利用鼠胚實驗對新建人類輔助生殖實驗室進行質量控制分析
屈春鳳,莫鳳明,蔣軍松,韋福慶,韋海燕
(廣西河池市人民醫院生殖醫學科,河池 547000)
體外受精-胚胎移植(IVF-ET)是一項有效治療不孕不育的人類輔助生殖技術(ART),而IVF實驗室好比一座加工廠,對IVF結局有著極為重要的影響[1]。相對于體內,體外培養的配子/胚胎脫離了母體自身保護,不具備任何保護屏障,對體外微環境的變化非常敏感,有可能會影響其發育潛能。因此,在輔助生殖全過程中需要有嚴格的實驗室質量控制系統與質量保障系統為配子和胚胎的生長發育提供一個相對穩定的場所。那么,對于新建IVF實驗室在啟用前,更應該全方位地監督和檢測各個環節,以建立穩定、可靠的培養體系,保證胚胎的質量。鼠胚實驗(mouse embryo assay,MEA)是目前最常用于實驗室培養液、耗材及設備質量控制的生物檢測方法,適用于新建或新啟動周期的IVF實驗室質量控制[2]。我院IVF胚胎實驗室于2016年初建成,啟用前對其進行了為期1個月的“熱處理”[3]后,自6月至11月,在新實驗室環境下,我們利用昆明系小白鼠行體內外受精及胚胎培養實驗進行質控評估,為開展人類胚胎體外培養提供可靠的實驗依據及質量保障。現將實驗情況報道如下。
一、材料與方法
1. 實驗動物:6周齡雌性昆明系小白鼠、8周齡以上雄性昆明系小白鼠,均購自廣西醫科大學實驗動物中心,在控光(白天光照12 h,夜間黑暗12 h)、控溫(20~25℃)條件下適應性喂養一周后方用于實驗。
2. 試劑與設備:取胚胎處理液G-MOPS、洗精受精液G-IVF、卵裂胚培養液G1、囊胚培養液G2、人血清白蛋白HAS、石蠟油,均為瑞典Vitrolife 公司產品;Labotect CO2培養箱(德國);K-SYSTEMS三氣培養箱(丹麥);NIKON 解剖顯微鏡、NIKON 倒置顯微鏡(日本);K-SYSTEMS IVF工作站(丹麥);Labotect CO2濃度檢測儀(德國)等。
3. 小鼠超排卵[4]:將注射用血促性素(PMSG)和注射用絨促性素(HCG,均購自杭州動物藥品廠)配制成100 U/ml的溶液,分裝保存于-20℃。培養液均于使用前一天下午配制好后置于37℃、含6%CO2濃度培養箱過夜平衡,G-MOPS置于37℃恒溫箱平衡。雌鼠腹腔內注射PMSG 10 U/只,48 h后再腹腔內注射HCG 10 U/只。
4. 體外受精實驗:(1)卵母細胞的采集:HCG后15~16 h采用頸椎脫臼法處死雌鼠,無菌條件下取出輸卵管,于G-MOPS+10%HAS中沖洗3次,用1 ml注射器于體視鏡下輕輕刺破輸卵管膨大部使卵子團釋放出來,將其收集并轉移至G-IVF受精液中,于37℃、含6%CO2濃度培養箱中培養待授精。(2)精子的采集與獲能:采用頸椎脫臼法處死雄鼠,無菌條件下取出附睪尾,于G-MOPS+10%HAS中沖洗3次,用眼科鑷輕輕擠出精子,收集精子懸液加入裝有G-IVF液的試管底部,置于37℃、含6%CO2濃度培養箱中上游并獲能30~60 min。(3)體外受精與培養:收集獲能后上層精子于另一試管中,顯微鏡下觀察其活力及濃度,取適量精子懸液加入含有卵子團的G-IVF液中,使其終濃度約為1.5×106/ml,置于37℃、含6%CO2濃度培養箱中培養,授精4 h后將卵子移至另一含G-IVF液受精皿中繼續培養。
5. 體內受精實驗:HCG后將雌雄小鼠按1∶1合籠,次日早上觀察雌鼠是否見陰栓。觀察到陰栓的雌鼠以頸椎脫臼法處死,無菌條件下取出輸卵管,于G-MOPS+10%HAS中沖洗3次,用1 ml注射器于體視鏡下輕輕刺破輸卵管膨大部使合子釋放出,將其收集并轉移至G-IVF受精液中,于37℃、含6%CO2濃度培養箱中培養。
6. 原核及卵裂期胚胎的觀察與培養(圖1):D0:下午原核觀察;D1:上午2細胞期胚胎觀察,并將其轉至已過夜平衡的卵裂胚培養液中繼續培養;D2:上午4細胞期胚胎觀察,下午8細胞期胚胎觀察,并轉至已過夜平衡的囊胚培養液中繼續培養;D3:上午桑椹期胚胎觀察;D4:上午早期囊胚觀察;D5~D6:上午囊胚觀察。
7. 數據分析:采用統計學軟件SPSS 19.0進行數據分析,計數資料采用χ2檢驗,檢驗水準α=0.05。P<0.05為差異有統計學意義。
二、結果
1. 體外受精實驗結果:共進行了25個體外受精周期實驗,總獲卵1 023個,其中原核受精胚共823個,受精率為80.4%,卵裂率為95.1%,2-細胞囊胚形成率為77.1%(表1)。
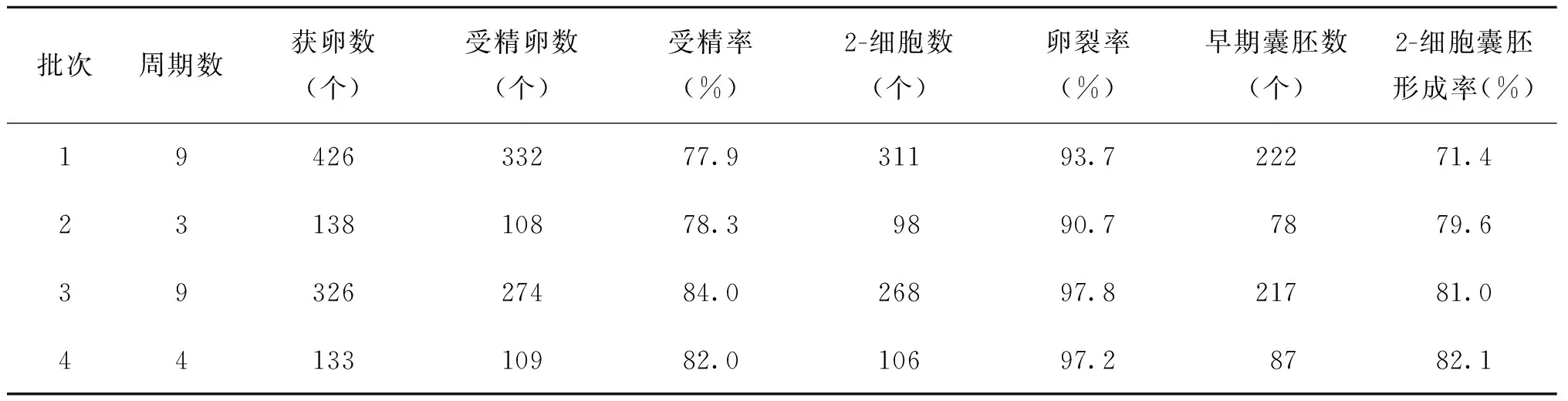
表1 昆明系小白鼠體外受精及胚胎培養實驗結果
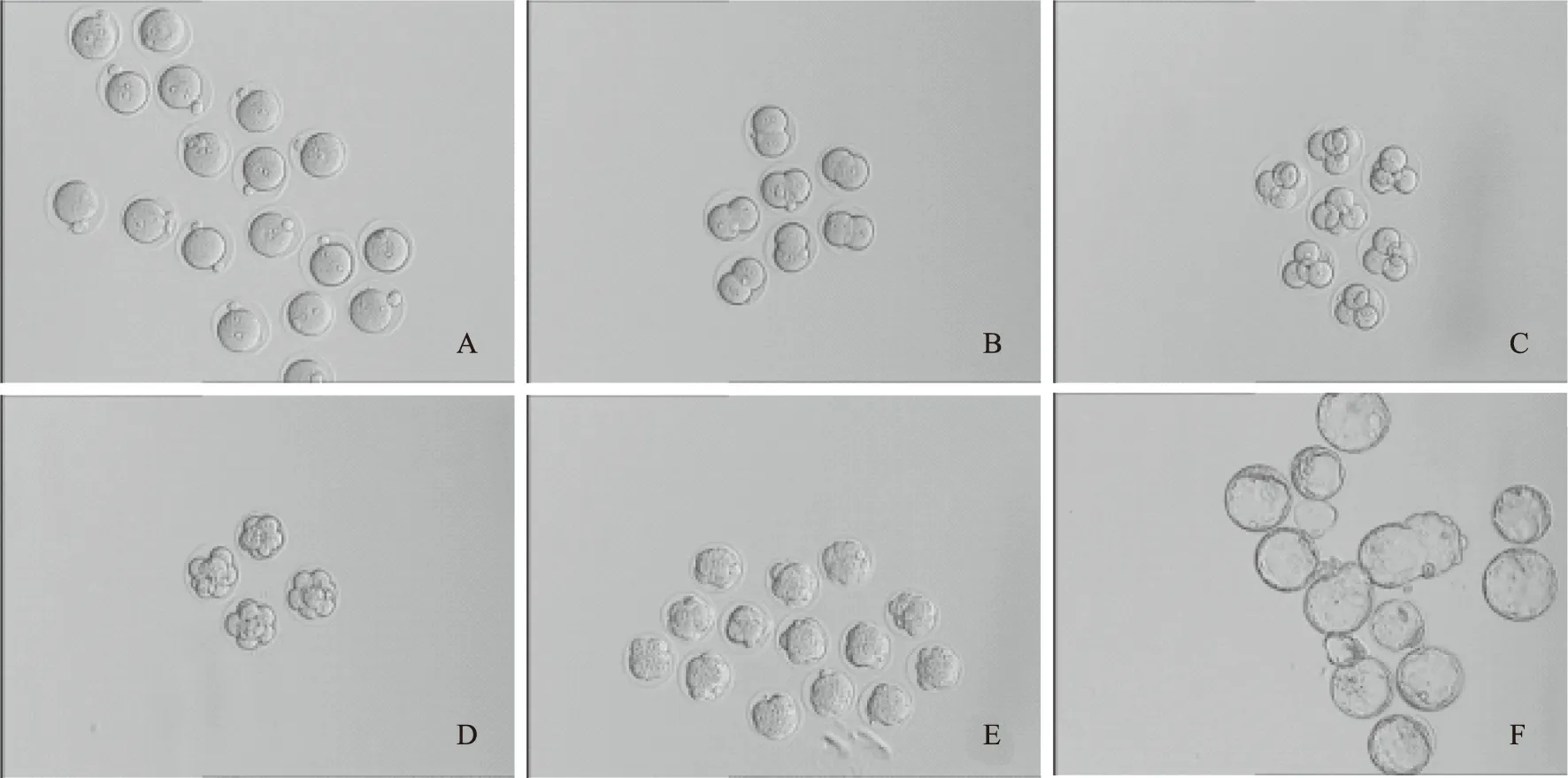
A:合子;B:2-細胞胚胎;C:4-細胞胚胎;D:8-細胞胚胎;E:桑葚胚;F:囊胚圖1 不同發育階段的小鼠胚胎(×10)
2.體內受精實驗結果:共進行了17個體內受精周期實驗,共獲卵642個,其中原核受精胚513個,受精率79.9%,卵裂率為97.1%,2-細胞囊胚形成率為80.9%(表2)。
3.兩組實驗小鼠胚胎體外培養結果比較:體內受精組與體外受精組相比,其受精率、卵裂率及2-細胞囊胚形成率兩組間差異均無統計學意義(P>0.05)(表3)。
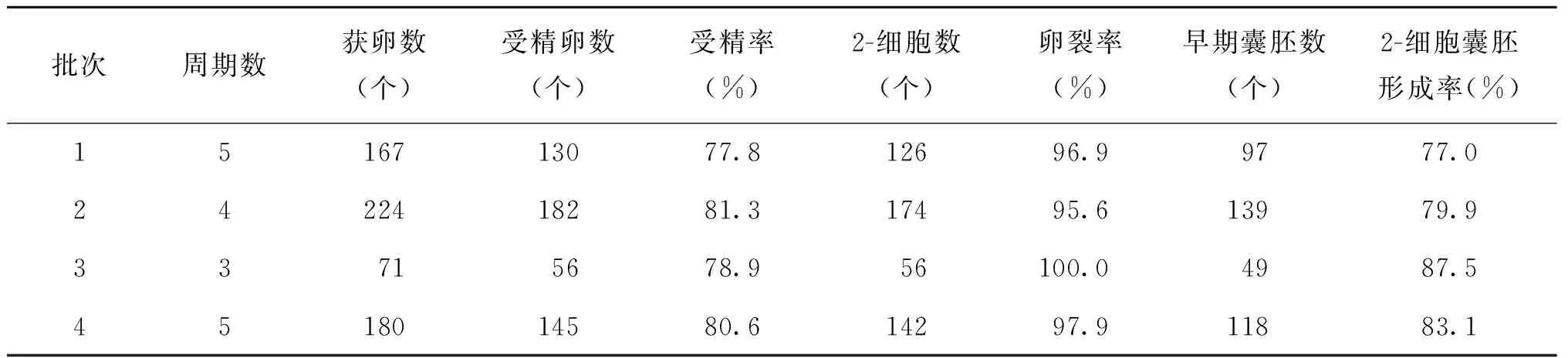
表2 昆明系小白鼠體內受精及胚胎培養實驗結果
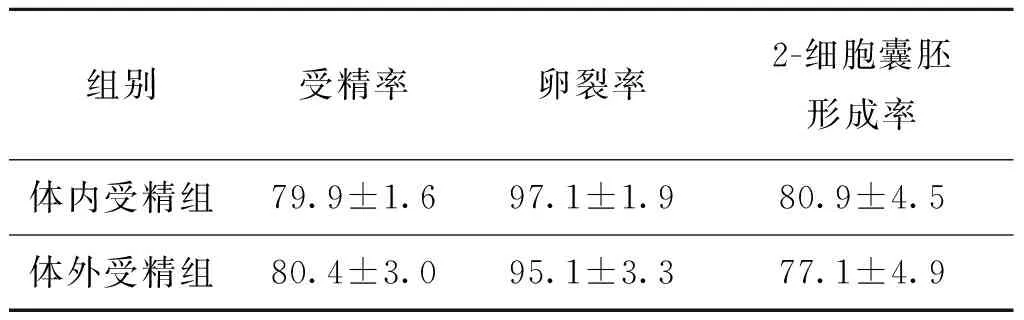
表3 兩組實驗小鼠胚胎體外培養結果比較(%)
三、討論
輔助生殖技術與其他學科最大的區別在于其對胚胎實驗室的依賴性和協同性。因此,胚胎實驗室是ART實施的重要支撐點,是保證ART成功的重要核心條件。實驗室的質量控制系統不僅能確保結果的穩定性,而且還可追蹤實驗室操作事件[5]。胚胎體外受精與培養是一種人工模擬輸卵管、子宮環境的過程,所有直接或間接接觸配子和胚胎的用品及環境,如溫度、濕度、CO2濃度、pH、滲透壓、離子濃度、塵埃、揮發性有機物(VOC)等均有可能存在危害胚胎的因素[6-7]。目前,MEA是評估IVF實驗室培養體系最為廣泛應用的方法,不僅能夠反映胚胎的發育潛能,同時還能監測胚胎實驗室整體的培養環境條件及操作技能,如空氣質量、溫濕度、培養液、耗材、培養箱、氣體以及技術人員操作水平等[8-9]。
本研究利用昆明系小白鼠行體內、體外受精兩種方法進行實驗,對本中心新建的輔助生殖實驗室培養環境、培養系統及技術員操作水平進行了全面的質量控制。我們的實驗結果表明,無論是小鼠體內或體外獲得的原核受精胚,皆能在體外培養發育至囊胚階段,胚胎發育狀況良好,且受精率(79.9% vs. 80.4%)、卵裂率(97.1% vs. 95.1%)、2-細胞囊胚形成率(80.9% vs. 77.1%)相比較,兩組間差異無統計學意義(P>0.05),其囊胚率比國內文獻報道[10-11]的偏低,但各項指標均符合人類輔助生殖實驗室質控標準[2,12-13]。以上結果說明本實驗室培養體系以及技術人員的操作水平已合格,能夠繼續開展人類IVF技術項目。
在整個實驗過程中,會有多種因素影響到胚胎的生長發育。從表1、表2可見,前兩個批次周期的受精率和囊胚形成率低,波動較大。分析其原因可能是:(1)實驗初期,技術人員操作技術不夠熟練,體外操作時間過長,導致培養液溫度、滲透壓等改變,進而影響了后續胚胎發育;(2)熱臺溫度設置時欠考慮培養皿熱傳導和熱丟失,造成溫度波動,可能導致了胚胎不可逆的損傷。溫度對卵子的影響是顯而易見的,溫度的變化會影響卵子內部一些結構的變化,其主要影響紡錘體的形態。有學者通過對加溫裝置的改進發現,若微滴內溫度保持在37℃,在更多的卵子內會觀察到紡錘體的存在,并且可顯著提高受精率和懷孕率;(3) 觀察的時間和次數增加,導致卵子和胚胎體外曝光的時間延長。相關的研究發現,輔助生殖中光照影響早期胚胎發育[14]。針對發現的問題,我們及時地進行了糾正,隨著操作技術的不斷嫻熟,后續實驗的受精率、卵裂率及囊胚形成率也在提高。但在實驗中我們發現,同批次小鼠,同樣的培養環境,同樣批號的試劑、促排藥物等,同樣的操作技術,其實驗結果也會出現波動,考慮到胚胎體外受精及培養受諸多因素的影響,其可能與精子及卵子的質量有關,或者與雌鼠的發情周期有關[15],隨著周齡增長雌雄小鼠的配子質量亦會下降,尤其是雌鼠對促排的效果明顯降低,因此在實驗中,我們盡量使用適齡的雌雄小鼠進行實驗,以期達到理想的效果。
通過鼠胚實驗,我們技術人員的操作水平及熟練程度得到了很大的鍛煉和提高,但在保證實驗室規章制度以及操作章程符合要求的情況下,一些細微之處也不容忽視。在實驗中我們注意到,培養箱的打開時間和次數也會影響到囊胚形成率,這與相關研究[16]一致。因此,在今后工作中,需謹慎對待每一項操作規程,不斷總結經驗,提升技術,保證人類IVF技術實施的可靠性與穩定性。
總之,對于新建或新啟動周期的IVF實驗室,為了保證培養環境及培養系統的可靠性,利用鼠胚實驗對影響配子受精及胚胎發育的因素進行質量控制是有必要的。
【參考文獻】
[1] Sun H,Chartier D,Leblanc N,et al. Intracellular calcium changes and tachycardia-induced cont ractile dysfunction in canine atrial myocytes [J].Cardiovasc Res,2001,49:751-761.
[2] 黃國寧,劉東云,韓偉.輔助生殖技術實驗室的建設及其質量控制[J].中國實用婦科與產科雜志,2010,26:755-758.
[3] 李媛.人類輔助生殖實驗技術[M].北京:科學出版社,2008:48-49.
[4] 孫青原,陳大元,譯.小鼠胚胎操作實驗手冊[M].北京:化學工業出版社,2006:124-125.
[5] Gardner DK,Reed L,Linck D,et al. Quality control in human in vitro fertilization[J].Semin Reprod Med,2005,23:319-324.
[6] 黃國寧,孫海翔. 體外受精-胚胎移植實驗室技術[M].北京:人民衛生出版社,2012:15-37.
[7] 靳鐳,任新玲.實驗室因素對胚胎發育和后代的影響[J].生殖醫學雜志,2017,26:403-408.
[8] Stamatkin CW,Roussev RG,Stout M,et al. Preimplantation factor(PIF) correlates with early mammalian embryo development-bovine and murine models[J].Reprod Biol Endocrinol,2011,9:63. doi: 10.1186/1477-7827-9-63.
[9] 杜湧瑞,張云山.質量管理系統在體外受精實驗室中的應用[J].國際生殖健康計劃生育雜志,2013,2013:498-501.
[10] 高亞可,杜姍姍.新建輔助生殖實驗室的鼠胚報告[J].廣西醫學,2016,38:304-307.
[11] 侯文文,胡衛華,吳滿意.新建IVF實驗室使用前的生物學檢測[J].安徽醫學,2013,34:1062-1065.
[12] 劉東云,韓偉,黃國寧.如何進行IVF實驗室的質控[J].廣東醫學,2010,31:2481-2483.
[13] Revil T,Gaffney D,Dias C,et al. Alternative splicing is frequent during early embryonic development in mouse[J].BMC Genomics,2010,11:399.doi: 10.1186/1471-2164-11-399.
[14] 劉超杰,鹿麗娜,祝獻民,等.輔助生殖中光照影響早期胚胎發育的研究進展[J].中華醫學雜志,2017,97:1516-1520.
[15] 朱娜,賈洪響,劉曉坤,等.小鼠發情周期卵泡發育動態及其對超數排卵的影響[J].動物學研究,2012,33:276-282.
[16] Gardner DK,Lane M.Alleviation of the “2-cell block”and development to the blastocyst of CF1mouse embryos:role of amino acids,EDTA and physical parameters [J]. Hum Reprod,1996,11:2703-2712.

