糖尿病心肌病患者內源性抗氧化體系及氧化應激水平
齊曉丹 常凌峰 于海濤 劉穎 高勇 林樹東 閆曉光 許冬霞 張春晶
1齊齊哈爾醫學院(161006黑龍江齊齊哈爾);2齊齊哈爾醫學院附屬第三醫院(161006黑龍江齊齊哈爾);3齊齊哈爾市第一醫院(161006黑龍江齊齊哈爾)
糖尿病患者長期處于高糖環境下,氧化應激增強,誘導心肌細胞凋亡和心肌功能降低,而引起糖尿病心肌病(diabetic cardiomyopathy,DCM)[1-2],DCM發病率高,危害大,日益受到研究者的廣泛關注[3]。DCM發病機制涉及糖脂代謝紊亂、胰島素抵抗、氧化應激、心臟自主神經病變、心肌細胞凋亡等,其中心肌細胞氧化應激增強是DCM較早期的分子事件[4]。
糖尿病狀態下氧化還原狀態失衡,也會引起血液中一系列內源性抗氧化物質的改變,其中內源性抗氧化肽肌肽和谷胱甘肽系統是心肌細胞氧化還原體系的重要組成成分[5],其會如何變化及程度如何未見報道。本研究探討DCM患者血清中內源性肌肽、谷胱甘肽系統及氧化應激的水平,分析DCM患者內源性抗氧化體系——肌肽、谷胱甘肽系統與氧化應激之間的關系。闡明內源性抗氧化體系對糖尿病心肌病變保護作用的分子生物學機制,以期為DCM的防治提供一個新的思路和理論依據。
1 資料與方法
1.1 一般資料 收集2014年6月至2016年9月齊齊哈爾醫學院附屬第三醫院體檢健康者(對照組)102例,男50例,女52例;2型糖尿病患者(DM組)96例,男49例,女47例;確診DCM患者(DCM組)74例,男38例,女36例。納入標準:(1)符合2013年中華醫學會糖尿病學分會制定的DCM和T2DM 診斷標準[6];(2)患者知情同意并簽署知情同意書。所有患者均行空腹血糖(FPG)、餐后2 h血葡萄糖(2hPG)、血清總膽固醇(TC)、血清三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、胰島素(FINs)、C肽、糖化血紅蛋白(HbA1c)[7]等檢測。
1.2 方法 采用酶聯免疫吸附法(ELISA)測定血清人肌肽含量,微量酶標法測定總谷胱甘肽(T?GSH)、還原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)水平,比色法測定GSH過氧化物酶(GSH?Px)和谷胱甘肽硫轉移酶(GST)活性及谷胱甘肽還原酶活性系數(GRAC),硝酸還原酶法測定一氧化氮(NO)含量,鉬酸顯色法測定過氧化氫(H2O2)含量,比色法測定一氧化氮合成酶(NOS)和過氧化氫酶(CAT)活性,試劑盒購自南京建成生物有限公司。結果以美國BioTek Elx800多功能酶標儀測定吸光度值(A值)。
1.3 統計學方法 采用GraphPad Prism5軟件進行數據分析。數據以均數±標準差表示,數據處理組間比較用F檢驗,兩兩比較用q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料比較 各組之間資料進行比較分析,與對照組相比較,DM組、DCM組的例數、性別、TC、TG、LDL、HDL指標比較,差異無顯著性(P>0.05)。與對照組相比較,DM組、DCM組的BMI、FPG、2hPG、FINs、C肽、HbA1c等指標明顯升高(P<0.05),見表 1。
2.2 各組血清肌肽含量的變化 對照組血清肌肽平均值正常,DM組、DCM組平均值均低于正常。DM組與對照組相比有所降低,但差異無統計學意義(P>0.05)。DCM組與對照組相比降低,差異有統計學意義(P>0.05),DCM組與DM組相比較無顯著變化(P>0.05)。結果顯示,DM和DCM時患者機體氧化應激增強,抗氧化肽消耗增加,血清中的抗氧化肽肌肽含量降低。見圖1。
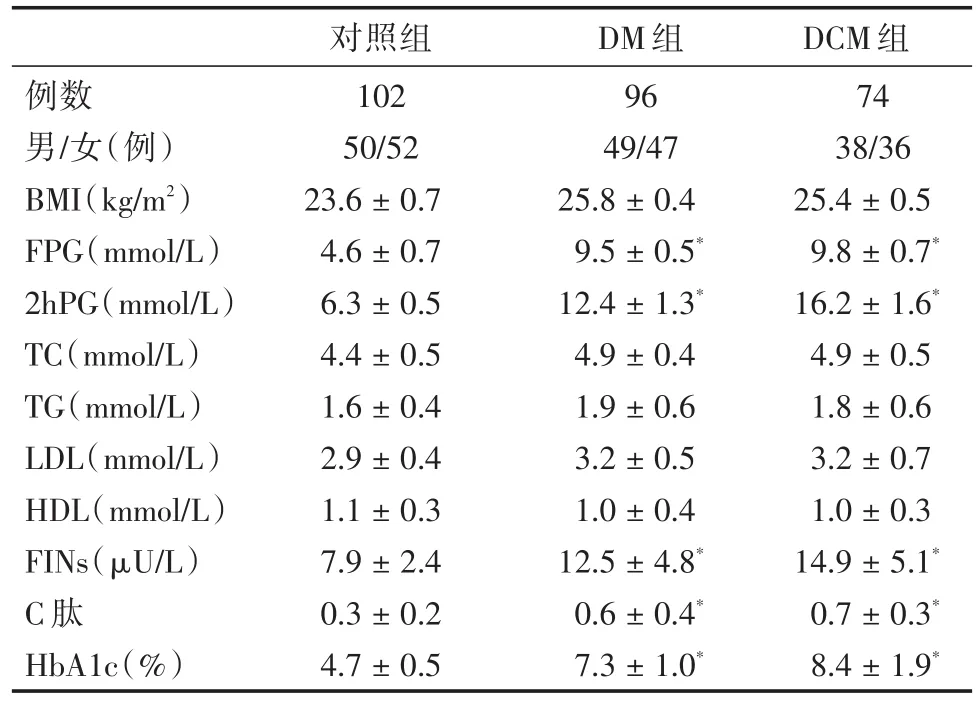
表1 各組一般資料對比分析Tab.1 Comparison analysis of clinical data among the groups x±s
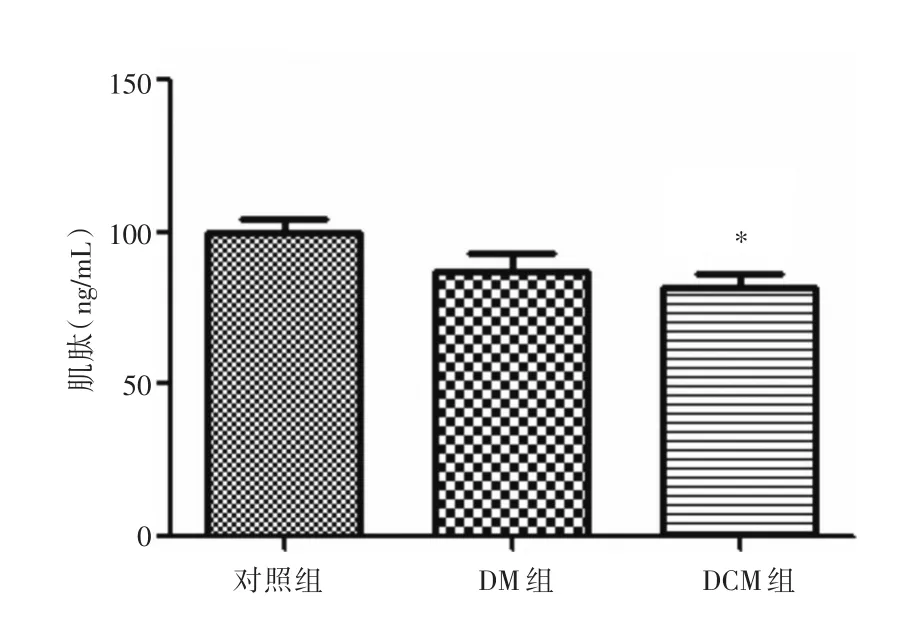
圖1 ELISA法檢測人血清肌肽含量Fig.1 To detect human serum carnosine by ELISA method
2.3 各組血清谷胱甘肽系統水平測定 見表2。 結果顯示,DM和DCM時機體谷胱甘肽系統異常,還原型GSH降低,氧化型GSSG升高,GSH/GSSG比值降低,GRAC及GST等活性降低,表明機體氧化水平增強,抗氧化能力減弱,氧化還原狀態失衡。
2.4 各組氧化還原水平分析 與對照組相比較,DCM組NO含量較對照組顯著升高(P<0.01);各組間TNOS活性差異無顯著性;iNOS活性和H2O2含量DCM組有所升高(P<0.05);DM組和DCM組CAT活性均顯著降低(P<0.01),見圖2。結果表明,DM和DCM時體內的氧化劑及自由基等增加,誘導氧化應激。
表2 各組人血清谷胱甘肽系統水平分析Tab.2 Glutathione system level analysis in human serum among each group ±s
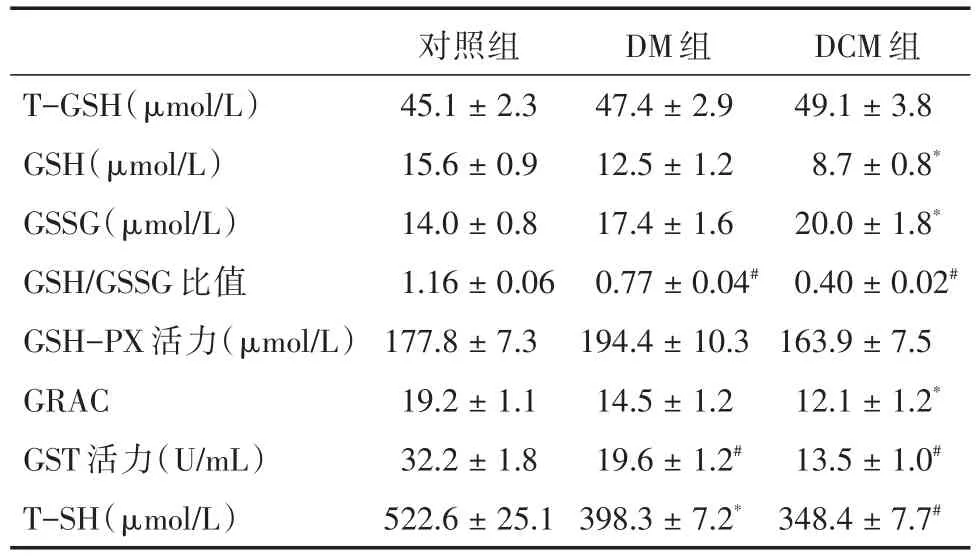
表2 各組人血清谷胱甘肽系統水平分析Tab.2 Glutathione system level analysis in human serum among each group ±s
注:與對照組相比,*P<0.05,#P<0.01
T-GSH(μmol/L)GSH(μmol/L)GSSG(μmol/L)GSH/GSSG比值GSH-PX活力(μmol/L)GRAC GST活力(U/mL)T-SH(μmol/L)對照組45.1±2.3 15.6±0.9 14.0±0.8 1.16±0.06 177.8±7.3 19.2±1.1 32.2±1.8 522.6±25.1 DM組47.4±2.9 12.5±1.2 17.4±1.6 0.77±0.04#194.4±10.3 14.5±1.2 19.6±1.2#398.3±7.2*DCM組49.1±3.8 8.7±0.8*20.0±1.8*0.40±0.02#163.9±7.5 12.1±1.2*13.5±1.0#348.4±7.7#
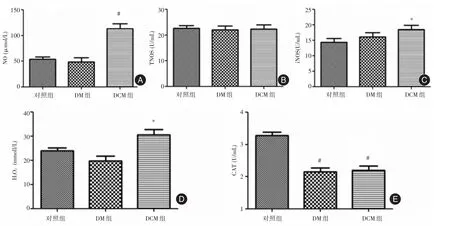
圖2 各組氧化還原水平分析Fig.2 Redox level analysis among each group
3 討論
DCM的發生機制主要涉及以下幾種因素:鈣離子平衡紊亂、線粒體功能失調、代謝底物利用異常等[8],而氧化應激增強是各因素的中心環節[9]。糖尿病狀態下心肌細胞氧化應激損傷,可給予外源性抗氧化劑進行治療,但是由于其本身的毒副作用,其療效并不十分理想。因而,內源性抗氧化劑成為當今治療及預防DCM的靶點,首先我們必須清楚糖尿病及DCM,患者體內這些內源性抗氧化劑水平是如何變化的,程度如何?
糖尿病狀態下會引起一系列內源性抗氧化體系的改變,其中抗氧化肽是心肌細胞氧化應激體系的重要組成成分。生物體內的天然抗氧化肽主要為肌肽和谷胱甘肽。肌肽(carnosine)是一種天然的、具有高效生物活性的水溶性二肽,具有很強的抗氧化活性[10],肌肽能夠抑制生物體內整個過氧化鏈中的每一步氧化反應。然而,糖尿病和DCM患者血清肌肽水平如何?目前未見報道。劉亞麗等應用HPLC?UV分析心肌肌肉組織中內源性肌肽濃度,糖尿病大鼠組與正常大鼠組相比較顯著降低[11]。本研究結果顯示,DM和DCM患者血清肌肽水平降低,其中DCM組與對照組相比較,差異具有統計學意義(P<0.05),結果表明DCM時抗氧化能力降低,氧化應激失衡。本研究結果與上述報道相一致,并進一步在DCM患者機體內進行證實。
谷胱甘肽系統是機體重要的抗氧化體系,在維持機體還原狀態,防止自由基損傷等方面起著重要作用[12]。DM患者血清還原型谷胱甘肽(GSH)、GSH 過氧化物酶(GSH?Px)和谷胱甘肽還原酶(GR)的活性降低,而DCM患者血清谷胱甘肽系統相關指標的水平未見報道。本研究結果顯示,DM和DCM時機體谷胱甘肽系統異常,T?GSH含量差異無顯著性,還原型GSH降低,氧化型GSSG升高,GSH/GSSG比值降低,GRAC及GST等活性降低,表明機體氧化水平增強,抗氧化能力減弱,氧化還原狀態失衡。
NO是內皮源性舒張因子,同時也是一種自由基,對心臟具有損傷與保護雙重作用。一氧化氮合酶(NOS)有內皮型(eNOS)、誘導型(iNOS)和神經元型(nNOS)三種亞型,在心肌中均有表達,eNOS、nNOS合成的NO對心臟具有保護作用,iN?OS合成的NO對心臟具有損傷作用,是DCM及心肌細胞凋亡的重要誘導因子。本研究結果顯示,NO含量DCM組較對照組顯著升高,TNOS活性差異無顯著性,iNOS活性DCM組較對照組顯著升高。表明DCM時氧化應激增強,心肌細胞受到嚴重損傷。過氧化氫是一種活性氧,可被過氧化氫酶分解。本研究結果與以往報道相一致,DCM時氧化應激增強ROS生成增加,過氧化氫增加同時過氧化氫酶活性下降。
肌肽和谷胱甘肽是生物體內主要的天然抗氧化肽[13?15],此外還有大量抗氧化蛋白如谷氧還蛋白、硫氧還蛋白等。谷胱甘肽是谷氧還蛋白的輔因子,維持谷氧還蛋白還原狀態。氧化脅迫或能量缺失時GSH缺少、GSSG積累,可導致氧化態谷氧還蛋白1增加。本研究只檢測了DM和DCM患者血清中肌肽和谷胱甘肽系統的變化,今后我們會進一步檢測抗氧化蛋白的水平,并探討這些內源性抗氧化劑之間的作用關系,為尋找高效的內源性抗氧化體系奠定理論基礎。
參考文獻
[1] YILMAZ S,CANPOLAT U,AYDOGDU S,et al.Diabetic car?diomyopathy;summary of 41 years[J].Korean Circ J,2015,45(4):266?272.
[2] 鄧夢媛,王海英.糖尿病心肌保護機制的研究進展[J].實用醫學雜志,2017,33(19):3323?3326.
[3] BUGGER H,BODE C.The vulnerable myocardium.Diabetic cardiomyopathy[J].Hamostaseologie,2015,35(1):17?24.
[4] MISHRA P K,YING W,NANDI S S,et al.Diabetic Cardiomy?opathy:An Immunometabolic Perspective[J].Front Endocrinol(Lausanne),2017,8:72.
[5] BAYE E,UKROPCOVA B,UKROPEC J,et al.Physiological and therapeutic effects of carnosine on cardiometabolic risk and disease[J].Amino Acids,2016,48(5):1131?1149.
[6] 田莉,常向云,李軍,等.石河子社區2型糖尿病患者藥物治療3年隨訪研究[J].實用醫學雜志,2017,33(18):3123?3127.
[7] 彭海林,金梅,錢錦,等.HbA1C在住院患者隱性糖尿病篩查中的應用[J].實用醫學雜志,2017,33(14):2386?2388.
[8] LEE W S,KIM J.Diabetic cardiomyopathy:where we are and where we are going[J].Korean J Intern Med,2017,32(3):404?421.
[9] KAYAMA Y,RAAZ U,JAGGER A,et al.Diabetic cardiovas?cular disease induced by oxidative stress[J].Int J Mol Sci,2015,16(10):25234?25263.
[10] PROKOPIEVA V D,YARYGINA E G,BOKHAN N A,et al.Use of carnosine for oxidative stress reduction in different pathol?ogies[J].Oxid Med Cell Longev,2016:2939087.
[11] LIU Y L,SU D,ZHANG L,et al.Endogenous L?Carnosine lev?el in diabetes rat cardiac muscle[J].Evid Based Complement Al?ternat Med,2016:6230825.
[12] LEMIRE J,ALHASAWI A,APPANNA V P,et al.Metabolic defence against oxidative stress:the road less travelled so far[J].J Appl Microbiol,2017,123(4):798?809.
[13] PETERS V,LANTHALER B,AMBERGER A,et al.arnosine metabolism in diabetes is altered by reactive metabolites[J].Amino Acids,2015,47(11):2367?2376.
[14] BAYE E,UKROPCOVA B,UKROPEC J,et al.Physiological and therapeutic effects of carnosine on cardiometabolic risk and disease[J].Amino Acids,2016,48(5):1131?1149.
[15] QI X,XU A,GAO Y,et al.Cardiac damage and dysfunction in diabetic cardiomyopathy are ameliorated by Grx1[J].Genet Mol Res,2016,15(3):15039000.

