基于miR- 21/Smad7探討芍藥苷在抗血管緊張素Ⅱ誘導心肌肥大中的作用
張會超,徐里,芮浩淼,曹程浩,楊鳳鳴,袁彬
(1.河南省中醫院 心病科,河南 鄭州 450000; 2.河南中醫藥大學 基礎醫學院,河南 鄭州 450000;3.河南中醫藥大學 研究生院,河南 鄭州 450000)
心肌肥厚是指心臟在各種生理以及病理因素的刺激下,為適應做功、維持心臟功能而表現出的體積與質量的增加,持續性心肌肥厚是心力衰竭及突發心源性死亡的主要原因,預防及逆轉心肌細胞肥厚及心室重構是治療心力衰竭的首要方法[1- 2]。芍藥苷(Pae)是從中藥毛莨科植物芍藥中分離獲得的一種單萜類糖苷化合物,是芍藥的主要活性成分之一,具有抑制心室重塑、減輕缺血缺氧對心肌的損傷、改善心衰患者心功能等心臟保護作用[3- 4],Pae對心肌細胞肥大的作用及其機制的研究目前尚不充分。微小RNA(microRNAs,miRs)是影響心臟發育及心臟疾病進展的重要調節器,大量研究顯示miRs在心肌肥大的過程中發揮重要作用,其中異常表達的microRNA- 21(miR- 21)與心肌肥厚、心肌細胞纖維化、心室重構及心臟功能的改善密切相關[5- 6]。然而,miR- 21是否參與了Pae防治及逆轉心肌細胞肥大,發揮保護心肌細胞的作用及其潛在機制研究尚未見報道。本研究通過模擬心肌細胞肥大模型,基于miR- 21調控探討Pae在抵抗血管緊張素Ⅱ(Ang- Ⅱ)誘導的心肌細胞肥大過程中的作用及其潛在機制。
1 材料與方法
1.1 乳鼠心肌細胞培養及分組
新生1~3日齡SD大鼠(購于北京維通利華實驗動物技術有限公司)常規消毒后置于超凈工作臺開胸迅速取出心臟,分離心室后使用預冷的D- Hanks液沖洗3次,剪成約1 mm3大小的碎塊后用0.2% 胰蛋白酶和0.1%膠原酶B 的混合消化液37 ℃水浴分次消化。采用差速貼壁原理分離去除非心肌細胞,調整細胞密度為3×105L-1,使用含5% 胎牛血清的改良Eagle培養基(DMEM) 置于二氧化碳培養箱中常規培養48 h后換用無血清培養基適應性培養10 h。實驗分組:對照組(n=9);Ang- Ⅱ組(Ang- Ⅱ, Sigma, USA,150 nmol·L-1,n=9);Pae組(Pae,北京博奧森生物技術有限公司,25 μmol·L-1,n=9);Pae+Ang Ⅱ組,(n=9)。藥物處理24 h后收集細胞進行各項指標的測定。
1.2 心肌細胞轉染
心肌細胞以3×105孔-1接種于6孔板,待細胞達到70%~80%融合時進行轉染,按照試劑盒(Cell signaling, USA)提供的說明書指示,將Smad7 siRNA、Lipofectamine 2000稀釋于100 μl無血清的基礎培養基opti- MEM中,室溫放置5 min。隨后將稀釋的siRNA溶液加入脂質體溶液中,輕緩混勻,室溫放置20 min;用基礎培養opti- MEM漂洗2次,加入無血清基礎培養基opti- MEM 1 ml·孔-1;將siRNA- 脂質體復合物加入細胞中,輕輕混勻,孵育6 h后換完全培養基,48 h后收集各組細胞待測。同法轉染miR- 21 模擬物(mimic)、miR- 陰性對照(NC)及siRNA- NC。
1.3 雙熒光素酶報告檢測
PCR擴增Smad7 mRNA 3′- UTR,將擴增產物克隆到pMD18- T載體構建含野生型Smad7基因載體(Smad7- WT)。根據miRBase預測并利用點突變方法構建Smad7- 3′UTR 突變載體(Smad7- Mut),PsiCHECKTM- 2 載體(Promega,美國) 含螢火蟲和海腎雙熒光素酶。將構建的載體Smad7- WT UTR、Smad7- Mut進行XhoⅠ和NotⅠ雙酶切,將野生型及含有突變位點的ROCK2- 3′UTR 克隆置于psiCHECKTM- 2 載體的海腎熒光素酶開放讀碼框架的下游,構建含該野生及突變載體的雙熒光素酶報告載體。將所構建的熒光素酶報告載體與miR- 21(miR- 21 mimic)表達載體或者陰性對照(miR- NC)載體共轉染至HEK- 293細胞,轉染后24 h收集細胞進行雙熒光素酶報告基因測定。計算公式:相對熒光值=螢火蟲熒光素酶熒光值/海腎熒光素酶熒光值。
1.4 心肌細胞表面積大小的檢測
心肌細胞經Ang Ⅱ處理24 h后,根據試劑盒(Santa Cruze,USA)提供的操作說明,攜帶熒光基團的染料鬼筆環肽(fluorescent phallotoxins)染心肌細胞骨架蛋白F- actinin,4′,6- 二脒基- 2- 苯基吲哚(DAPI)染核,Zeiss (AX10) 倒置熒光顯微鏡進行拍照,隨機選取10個視野,測量100個細胞進而計算細胞的表面積,取平均值。每組重復測量3次。
1.5 Western blotting檢測
將培養的各組心肌細胞用0.05%胰蛋白酶消化,PBS洗滌3次;加入450 μl蛋白裂解液常規方法裂解細胞,BCA 法測定蛋白濃度,樣品經10%聚丙烯酰胺凝膠(SDS)電泳后轉至聚偏氟乙烯(PVDF)膜,封閉后兔抗小鼠一抗GAPDH (1∶2 000,Cell Signaling,美國)、兔抗鼠心房利尿鈉肽(ANP)(1∶1 000, Santa Cruz, 美國)及腦利尿鈉肽(BNP)(1∶1 000,Santa Cruz,美國) 4 ℃孵育過夜,辣根過氧化物酶(HRP)標記山羊抗兔二抗,Western blotting檢測ANP及BNP蛋白表達, FluorChem Q凝膠成像系統(Alpha Innotech,美國)顯影,Scion Image圖像分析系統對條帶進行分析,目的蛋白的相對含量以目的蛋白與GAPDH條帶光密度的比值表示,每組重復檢測3次。
1.6 SYBR Green實時熒光定量PCR
Trizol(Invitrogen, 美國)抽提法提取細胞總RNA,紫外分光光度計測吸光度值確定RNA的濃度和純度。Quantscript RT kit反轉錄合成cDNA,采用SYBR Green Ⅰ(Invitrogen, 美國)熒光染料嵌合法20 μl反應體系,即10 μl SYBR Green實時PCR Master Mix、1 μl 0.2 μmol·L-1引物、2 μl cDNA及7 μl無菌雙蒸水。避光置于熒光定量PCR儀(ABI 7 500 Fast PCR)采集熒光信號檢測miR- 21及ANP、BNP mRNA表達,U6 (Mus musculus U6 small nuclear RNA)及GAPDH分別作為miR- 21及mRNA內參,ABI7500配套軟件采用2- ΔΔCт法處理數據。PCR擴增引物采用Oligo 6.0設計,由上海生工生物工程有限公司合成,引物及其序列見表1。
表1實時PCR引物序列
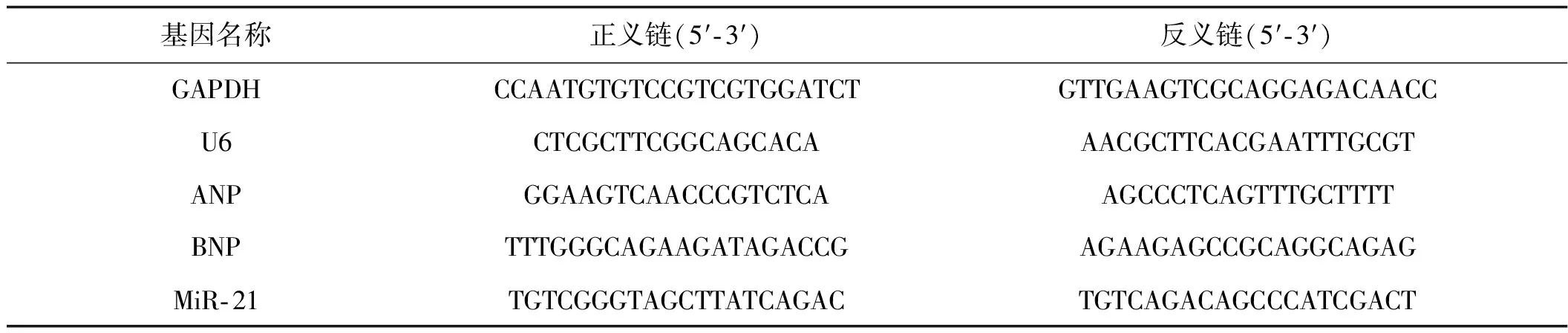
基因名稱正義鏈(5′?3′)反義鏈(5′?3′)GAPDHCCAATGTGTCCGTCGTGGATCTGTTGAAGTCGCAGGAGACAACCU6CTCGCTTCGGCAGCACAAACGCTTCACGAATTTGCGTANPGGAAGTCAACCCGTCTCAAGCCCTCAGTTTGCTTTTBNPTTTGGGCAGAAGATAGACCGAGAAGAGCCGCAGGCAGAGMiR?21TGTCGGGTAGCTTATCAGACTGTCAGACAGCCCATCGACT
1.7 統計學處理
應用SPSS 20.0統計軟件進行數據處理,計量資料以均數±標準差表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗分析,檢驗水準為雙側α=0.05,P<0.05為差異有統計學意義。
2 結 果
2.1 Pae能有效抑制Ang- Ⅱ誘導的心肌細胞肥厚
結果顯示,與對照組相比,Ang- Ⅱ處理能顯著增加心肌細胞表面積約1.3倍(P<0.05)。Pae處理能顯著抑制Ang- Ⅱ誘導的心肌細胞表面積增大,對心肌細胞表面積的抑制率約39%(P<0.05)(圖1A、B)。實時PCR及Western blotting結果顯示,與正常心肌細胞相比,Ang- Ⅱ組心肌細胞肥厚性標志基因ANP及BNP表達顯著增加,Pae預處理對Ang- Ⅱ誘導的細胞表面積增加及ANP、BNP表達的上調均具有顯著的抑制作用(均P<0.05) (圖1C、D)。
2.2 Pae能顯著降低Ang- Ⅱ誘導的肥厚性心肌細胞miR- 21表達
實時PCR檢測結果顯示,與對照組相比,Ang- Ⅱ組心肌細胞miR- 21相對表達量顯著上調(P<0.05),Pae處理后能顯著抑制Ang- Ⅱ誘導的miR- 21表達的增加(P<0.05) (圖2),提示Pae可能是通過抑制miR- 21表達的增加發揮抵抗心肌細胞肥大的作用。
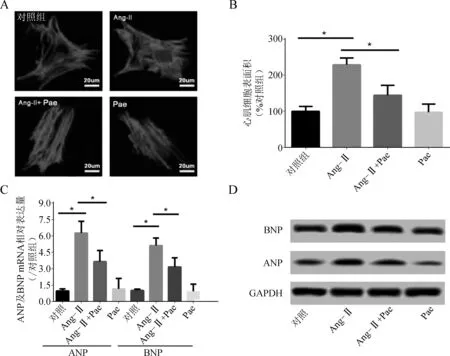
A、B.各組心肌細胞表面積,Scale bar=20 μm;C.ANP、BNP mRNA相對表達量;D.ANP、BNP蛋白表達 (*P<0.05)
圖1Pae對AngⅡ誘導的心肌細胞肥大效應的影響
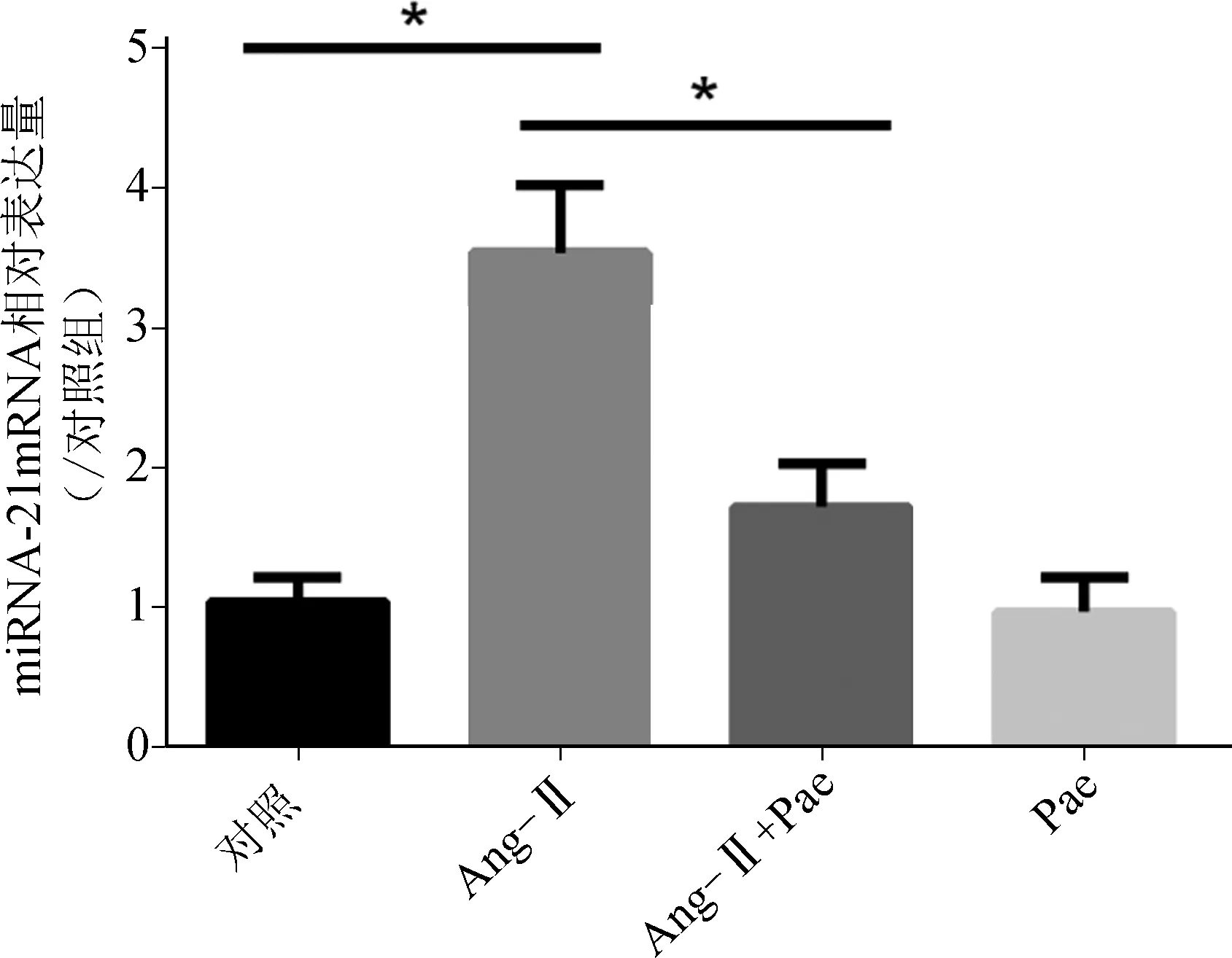
*P<0.05
圖2各組心肌細胞miR-21相對表達量
2.3 miR- 21介導Pae抵抗心肌細胞肥大的作用
結果顯示,與Ang- Ⅱ組相比,Pae預處理能顯著抑制心肌細胞相對表面積的增加,下調肥厚性標志基因ANF及BNP表達 (P<0.05) (圖3A、B、C),miR- 21 mimic 轉染后顯著削弱了Pae對Ang- Ⅱ誘導的細胞表面積及ANP、BNP表達增加的抑制作用(P<0.05) (圖3D),提示miR- 21介導了Pae對心肌細胞的保護作用。
2.4 miR- 21直接靶向Smad7介導Pae對心肌細胞肥大的抵抗作用
生物信息學(http://www.targetscan.org)預測分析顯示,Smad7 mRNA的3′- UTR存在miRNA- 21的結合序列(圖4A)。熒光素酶檢測顯示與miR- NC陰性對照相比,miRNA- 21過表達抑制Smad7 mRNA的3′- UTR載體的相對熒光素酶活性。而對Smad7的該序列進行突變(Mut)后這種抑制作用消失,證實miR- 21能靶向作用于Smad7 (圖4B)。
進一步檢測發現,與對照組相比,Ang- Ⅱ作用下伴隨著miR- 21表達的升高,心肌細胞Smad7 mRNA及蛋白表達顯著下降,Pae預處理可部分抵消該效應,而miR- 21 mimic轉染則削弱了Pae對Smad7表達的調控作用,提示Pae對Ang- Ⅱ誘導的心肌細胞肥大的抵抗作用可能是通過調控miR- 21表達,影響靶分子Smad7表達水平實現的(圖4C)。
2.5 Smad7調控Pae對心肌細胞肥大的抵抗作用
進一步分析Smad7在Pae抵抗Ang- Ⅱ誘導的心肌細胞肥大中的作用,結果如圖5所示,Pae能顯著增加Smad7蛋白表達(P<0.05)(圖5A),Smad7 siRNA轉染后顯著減弱了Pae對Ang- Ⅱ誘導的心肌細胞表面積及ANP、BNP mRNA及蛋白表達的降低,逆轉了Pae對Ang- Ⅱ誘導的心肌細胞肥厚的抵抗性保護作用(P<0.05) (圖5B、C、D),提示Smad7在Pae對抗心肌細胞肥厚中具有一定的調控作用。

A.各組心肌細胞相對表面積;B.ANP、BNP蛋白相對表達量;C.ANP、BNP mRNA相對表達量;D.miR- 21相對表達量(*P<0.05)
圖3miR-21介導Pae抵抗心肌細胞肥大的作用
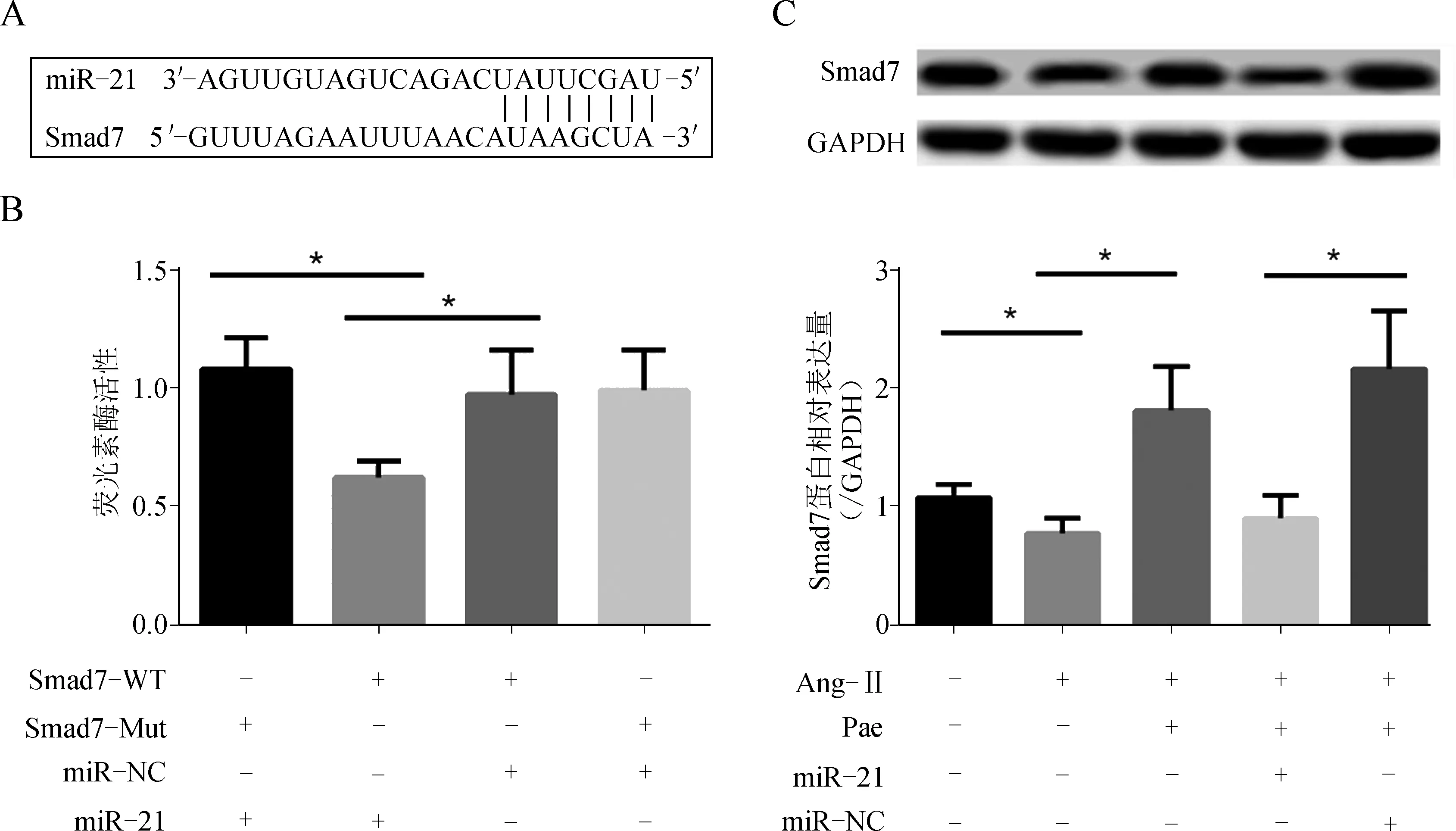
A、B.miR- 21與Smad7靶向關系;C.心肌細胞Smad7蛋白表達的變化(*P<0.05)
圖4miR-21靶向Smad7介導Pae對心肌細胞肥大的抵抗作用

A.各組心肌細胞Smad7蛋白表達的變化;B.各組心肌細胞相對表面積;C、D.ANP、BNP 蛋白及mRNA相對表達量(*P<0.05)
圖5Smad7調控Pae對心肌細胞肥大的抵抗作用
3 討 論
心肌肥大是心臟在各種病理因素刺激下通過增加室壁厚度來增加室壁張力的代償性反應,早期心肌肥厚有利于維持心臟的正常功能,然而持續性心肌肥厚會導致心力衰竭及突發性死亡。臨床數據顯示約1/3確診的心衰病人會在1年內死亡,心衰往往由心肌肥厚發展而來,因此對心肌肥厚機制的研究以及尋找預防和治療心肌肥厚的藥物具有重要意義[7]。Pae是從中草藥毛莨科植物芍藥的根莖中提取的一種單萜類糖苷化合物,具有抗氧化、抗炎、抗凝血、解痙鎮痛及免疫調節等作用[8]。對心血管疾病的預防與治療發揮著重要作用,能夠減輕缺血缺氧造成的心肌損傷,抑制梗死后心室重塑,通過抑制還原型輔酶Ⅱ(NAPDH)氧化酶的活性抑制心肌細胞凋亡[9]。此外,Pae還能夠抑制持續性壓力負荷下心臟病大鼠心肌收縮功能的下降和心肌壁厚度的增加[10]。本次研究顯示,Pae能有效逆轉Ang- Ⅱ誘導的心肌細胞表面積的增加以及心肌肥厚標志物ANP、BNP的表達,通過負性調控miR- 21解除對Smad7表達的抑制而發揮對心肌的保護作用。
MiR- 21是一種在進化上高度保守的單基因編碼的miRNA,廣泛表達于心臟、脾臟、小腸等器官,在心肌細胞的分化生長及心肌肥厚中發揮重要的調節作用[11]。既往研究證實miR- 21 抑制不僅能夠減緩心肌肥厚的進展,同時可以逆轉壓力負荷下的心室重構[12]。此外,miR- 21過表達能夠靶向作用于信號通路特異性抑制蛋白(Spry)2,誘導心肌細胞間特異性細絲狀縫隙連接的生成,參與促進心肌細胞肥厚及心室重構過程的進展[13]。與上述研究一致,本次研究發現Ang- Ⅱ誘導的心肌肥厚細胞miR- 21表達顯著增加,Pae可以通過降低miR- 21表達發揮一定的抗心肌細胞肥大的作用。心肌肥厚的進行性加重可導致心肌纖維化,繼而促進心肌肥厚進展,內皮—間葉組織轉化是心臟纖維化的主要來源,研究指出miR- 21通過PTEN/AKT通路參與TGF- β1介導的上皮間質化(EMT)過程[14]。這些研究進一步佐證miR- 21可增強EMT過程,增加心臟成纖維細胞數量,加重心肌細胞肥厚、心臟重塑及心力衰竭。
Smad7是Smad家族的一個重要的抑制性成員,不僅能直接與活化的TGF- β1受體結合,抑制Smad3的磷酸化,還能在細胞內競爭性結合Smad3,阻斷TGF- β1信號通路傳導,報道指出Pae能通過調節心臟、肺臟及腎臟TGF- β1/Smad信號通路發揮一定的抗炎、抗氧化、抗纖維化的保護性作用[15]。本次研究顯示,心肌細胞經Ang- Ⅱ處理后,miR- 21表達增加,伴隨Smad7表達的降低。Pae處理能逆轉Ang- Ⅱ處理后心肌細胞miR- 21表達的增加,增加Smad7表達,通過減弱miR- 21對Smad7的抑制,降低心肌肥厚細胞表面積及肥厚性標志ANP、BNP的表達,對心肌細胞肥厚的進展發揮明顯的抑制作用。
本次研究發現,Ang- Ⅱ誘導的肥厚性心肌細胞中miR- 21表達顯著增加,Pae能夠通過抑制miR- 21表達進而降低其對靶蛋白Smad7的抑制作用,降低心肌細胞表面積及心肌肥厚性標志物ANP、BNP的相對表達量,發揮對心肌的保護性作用。本研究明確了miR- 21/Smad7在Pae抵抗心肌細胞肥大過程中的作用,加深了對Pae在抵抗心肌肥厚研究方面的認識,同時為中醫藥在治療心血管疾病方面對miRs調控機制的深入研究提供了新的方向和理論支持。
[參考文獻]
[1] BELL D,CAMPBELL M,WANG X,et al.Adrenomedullin gene delivery is cardio- protective in a model of chronic nitric oxide deficiency combining pressure overload, oxidative stress and cardiomyocyte hypertrophy[J].Cell Physiol Biochem, 2010,26(3):383- 394.
[2] 于迎根,彭穎秀,史詠秋.慢性心衰患者心率減速力與室性心律失常的相關性研究[J].現代醫學,2016,44(8):1074- 1076.
[3] ZHAI J,GUO Y.Paeoniflorin attenuates cardiac dysfunction in endotoxemic mice via the inhibition of nuclear factor- kappaB[J].Biomed Pharmacother,2016,80:200- 206.
[4] HAN F,ZHOU D,YIN X,et al.Paeoniflorin protects diabetic mice against myocardial ischemic injury via the transient receptor potential vanilloid 1/calcitonin gene- related peptide pathway[J].Cell Biosci,2016,6:37- 40.
[5] YAN M,CHEN C,GONG W,et al.miR- 21- 3p regulates cardiac hypertrophic response by targeting histone deacetylase- 8[J].Cardiovasc Res,2015,105(3):340- 352.
[6] BANG C,BATKAI S,DANGWAL S,et al.Cardiac fibroblast- derived microRNA passenger strand- enriched exosomes mediate cardiomyocyte hypertrophy[J].J Clin Invest,2014,124(5):2136- 2146.
[7] MOSTERD A,HOES A W.Clinical epidemiology of heart failure[J].Heart,2007, 93(9):1137- 1146.
[8] 鄭世存,李曉宇,歐陽兵,等.芍藥苷藥理作用研究新進展[J].中國藥物警戒, 2012(2):100- 103.
[9] QIAN G Q,DING J,ZHANG X,et al.Preconditioning with glycyrrhizic, ferulic, paeoniflorin, cinnamic prevents rat hearts from ischemia/reperfusion injury via endothelial nitric oxide pathway[J].Pharmacogn Mag,2015,11(42):292- 296.
[10] ZHOU H,YANG H X,YUAN Y,et al.Paeoniflorin attenuates pressure overload- induced cardiac remodeling via inhibition of TGFbeta/Smads and NF- kappaB pathways[J].J Mol Histol,2013,44(3):357- 367.
[11] OLIVEIRA- CARVALHO V,CARVALHO V O,SILVA M M,et al. MicroRNAs:a new paradigm in the treatment and diagnosis of heart failure? [J].Arq Bras Cardiol, 2012,98(4):362- 369.
[12] THUM T,GROSS C,FIEDLER J,et al.MicroRNA- 21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008, 456(7224):980- 984.
[13] SAYED D,RANE S,LYPOWY J,et al.MicroRNA- 21 targets Sprouty2 and promotes cellular outgrowths[J].Mol Biol Cell,2008,19(8):3272- 3282.
[14] BRONNUM H,ANDERSEN D C,SCHNEIDER M,et al.miR- 21 promotes fibrogenic epithelial- to- mesenchymal transition of epicardial mesothelial cells involving. Programmed Cell Death 4 and Sprouty- 1[J].PLoS One, 2013,8(2):e56280.
[15] JI Y,DOU Y N,ZHAO Q W,et al.Paeoniflorin suppresses TGF- beta mediated epithelial- mesenchymal transition in pulmonary fibrosis through a Smad- dependent pathway[J]. Acta Pharmacol Sin,2016,37(6):794- 804.

