注射性殼聚糖β-甘油磷酸鈉凝膠負載富血小板血漿和骨髓基質干細胞促進牙周再生的研究*
鄧蔡 張麗 冷衛東 歷丹 桂婷
(湖北醫藥學院附屬太和醫院口腔醫學中心牙周科,湖北 十堰 442000)
牙周組織的再生一直以來都是口腔醫學領域研究的熱點,在再生過程中生長因子發揮了巨大的作用[1,2]。但由于生長因子易失活、易流失的特點,其應用長期以來都受到了限制。近年來,隨著組織工程技術的飛速發展,不少理想的生物相容性的支架材料在臨床上得到了應用[3-4]。注射性殼聚糖β-甘油磷酸鈉(chitosan/β-glycerol phosphate disodium salt,C/GP)是一種生理中性、在37℃時可形成凝膠的物質,對大分子藥物具有緩釋性,能夠作為細胞的載體并維持細胞活性[5,6]。富血小板血漿(platelet-rich plasma,PRP)富含生長因子,能夠從自體外周血中提取,故不存在免疫排斥反應,在牙周組織再生中能夠發揮巨大作用[4]。骨髓基質干細胞((bone marrow mesenchymal stem cells,BMSCs)是一種理想的種子細胞,具有取材容易、增殖性強、易于成活等多種優勢[7,8]。本研究將分析可注射性殼聚糖β-甘油磷酸鈉凝膠負載富血小板血漿和骨髓基質干細胞促進牙周再生的效果。
1 材料與方法
1.1 材料來源 取3只健康雄性雜種犬,年齡1~2歲,體重15~20kg。 試劑:醫用級殼聚糖(青島博益特生物材料有限公司提供,脫乙酰度91%),β-甘油磷酸二鈉、牛凝血酶、胰蛋白酶(上海研生生化試劑有限公司),優純級乙酸(國藥集團),胎牛血清(西安熱默爾生物科技有限公司),DMEM培養液(美國Gibco),人淋巴細胞分離液(深圳市偉通生物科技有限公司)。儀器:CO2培養箱(美國SHELLAB公司),倒置顯微鏡(上海蔡康光學儀器廠)。
1.2 研究方法
1.2.1 C/GP溶液制備方法 于8ml 0.1mol/L的乙醇溶液中置入殼聚糖0.2g,使用攪拌器攪拌約2h。把0.56gβ-甘油磷酸鈉置于2ml雙蒸水中攪勻并振蕩5min。將上述兩種溶液進行20min冰浴,而后把β-甘油磷酸鈉逐滴加入殼聚糖溶液并混勻攪拌10min。所得C/GP溶液的β-甘油磷酸鈉質量濃度為5.6%,殼聚糖質量濃度為2.0%。
1.2.2 PRP的制備 采集犬靜脈血10ml加入裝有1ml 10%枸櫞酸鈉抗凝劑的試管中,立刻采用二次離心法進行PRP的制備,可獲得1ml PRP,置于-70℃冰箱中貯存。
1.2.3 BMSCs培養及誘導分化 采集犬髂后上棘骨髓進行BMSCs的原代培養,并對第三代BMSCs進行誘導分化。
1.2.4 根分叉缺損模型的制備 將每只犬的上、下頜的第二、第三前磨牙與第一磨牙共10顆牙作為本次研究的實驗牙,對3只犬分別注射0.1ml陸眠寧進行麻醉。依據既往文獻[9,10]方法進行前磨牙區Ⅱ度根分叉缺損制備,制備完畢后通過垂直褥式法對牙齦瓣進行縫合。依據隨機分組結果對各組模型進行相應處置:A組僅在缺損處注射C/GP;B組在缺損處注射C/GP+PRP(C/GP:PRP=1:2);C組在缺損處注射C/GP+106/m BMSCs;D組在缺損處注射C/GP+PRP+106/m BMSCs;對照組在缺損處不注射任何物質。術后連續3天對犬進行青霉素靜注以防感染,1周內食用流質食物,此后轉為半流質食物。
1.2.5 標本處理與組織學觀察 術后8周將實驗犬處死,采集樣本用40g/L甲醛固定3天,常規脫鈣處理,制作5μm厚切片,每個組織隨機選取10個切片進行觀察測量。在光學顯微鏡下對新生牙周組織部位的再生情況進行觀察,并用微尺對新生牙骨質、新生牙周膜組織、新生牙槽骨的新生情況進行測定。同時,對各組牙周缺損再生情況進行X線觀察。
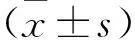
2 結果
2.1 實驗結果 所有實驗犬在術后均未發生異常癥狀,處死時均健康狀況良好。實驗牙周邊未見牙石,牙齦部位愈合理想,深度約為1.2~1.7mm。
2.2 牙周缺損X線片觀察結果 觀察X線片可知,B、C、D組的牙周缺損部位均有明顯的牙槽再生現象,且骨密度均顯著高于A組與對照組。見圖1。
2.3 組織學觀察與測量結果 B組、C組及D組觀察鏡下均可見新生牙槽骨、新生牙骨質和新生牙周膜纖維生長,D組牙周組織再生最為明顯,新生的牙槽骨幾乎充滿根分叉區。而A組與對照組的新生牙組織則較少,根分叉區存在大量上皮組織(見圖2)。結果顯示,B、C、D組的新生牙槽骨、新生牙骨質和新生牙周膜纖維測量值均顯著高于A組和對照組(P<0.05);D組各指標值顯著高于B和C組(P<0.05),差異均有統計學意義;A組和對照組僅有少量的牙周組織再生,兩組差異不顯著(P>0.05),見表1。

Table1Measurementsofalveolarbone,newcementumandperiodontalligamentfiberineachgroup

組別新生牙槽骨新生牙骨質新生牙周膜纖維A組1.80±0.251.78±0.351.69±0.21B組4.22±0.29①4.16±0.30a①4.14±0.23①C組4.17±0.31①4.14±0.19①4.03±0.29①D組4.91±0.39①②4.79±0.26①②4.72±0.31①②對照組1.87±0.231.76±0.241.74±0.30
注:與A組、對照組相比,①P<0.05;與B組、C組相比,②P<0.05
3 討論
注射性殼聚糖β-甘油磷酸鈉(C/GP)作為新型的可注射性溫敏凝膠,生物相容性良好,目前已經被作為種子細胞和生長因子載體在組織工程中被廣泛利用。有研究曾將C/GP作為支架材料,并負載髓核細胞進行培養,結果顯示髓核細胞能夠正常增殖,且其中Ⅱ型膠原表達較高[11,12]。PRP是一種包含有多種生長因子的全血提取物,具有制備簡易、自體無毒等特點,是理想的生長因子來源。BMSCs則是一種未分化的原始祖細胞,有研究證明BMSCs能夠有效修復根分叉缺損,在牙骨質、牙槽骨等組織的修復中起到重要作用[13,14]。

圖1各組術后8周牙周缺損X線片圖
Figure1X-rayfilmofperiodontaldefectat8weeksafteroperation

圖2 術后8周各組牙周缺損處牙周組織再生情況Figure 2 Periodontal tissue regeneration in periodontal defect at 8 weeks after operation注:A.對照組;B.C/GP;C.C/GP+PRP;D.C/GP+BMSCs ;E、F.C/GP+PRP+BMSCs
由于牙周炎造成的牙周組織缺損往往極不規則,選擇合適的支架材料與生長因子使缺損區得到充分的修復是當前急需解決的問題[15,16]。本研究中所使用的C/GP在常溫下為溶液,可以向缺損區進行注射使之充滿缺損部位,并通過原位凝固維持空間和釋放生長因子。結果顯示,A組與對照組牙槽雖出現了再生現象,但新生牙組織則較少,并且根分叉區存在大量上皮組織。這表明了C/GP能夠較好的與組織相容,且不會造成根分叉缺損部位的不良反應,但同時C/GP也不會對牙周組織的再生起到促進作用。既往文獻報道中,往往只研究了單一生長因子在牙周組織再生中發揮的作用,但單一生長因子由于不具有多生長因子聯用發揮協同作用的優勢,因此效果并不理想[17,18]。本研究分析了C/GP+PRP+BMSCs 對牙周組織再生中的應用效果,結果顯示B組、C組及D組均有新生牙槽骨、新生牙骨質和新生牙周膜纖維生長,D組牙周組織再生最為明顯,且各指標測量值均顯著高于A組、對照組(P<0.05),D組各指標值顯著高于B、C組(P<0.05)。這表明PRP的使用能夠有效提高牙周組織的再生與愈合,PRP與C/GP由于在液態時復合,因此復合更為均勻,保證了材料內的PRP不會輕易經血液沖刷等流失,能夠在缺損部位釋放高濃度的生長因子。D組的牙周組織再生最為顯著,這可能是由于C/GP在原位凝固后為BMSCs創造了一個立體增殖空間,再加之PRP中高濃度生長因子的釋放,BMSCs在牙周組織中的分化與增殖更為迅速。有研究表明,1%的PRP即可使BMSCs增殖速度加快,二者聯用能夠發揮良好的骨修復效果[19,20]。
4 結論
本文資料顯示,C/GP負載PRP和BMSCs有助于促進牙周組織的再生,值得在臨床進一步深入研究與利用。
【參考文獻】
[1]于新波. 牙齦間充質干細胞與牙周膜干細胞膜片牙周再生能力的實驗研究[D]. 山東大學, 2014.
[2]巴格那. 可注射性納米殼聚糖骨形成蛋白-2復合體用于大鼠實驗性牙周炎的效果研究[D]. 蘭州大學, 2015.
[3]Yu B, Zhang Y, Li X,etal. The use of injectable Chitosan/Nanohydroxyapatite/collagen composites with bone marrow mesenchymal stem cells to promote ectopic bone formation in vivo[J]. Journal of Nanomaterials, 2013, 2013(3):3805-3816.
[4]趙月亮. 自體富血小板纖維蛋白牙周再生治療的護理配合[J]. 天津護理, 2015, 23(5):429-430.
[5]朱斌, 趙喜聰, 李楠,等. 組織特異性間充質干細胞的牙周再生對比[J]. 口腔生物醫學, 2015, 6(3):150-154.
[6]Khojasteh A, Behnia H, Hosseini F S,etal. The effect of PCL-TCP scaffold loaded with mesenchymal stem cells on vertical bone augmentation in dog mandible: A preliminary report [J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2013, 101(5):848-854.
[7]徐景. 早期拔牙窩愈合組織對牙周組織再生的動物實驗研究[D]. 山東大學, 2015.
[8]馬君義, 陳香玲, 盛愛霞,等. 載高烏甲素可注射殼聚糖/β-甘油磷酸鈉溫敏水凝膠的制備與性能研究[J]. 中國藥學雜志, 2015, 50(19):1696-1703.
[9]Oliveira J M, Sousa R A, Kotobuki N,etal. The osteogenic differentiation of rat bone marrow stromal cells cultured with dexamethasone-loaded carboxymethylchitosan/poly(amidoamine) dendrimer nanoparticles.[J]. Biomaterials, 2009, 30(5):804-813.
[10] 王阿嫻, 唐麗, 梁源,等. 人骨髓來源細胞外基質對人牙周膜干細胞增殖的影響[J]. 中國組織工程研究, 2014, 18(6):938-943.
[11] 王敬, 徐燕, 楊洋,等. 生長因子在牙周炎位點保存中促進骨組織再生的觀察[J]. 安徽醫科大學學報, 2016, 51(9):1329-1333.
[12] Kusumastuti Y, Shibasaki Y, Hirohara S,etal. Encapsulation of rat bone marrow stromal cells using a poly-ion complex gel of chitosan and succinylated poly(Pro-Hyp-Gly)[J]. Journal of Tissue Engineering & Regenerative Medicine, 2015, 215(11):249-262.
[13] 高瑩. 自體濃縮生長因子(CGF)在犬牙周組織缺損再生中的研究[D]. 山東大學, 2015.
[14] 李樹臣, 尚緒山, 李東,等. PRP聯合鹽酸川芎嗪對BMSCs體外增殖及向成骨細胞分化的影響[J]. 生物骨科材料與臨床研究, 2015, 12(5):1-4.
[15] Wang N, Yang Z, Zang M,etal. Carbon nanotubes functionalized with fibroblast growth factor accelerate proliferation of bone marrow-derived stromal cells and bone formation[J]. Nanotechnology, 2013, 24(43):435101-435101.
[16] Gnecchi M, Melo L G. Bone marrow-derived mesenchymal stem cells: isolation, expansion, characterization, viral transduction, and production of conditioned medium[J]. Methods in Molecular Biology, 2009, 482(2):281.
[17] 許春姣, 郭峰, 高清平,等. 骨髓基質干細胞與黃芪-殼聚糖/聚乳酸支架對犬牙周骨缺損再生的影響[J]. 中南大學學報(醫學版), 2006, 31(4):512-517.
[18] 陳玉陽. 可注射納米殼聚糖/骨形成蛋白復合物修復大鼠頜骨缺損的實驗研究[D]. 蘭州大學, 2014.
[19] 趙清桐, 賴仁發, 汪距,等. 殼聚糖/β-磷酸三鈣/重組人骨形態發生蛋白2可注射性復合體修復兔下頜骨缺損[J]. 中國組織工程研究, 2009, 13(51):10065-10068.
[20] 謝富強, 魚靈會, 王新,等. 骨形態發生蛋白氰基丙烯酸復合修復大鼠下頜骨骨缺損的實驗研究[C]// 全國口腔頜面外科修復重建學術會議暨國際研討會. 2013.

