肺癌與肺癌骨轉移患者血清ODF、OCIF及Ca水平的研究*
李 莉,陳保錦,劉志武,張 藝,陳 明
(蘭州大學第一醫院:1.檢驗科;2.呼吸科;3.核醫學科,蘭州 730000)
骨骼是中晚期肺癌患者轉移最常見的部位,骨轉移后并發癥較多,表現為疼痛、高鈣血癥、運動障礙、病理性骨折等,給患者帶來極大的痛苦,減少生存期。現在多項腫瘤標志物的聯合檢測,顯著提高肺癌的早期臨床診斷,但對肺癌骨轉移的早期診斷缺乏相關性研究。本研究對肺癌骨轉移患者進行破骨細胞分化因子(ODF)、破骨細胞生成抑制因子(OCIF)、血清鈣(Ca)水平的檢測,同時監測患者在唑來膦酸治療后2、4、6個月ODF、OCIF、CA的水平變化,分析其與肺癌骨轉移臨床預后的相關性,為其診斷、監測治療療效提供一定依據。
1 資料與方法
1.1一般資料 收集該院診斷為肺癌的114例患者,均經細胞學和病理學確診。非骨轉移組51例,男35例,女16例,年齡32~78歲;小細胞癌18例,鱗癌10例,腺癌20例,腺鱗癌3例。骨轉移組63例,男41例,女22例,年齡39~75歲;小細胞癌22例,鱗癌15例,腺癌23例,腺鱗癌3例。
1.2儀器與試劑 采用Olympus AU2700全自動生化分析儀及北京九強生物技術有限公司試劑檢測Ca,ODF和OCIF采用美國Uscnlife公司試劑在全自動酶標儀上進行定量分析。
1.3方法 2組患者清晨抽取空腹靜脈血5 mL,離心后血清Ca當日檢測,剩余標本分裝于―80 ℃冰箱保存待測ODF和OCIF水平。血清ODF 和OCIF采用酶聯免疫吸附試驗(ELISA)法,血清Ca采用偶氮砷Ⅲ法。骨轉移組患者使用唑來膦酸鈉注射液4 mg,加入生理鹽水100 mL,快速靜脈滴注15 min,每4周為1個療程,持續6個月。采集治療前、治療后2、4、6個月的血清標本。
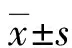
2 結 果
2.12組患者各指標結果比較 2組患者ODF和OCIF水平比較,差異有統計學意義(P<0.01),2組Ca水平比較,差異也有統計學意義(P<0.05)。見表1。

表1 2組患者各指標結果比較
注:與非骨轉移組比較,abcP<0.01
2.2骨轉移組患者治療時各指標變化比較 骨轉移組患者唑來膦酸治療2個月時 ODF、OCIF、Ca水平與0個月比較,差異有統計學意義(P<0.05);治療4個月時與0個月比較,各指標差異有統計學意義(P<0.05);治療6個月時與0個月比較,各指標差異有統計學意義(P<0.01);治療4個月時與2個月比較,各指標差異有統計學意義(P<0.05);治療6個月時與4個月比較,各指標差異有統計學意義(P<0.05)。見表2。

表2 骨轉移組患者唑來膦酸治療各時點各指標水平變化比較
3 討 論
肺癌是最常見的惡性腫瘤,發病率呈明顯的增加趨勢,中晚期肺癌骨轉移發生率約為30%~40%,骨轉移患者生活質量下降甚至威脅生命[1-2]。目前對骨轉移的診斷一般通過X光線、電子計算機斷層掃描(CT)、發射型計算機斷層儀(ECT)、磁共振成像(MRI) 等進行確診,但均對早期診斷骨轉移的敏感性較差,正電子發射型計算機斷層(PET) 檢測價格昂貴,不適合病情監測。近年來,骨骼生成和破壞的特異性標志物在骨轉移癌的早期診斷和預測的價值受到廣泛關注。骨組織是由成骨細胞、骨細胞、破骨細胞、骨原細胞等和大量鈣化的細胞間質組成。骨形成和骨吸收之間的平衡是由成骨細胞和破骨細胞的活動及其相互作用而決定。癌細胞原發灶的轉移是造成腫瘤轉移的重要環節,ODF和OCIF是惡性腫瘤骨轉移過程中釋放的一對重要因子[3-4]。當ODF受單核細胞集落因子刺激,與相應細胞受體結合,從而刺激破骨細胞系前體轉變為成熟的破骨細胞,使骨質溶解破壞,在高水平時就會增加細胞活性,減少成熟破骨細胞的細胞凋亡[5]。ODF還可促進破骨細胞生成,并激活破骨細胞活性。OCIF是腫瘤壞死因子受體家族的成員,在體外OCIF抑制破骨細胞的形成,在體內OCIF抑制骨吸收[6-7]。
本研究結果顯示,2組患者ODF和OCIF水平比較,差異有統計學意義(P<0.01)。趙雪志等[8]研究發現OCIF在骨轉移組水平升高;譚云昌[9]也研究報道,前列腺癌骨轉移患者血清ODF和OCIF水平顯著增高。說明ODF和OCIF都參與了骨轉移,ODF和OCIF水平均增高,ODF可促進骨質破壞的作用,OCIF具有抑制作用,但ODF的破壞活力強于OCIF的抑制活力,造成骨轉移部位的溶骨性破壞。提示ODF和OCIF對診斷肺癌骨轉移具有一定的臨床價值,可作為重要的參考指標。骨轉移的病理基礎主要是腫瘤細胞與破骨細胞、成骨細胞間的相互作用,當骨質破壞以溶骨性為主時大量骨基質被破壞,釋放出的Ca超過腎和腸清除Ca的能力,導致患者Ca水平明顯升高。本研究結果顯示,骨轉移組患者血清Ca高于非骨轉移組(P<0.05)。有研究報道,高水平Ca(>2.65 mmol/L)是影響前列腺癌骨轉移患者生存的獨立危險因素[10]。有關研究表明,血清Ca水平升高與肺癌骨轉移相關,但與骨轉移類型無關,提示Ca水平對評價骨病灶的進展具有重要的意義[11]。
唑來膦酸作為第3代雙磷酸鹽,是目前臨床應用最廣泛的惡性腫瘤骨轉移的治療藥物,能抑制破骨細胞的活性,誘導破骨細胞凋亡[12-13]。通過與骨表面的羥磷灰石結合而阻止骨和軟骨礦物質的再吸收,同時唑來膦酸還可抑制腫瘤細胞釋放細胞因子引起的破骨細胞活性增加和骨鈣釋放,可減輕骨轉移疼痛、降低Ca水平[14-15]。本研究結果表明,骨轉移組患者接受唑來膦酸治療后,ODF水平在用藥后2、4、6個月逐漸降低,說明破骨細胞的活性下降,溶骨能力減弱。OCIF水平在用藥后2、4、6個月逐漸升高,提示OCIF抑制了破骨細胞的分化形成及功能,促進破骨細胞凋亡,增加成骨細胞合成的能力。通過監測肺癌骨轉移患者接受唑來膦酸治療后血清Ca水平變化,發現Ca水平在用藥后2、4、6個月逐漸降低,說明唑來膦酸促進破骨細胞凋亡,抑制骨基質分解和骨鹽溶解,從而降低Ca水平[16]。趙曉亮[17]研究顯示,唑來膦酸能改善肺癌骨轉移引起的疼痛和高鈣血癥。提示血清Ca在骨轉移治療過程中具有很好的相關性,對肺癌骨轉移患者治療及療效的觀察有廣泛的應用前景。
綜上所述,肺癌骨轉移是一個復雜的生物學過程,研究過程中對病例選擇、檢測方法、統計學方法的不同可能可導致不同的結論。本研究結果顯示,聯合檢測血清ODF、OCIF、Ca水平可作為肺癌骨轉移患者的預測指標,對其治療及療效具有臨床價值。
參考文獻
[1]韓雪,喬鵬,謝夢,等.2002-2010年上海市楊浦區居民肺癌發病與死亡分析[J].中華腫瘤雜志,2012,34(6):717.
[2]劉宇,張幸平,吳紅宇,等.258例肺癌骨轉移患者的臨床及治療相關因素分析[J].中國腫瘤臨床,2012,39(13):914-918.
[3]RAFIEI S,KOMAROVA S V.Molecular signaling pathwavs mediating osteoclastogenesis Induced by prostate cancer cells[J].BMC Cancer,2013,26(13):605-607.
[4]KUSHLINSKIY N E,TIMOFEEVIU S,GERSHTEYN E S,et al.Clinical perspectives of the Study of RANK/RANKL/OPG system components in primary and metastatic bone tumor[J].Vopr Onkol,2014,60(4):413-421.
[5]HOFBAUEROF L C,KHOSLA S,DUNSTAN C R,et al.The rols of osteoprotegerin and osteoprotegerin ligand in the paracrine regulation of bone resorption[J].J Bone Miner Res,2000,15(1):2-12.
[6]WALSH M C,CHOI Y.Bioiogy of the TRANCE axis[J].Cytokine Growth Factor Rew,2003,14(3/4):251-263.
[7]KOIDE M,MURASE Y,YAMATO K,et al.Bone morphogenetie protein-2 enhances osteoclast formation mediated by interleukin-1alpha through upregulation of osteoclast differentiation factor and cyclooxygenase-2[J].Biochem Biophys Res Commun,1999,259(1):97-102.
[8]趙雪志,李綱,王振杰,等.前列腺癌患者血清骨保護素測定的臨床價值[J].中國綜合臨床,2010,26(12):1242-1243.
[9]譚云昌.血清破骨細胞分化因子及生成抑制因子測定在前列腺癌骨轉移診斷中的價值[J].中國現代醫學雜志,2014,23(1):37-40.
[10]GUPTA D,TRUKOVA K,POPIEL B,et al.The association between pre-treatment serum 25-hydroxyvitamin D and survival in newly diagnosed stage Ⅳ prostate cancer[J].PLoS One,2015,10(3):e0119690.
[11]SOYFOO M S,BRENNER K,Paesmans M,et al.Non-malignant causes of hypercalcemia in cancer patients:a frequent and neglected occurrence[J].Support Care Cancer,2013,21(5):1415-1419.
[12]SKERJANEC A,BERENSON J,HSU C,et al.The pharmacokinetics and pharmacodynamics of zoledronic acid in cancer patients with varying degrees of renal function[J].J Clin Pharmacol,2003,43(2):154-162.
[13]BODY J J,LORTHOLARY A,ROMIEU G,et al.A dose-finding study of zoledronate inhypercalcemic cancer patients[J].J Bone Miner Res,2009,14(9):1557-1561.
[14]COLEMAN R,GNANT M.New results from the use of bisphosphonates in cancer patients[J].Curr Opin Support Palliat Care,2009,3(3):213-218.
[15]COSTA L,MAJOR P P.Effect of bisphosphonates on pain and quality of life in patients with bone metastases[J].Nat Clin Pract Oncol,2009,6(3):163-17
[16]KELLER J,CATALA-LEHNEN P,HUEBNER A K,et al.Calcitonin controls bone formation by inhibiting the release of sphingosine 1-phosphate fromosteoclasts[J].Nat Commun,2014,59(4):12-15.
[17]趙曉亮.唑來膦酸與帕米膦酸二鈉治療肺癌骨轉移疼痛的療效與安全性對比分析[J].現代預防醫學,2011,38(6):1179-1180.

