異裂菊屬根際微生物群落結構及功能多樣性
史艷財 鄒蓉 唐健民 熊忠臣 蔣運生 韋霄 鄧濤
摘 要: ?異裂菊屬是廣西喀斯特石山區(qū)典型的特有屬,根際微生物是其能否有效吸收、有效利用土壤養(yǎng)分和適應石山惡劣土壤環(huán)境的最直接表征之一。該研究采用DGGE和Biolog兩種方法對異裂菊屬植物根際和非根際微生物多樣性進行了研究。結果表明:(1)異裂菊屬5個種根際pH、堿解氮等9個養(yǎng)分含量都高于非根際。(2)5個種的根際、非根際存在2個共有細菌類群,但在數(shù)量上存在差異,3個種的根際條帶小于非根際;5個種的根際、非根際微生物群落較為相似,較易聚在一起。(3)絹葉異裂菊根際微生物對碳源利用能力最強,凹脈異裂菊非根際最弱,其他對碳源的利用能力較接近;異裂菊屬種根際微生物利用碳源的能力都高于非根際,根際微生物多樣性指數(shù)均高于非根際,優(yōu)勢度指數(shù)與非根際基本相同或略高于非根際,豐富度和均勻度指數(shù)與優(yōu)勢度指數(shù)規(guī)律相似;異裂菊屬根際、非根際微生物利用的碳源主要是糖類、羧酸類和氨基酸類化合物,4個種根際微生物利用碳源的能力高于非根際。(4)陽離子交換量、黏粒含量百分率和堿解氮是影響異裂菊屬根際微生物碳源利用模式的最重要因子。總體來說,土壤理化性質對異裂菊屬植物根際微生物群落多樣性具有重要影響,異裂菊屬通過分泌羧酸、糖等多類化合物提高了根際微生物的活性,進而有效地提高了根際肥力水平。
關鍵詞: 喀斯特石山區(qū), 特有屬, 根際微生物, PCR-DGGE, Biolog微平板法
中圖分類號: ?Q948.15, Q938
文獻標識碼: ?A
文章編號: ?1000-3142(2018)01-0001-10
Structural and functional diversity of rhizosphere microbial community of Heteroplex
SHI Yancai, ZOU Rong*, TANG Jianmin, XIONG Zhongchen, JIANG Yunsheng, WEI Xiao, DENG Tao
( Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China )
Abstract: ?Heteroplex is a typical endemic genus of karst rocky mountainous area in Guangxi, and rhizosphere microorganism is one of the most direct representations of its ability to absorb and utilize soil nutrients and adapt to the harsh soil environment. In this study, DGGE and Biolog methods were used to study the rhizosphere and non-rhizosphere microbial diversity of Heteroplex. The results showed that the values of pH and alkali nitrogen content in the rhizosphere were hi-gher than those in the non-rhizosphere. The results of DGGE showed that two common bacterial groups were same in the rhizosphere and non-rhizosphere of Heteroplex, but the numbers were different. The bands in DGGE profile of the three species were less than non-rhizosphere. Rhizosphere and non-rhizosphere microbial community of each species were similar. The results of Biolog showed that the rhizosphere microorganisms of H. sericophylla ?had the strongest ability to use carbon source, and the non-rhizosphere of H. impressinervia was the weakest, and the ability of utilize carbon source of other rhizosphere and non-rhizosphere microbial community was close. The microbial diversity index of rhizosphere microorganisms was higher than that of non-rhizosphere, and the dominance index was the same as that of non-rhizosphere, the richness and evenness index are similar to the dominance index. The carbon sources used in non-rhizosphere microbes were mainly sugars, carboxylic acids and amino acids. The ability of utilize carbon source of four rhizosphere microorganisms were higher than non-rhizosphere. Cation exchange capacity, clay content and alkali nitrogen were the most important factors affecting the microbial carbon source utilization model of rhizosphere microorganisms. In general, the soil physical and chemical properties have an important effect on rhizosphere microbial community diversity of Heteroplex, and the activity of the rhizosphere microorganisms and fertility level were improved by secreting compounds such as carboxylic acid and sugar.
Key words: karst limestone regions, endemic genus, rhizosphere microbial community, PCR-DGGE, Biolog-Eco
菊科異裂菊屬(Heteroplex)為廣西稀有的特有屬,該屬5個種全部為中國特有種(覃海寧和劉演, 2010)。異裂菊屬地理分布范圍十分狹小,僅分布于廣西少數(shù)縣石灰?guī)r石山中上部的狹小區(qū)域,其種群個體數(shù)量5~60株。小花異裂菊對菊科分類、演化等研究具有重要科學價值,已被列為國家二級保護植物(付立國, 1992)。近年來,由于自然生態(tài)環(huán)境和植被遭受破壞,該屬的野生植株逐年減少,小花異裂菊模式標本采集地的種群現(xiàn)已絕跡(史艷財?shù)龋?2017)。大力開展異裂菊屬保育生物學研究,摸清其瀕危機制勢在必行。
根際(rhizosphere)是指受植物根系影響的根—土界面的一個區(qū)域,是植物—土壤—微生物與其環(huán)境條件相互作用最為活躍的場所(Haremann et al, 2008)。根際微生物直接參與土壤中氮、磷、硫等養(yǎng)分的循環(huán)和轉化(Eisenhauer et al, 2012)。其分泌的有機酸(Pii et al, 2015)、土壤酶可提高植物對根際土壤養(yǎng)分的吸收能力和植物對土壤的適應性(蘇春淪等, 2016)。植物根際微生物對植物的定植、生長、繁殖和群落演替至關重要。近年來,國內外研究表明,高山、荒漠等生境中植物根際微生物是影響其生態(tài)適應力的關鍵因子(Jorge et al, 2016)。易思榮等(2012)研究發(fā)現(xiàn)塔里木河下游7種典型優(yōu)勢荒漠植物增加了根際微生物的數(shù)量及活性,促進了土壤養(yǎng)分的積累和轉化。銀杉根際微生物類群數(shù)量和個體總量低可能是其退化和生長不良的主要原因之一。小花異裂菊分布的石山中上部土壤具有土層淺、保水能力差、鹽分含量高、養(yǎng)分貧瘠等特點,根際微生物是其能否有效吸收、利用土壤養(yǎng)分和適應惡劣土壤環(huán)境的最直接表征之一(Wang et al, 2016)。本文通過研究異裂菊屬根際微生物的結構和功能多樣性及其對植物適應力的影響,闡明異裂菊屬的生態(tài)適應機制,為異裂菊屬的保護以及揭示其他石山特有植物的瀕危機制奠定基礎。
1 材料與方法
1.1 研究區(qū)概況
異裂菊屬植物僅分布在廣西少數(shù)的幾個縣,具體為小花異裂菊僅分布于廣西陽朔、融安縣,絹葉異裂菊分布于陽朔縣,柳州異裂菊分布于柳州市,凹脈異裂菊和異裂菊分布于馬山、寧明、龍州縣。異裂菊屬植物分布在這些縣的石灰?guī)r石山中上部的灌叢或者向陽處,種群個體數(shù)量在5~20株之間。分布區(qū)土壤為石灰?guī)r土,偏堿,pH值6.5~8.0,土層在5~15 cm,保水能力差,土壤含水量低。分布區(qū)光照強,晝夜溫差大,夏季溫度可達40 ℃以上。植被主要以灌木為主,包括有檵木(Loropetalum chinense)、樸樹(Celtis sinensis)、黃連木(Pistacia chinensis)、化香樹(Platycarya strobilacea)、園葉烏桕(Saptum rotundifolium)、石班木(Photinia consimilis)等。
1.2 采樣方法
于2016年8月在廣西的陽朔縣(采集小花異裂菊XH、絹葉異裂菊JM)、龍州縣(異裂菊YL)、馬山縣(凹脈異裂菊AM)及柳州市(柳州異裂菊LZ)進行樣品采集(表1)。在異裂菊屬植物種群分布集中的位置均勻選取3個樣點,每個樣點采用5點采樣法采集。將異裂菊屬植物連根挖起(根系盡量完整),抖落根系外圍大塊的土,取緊貼在根系表面的土壤作為根際土(R)。在植株附近未生長植物的位置取0~20 cm的土壤樣品作為非根際土壤(N)。裝于封口袋后置于便攜式冰盒中帶回實驗室。用于提取微生物DNA的土壤樣品于-80 ℃冰箱保存。Biolog實驗于土壤樣品采回后立即進行。
1.3 研究方法
1.3.1 土壤理化性質測定 土壤pH、電導率采用pH計、電導率儀測定;土壤交換性陽離子(CEC)測定采用中性乙酸銨法;交換性鉀和鈉的測定采用乙酸銨交換—火焰光度法;交換性鈣和鎂采用乙酸銨—原子吸收分光光度法;機械組成采用吸管法測定;全氮采用高氯酸—硫酸消化法;速效氮采用堿解蒸餾法;全磷、速效磷用0.5 mmol·L-1 NaHCO3浸提—鉬銻抗比色法;全鉀采用氫氟酸—高氯酸消煮法;速效鉀用NH4OAc浸提—火焰光度法;有機質采用高溫外熱重鉻酸鉀氧化—容量法。
1.3.2 群落結構多樣性DGGE測定 稱取約0.5 g冷凍土壤樣品,按試劑盒(OMEGA N.A.TM Soil DNA Kit)操作說明提取土壤微生物總DNA。采用Nanodrop和1%瓊脂糖凝膠電泳法檢測微生物DNA濃度和完整度。保存于-20 ℃冰箱中備用。
PCR擴增體系: 2×Taq PCR MasterMix 25 μL,上下游引物(10 μmol·L-1)2.5 μL,1 μL DNA(約30 ng),超純水補至50 μL。PCR擴增引物采用細菌通用引物,即338F(5′-GACTCCTACGGGAGGCAGCAG-3′)和518R(GTGCCAGCMGCCGCGG)。
PCR擴增程序:95 ℃ 5 min;95 ℃ 40 s,55 ℃ 35 s,72 ℃ 3 min,32個循環(huán);72 ℃ 10 min;4 ℃ 30 min。
PCR產物經1.5%瓊脂糖凝膠電泳檢測后用EB液(0.5 μg·mL-1)染色20 min,凝膠成像儀照相。
PCR擴增產物的變性梯度凝膠電泳所用聚丙烯酰胺膠濃度為8%(w/v),變性梯度為40%~60%。60 V電壓、60 ℃恒溫條件下電泳14 h。電泳結束后采用銀染方法染色,用凝膠成像儀照相,用Quantity One軟件對凝膠圖象進行分析。
1.3.3 群落功能多樣性測定 稱取相當于10 g烘干土樣的新鮮土壤加入到裝有100 mL滅菌水的250 mL三角瓶中;在搖床上以200 r·min-1轉速震蕩30 min后,取出放入超凈工作臺,吸取之前搖一搖,靜置大概40 s,待土和根等稍微下沉后,取3 mL加入到提前加好27 mL水的培養(yǎng)皿中稀釋,混勻,再進行下一梯度稀釋,重復此步驟,用八孔槍將稀釋1 000倍后的菌液加入Biolog板中,每孔加150 μL;每個樣品重復3次。將接種的微平板在30 ℃培養(yǎng)箱培養(yǎng),分別于0、24、48、72、96、120、144 h用酶標儀讀取590 nm下的吸光值。
AWCD= [∑(C-R)]/n
式中,C是所測的反應孔的吸光值,R是對照孔的吸光值,n是反應孔數(shù),n=31。
優(yōu)勢度指數(shù)(D): D=1-∑Pi2。
Shannon-Wiener多樣性指數(shù)(H):H=-∑PilnPi。式中,Pi為第i孔相對吸光值(C-R)與整個微平板相對吸光值綜合的比率。
豐富度指數(shù)(S):代謝剖面反應孔顏色變化的數(shù)目(AWCD>0.2)。
均勻度指數(shù)(E):E=H/lnS。式中,H為Shannon-Wiener多樣性指數(shù),S為豐富度指數(shù)。
1.4 數(shù)據(jù)處理方法
用Bio-Rad公司的Quantity One 4.6.5軟件對DGGE圖譜進行條帶分析,用非加權成對算術平均
2 結果與分析
2.1 異裂菊屬植物根際與非根際土壤理化性質
異裂菊屬植物根際、非根際土壤理化性質如表2所示。由表2可知,異裂菊屬5個種根際pH、堿解氮、速效磷、全磷、速效鉀、交換性鉀、交換性鈣、交換性鎂、全氮含量都高于非根際土壤。其余指標無明顯的規(guī)律性。
2.2 異裂菊屬植物根際與非根際微生物DGGE結果分析
2.2.1 異裂菊屬植物根際與非根際微生物DGGE結果 對異裂菊屬5種植物根際、非根際土壤細菌群落多樣性進行了DGGE分析(圖1)。圖1結果表明,5個種的DGGE條帶數(shù)、強度和均勻度都存在較大差異。5個種的根際、非根際存在2個共有的細菌類群,但其條帶的亮度存在差異,說明其在細菌物種的數(shù)量上存在差異。5個種中除小花異裂菊(XH)的根際、非根際條帶基本相同,柳州異裂菊(LZ)根際條帶大于非根際,其余3個種的根際條帶小于非根際。
2.2.2 異裂菊屬植物根際與非根際土壤微生物群落結構多樣性 根據(jù)異裂菊屬5種植物根際、非根際土壤細菌群落DGGE條帶計算其多樣性指數(shù)(表3)。表3結果表明,除絹葉異裂菊的根際細菌多樣性低于非根際外,其余4個種的根際細菌群落豐富度指數(shù)都高于非根際。5個種根際、非根際細菌群落的均勻度指數(shù)基本相同。5個種中除小花異裂菊的根際、非根際細菌群落豐富度指數(shù)基本相同,柳州異裂菊根際豐富度指數(shù)大于非根際,其余3個種的根際豐富度指數(shù)小于非根際。
2.2.3 異裂菊屬植物根際與非根際土壤微生物DGGE聚類分析 采用Quantity One 軟件計算出不同物種根際、非根際微生物的遺傳距離,然后進行了聚類分析(UPGMA)。圖2結果表明,與其他種的根際、非根際微生物群落相比,每個種的根際、非根際微生物群落較為相似,較易聚在一起。小花異裂菊與其他4個種的關系最遠;異裂菊和其他3個種的關系相對較遠;絹葉異裂菊和其他兩個種關系相對較近;柳州異裂菊和凹脈異裂菊的關系最近。
2.3 Biolog微平板結果分析
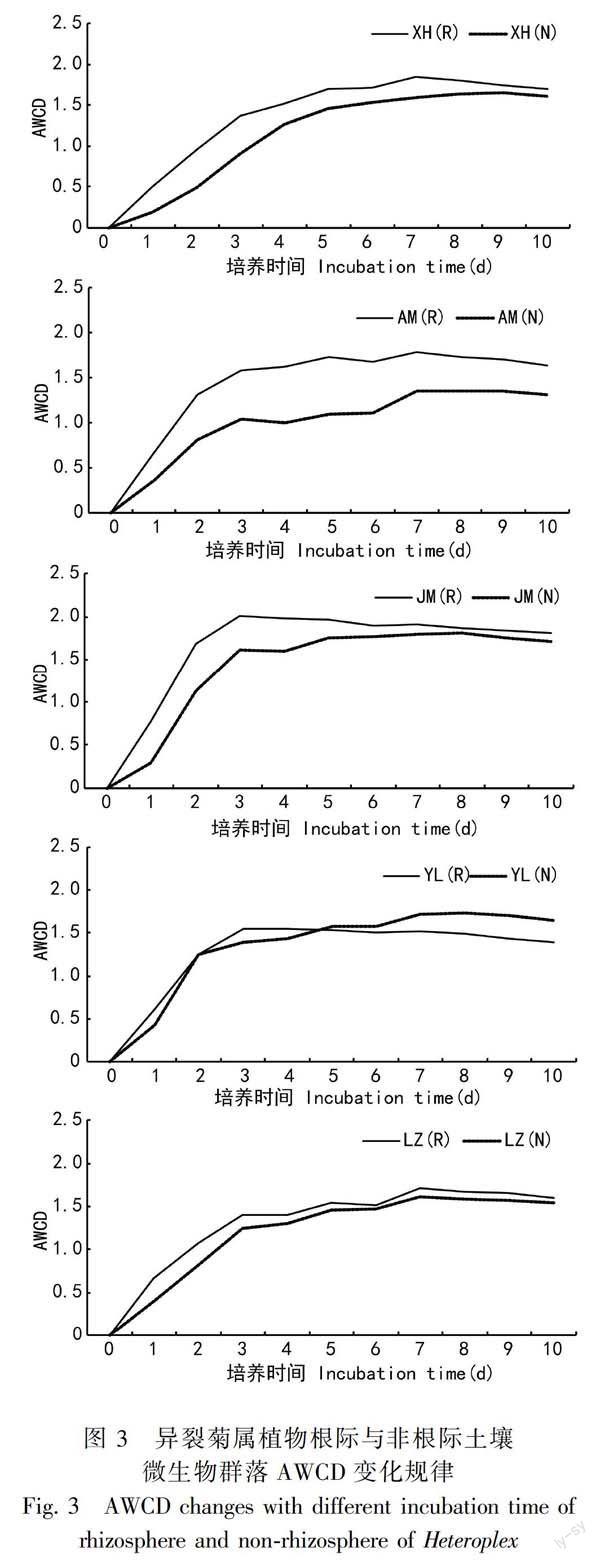
2.3.1 異裂菊屬植物根際與非根際微生物群落AWCD變化規(guī)律 對異裂菊屬5個物種的根際、非根際土壤微生物進行了Biolog平板分析(圖3)。
AWCD可反映出細菌在Biolog平板上的生長情況,曲線變化大的樣品其細菌碳源利用能力越強,其豐富度也越高。結果表明,隨著培養(yǎng)時間延長,微生物活性逐漸升高,從24 h起AWCD值迅速升高,144 h后趨于穩(wěn)定。絹葉異裂菊根際微生物對碳源利用能力最強,凹脈異裂菊非根際微生物對碳源的利用能力最弱,其他對碳源的利用能力比較接近。5個物種根際微生物利用碳源的能力都高于非根際。
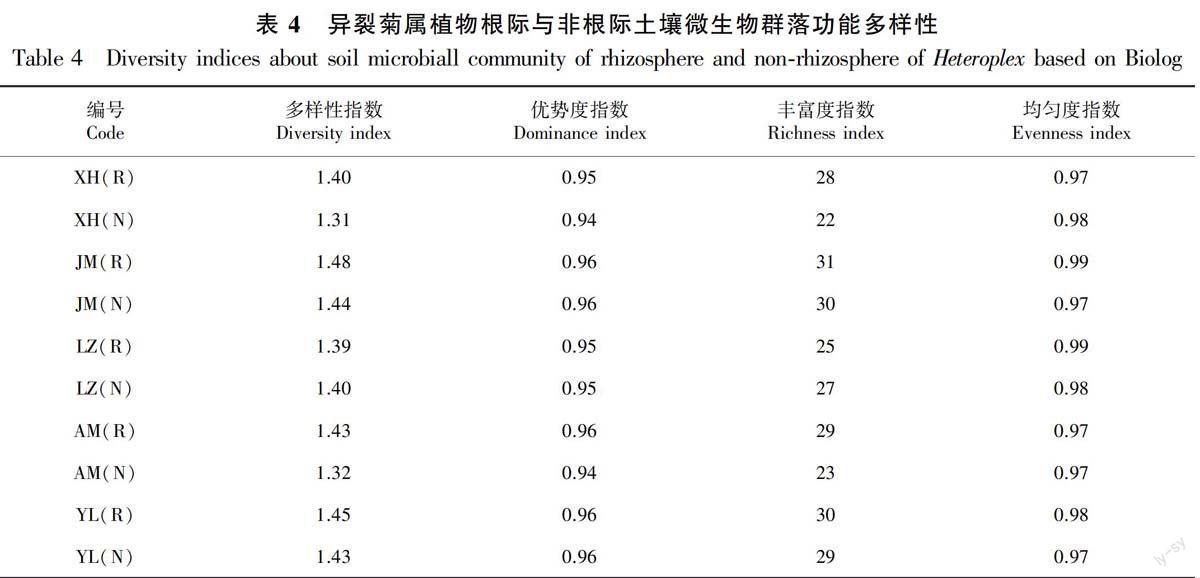
2.3.2 異裂菊屬植物根際與非根際微生物群落代謝多樣性分析 對異裂菊屬5個種根際、非根際微生物培養(yǎng)72 h的多樣性指數(shù)進行了分析(表4)。由表4可知,5個種的根際微生物多樣性性指數(shù)均高于非根際,根際微生物的優(yōu)勢度與非根際基本相同或略高于非根際,豐富度指數(shù)和均勻度指數(shù)表現(xiàn)與優(yōu)勢度指數(shù)相似的規(guī)律。
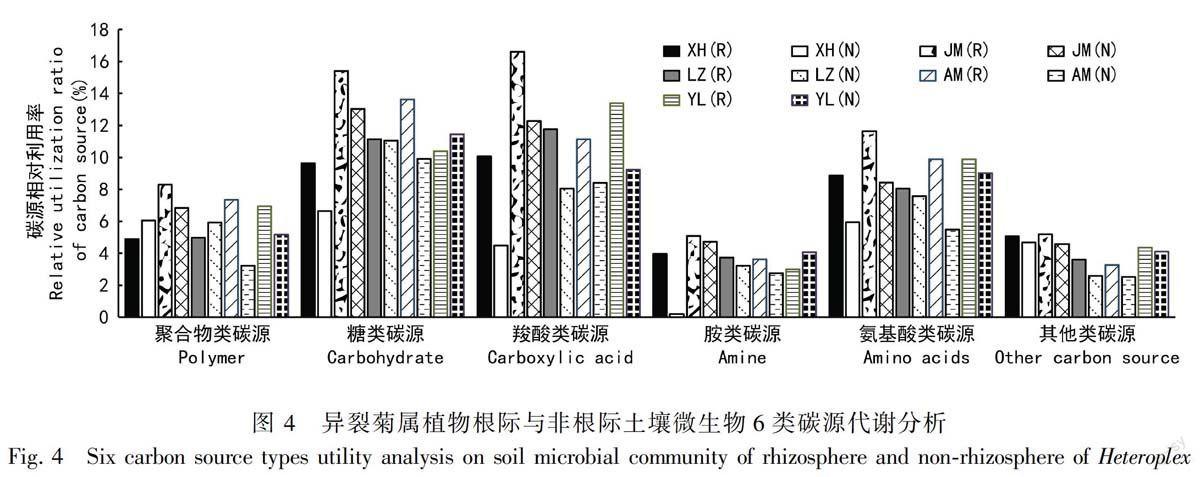
2.3.3 異裂菊屬植物根際與非根際微生物利用碳源的類型 Biolog板上的31種碳源可分為糖類、氨基酸類、 羧酸類、 聚合物類、胺類和其他類六大類。由圖4可知, 異裂菊屬植物對各類碳源的利
用能力存在明顯的差異。異裂菊屬植物根際、非根際微生物利用的碳源主要是糖類和羧酸類,對胺類和其他類碳源的利用能力相對較低。除異裂菊根際微生物利用糖類的能力低于非根際外,其他4個種的根際微生物利用碳源的能力均高于非根際。異裂菊屬5個種根際微生物利用羧酸類碳源的能力均高于非根際。此外,異裂菊屬5個種根際微生物利用氨基酸類碳源、其他類碳源的能力也高于非根際。絹葉異裂菊(JM)根際微生物利用碳源的能力相對高于其余4個種。
2.4 異裂菊屬植物根際與非根際微生物碳源利用多樣性的主成分分析
對72 h時各碳源的AWCD值進行主成分分析(圖5),在31種碳源因子中提取前5個因子的貢獻率可達86.40%,第1、2主成分得分貢獻率分別為36.88%、24.63%,兩者累積貢獻率達61.51%,因此將前兩個主成分得分作圖來表征微生物群落碳源代謝特征。主成分分析圖中樣品間距離越近表示其碳源利用能力相似度越高。由圖5可知,在第一主成分上可將5個種的根際、非根際利用碳源的能力分開,其根際利用碳源的能力強于非根際。在第二主成分上5個種根際、非根際微生物利用碳源的能力區(qū)別也較為明顯,其根際強于非根際。
2.5 異裂菊屬植物根際與非根際微生物碳源與土壤因子的冗余分析
冗余分析可確定土壤理化性質對土壤微生物碳源利用模式的影響。土壤理化性質與碳源之間關系二維排序圖如圖6所示。由圖6可知,陽離子交換量、黏粒含量百分率和堿解氮的箭頭連線最長,這3個指標對微生物碳源利用模式起到很好的解釋,是影響碳源利用模式的最重要因子。影響異裂菊屬5個物種根際、非根際微生物碳源利用模式的土壤因素不同。
3 討論與結論
根際和土壤微生物可影響土壤中物質轉化、能量流動反應的生態(tài)過程,如有機化合物、高等植物和微生物殘體的水解、生物固氮、磷、硫、鐵及其他元素轉化等(王茹華等,2007)。異裂菊屬植物在石山上的分布區(qū)域未受人為干擾,采集的植物根際土壤和非根際土壤位于同一區(qū)域,根際土壤肥力及其影響因子與非根際相同,但增加了植株的影響。本研究發(fā)現(xiàn)異裂菊屬5個物種根際土壤pH、堿解氮、速效磷、全磷、速效鉀、交換性鉀、交換性鈣、交換性鎂、全氮含量都高于非根際土壤,說明異裂菊屬植物根際肥力均有不同程度提高,該區(qū)域土壤的保肥和補給能力增強,有利于植物生長。這與何滕兵等(2000)研究結果一致。
植物根際環(huán)境非常利于微生物生存,很多植物物種的根系對土壤微生物群落有顯著的影響,可使其群落結構發(fā)生較大改變。本研究中,異裂菊屬根際微生物群落利用碳源的能力高于非根際也證明了這一點。與此同時,本研究結果表明同一屬的植物根際微生物群落對碳源的代謝特征較相似,但不同物種的代謝強度存在差異,絹葉異裂菊根際微生物對碳源利用能力最強,凹脈異裂菊非根際微生物對碳源的利用能力最弱,其他隊碳源的利用能力比較接近。
在六類碳源中,糖類、羧酸類和氨基酸類化合物是異裂菊屬5個種土壤微生物的主要碳源,其次是聚合物類、胺類和其他類型的碳源化合物。主成分分析表明,對PC1和PC2起分異作用的主要碳源分別為羧酸類化合物類和糖類化合物。說明羧酸類化合物類和糖酸類是5種植物群落的微生物群落變化的敏感碳源。本研究結果表明不同植物根際微生物對各碳源具有不同的利用能力,因為這些植物可通過分泌不同的分泌物來影響微生物群落中利用此類碳源微生物的生長。羧酸類化合物類和糖類化合物是5種植物根際微生物的主要碳源,說明這兩種化合物是土壤中廣泛存在且能被各種微生物很好利用的碳源種類。
據(jù)報道,根系分泌物中糖類化合物占可溶性組分的65%,有機酸占33%,其他2%為氨基酸、脂肪酸等。可溶性糖、氨基酸、有機酸等小分子可溶有機物具有絡合、螯合能力,可為根際微生物提供有效的碳源和氮源,影響土壤微生物種群的分布。目前這方面的研究已較為全面。異裂菊屬根際微生物利用羧酸類化合物碳源的能力最強,說明該類化合物在根際土壤中含量較高或較為普遍。這可能是由于異裂菊屬植物分布地土壤呈堿性,鹽基離子含量高。異裂菊屬分泌的α-酮丁酸等羧酸類化合物不但可以為金屬離子提供配位體,影響其生物有效性,還可以酸化土壤微環(huán)境。
Kaufmann et al(2004)認為,在營養(yǎng)貧瘠的土壤中,微生物群落功能多樣性主要受自然條件、土壤理化性質的影響。本研究中,陽離子交換量、黏粒含量百分率和堿解氮是影響碳源利用模式的最重要因子。這是由于土壤陽離子交換量是反映土壤保肥、供肥和緩沖能力的重要指標(劉世全等,2004),代表土壤肥力水平,肥力高的土壤可提供的生物有效碳源多,能維持較高的微生物活性并激發(fā)微生物生長發(fā)育(Macci et al, 2016)。土壤團聚體是構成土壤的結構單元,對土壤結構和土壤肥力的形成具有重要作用(文倩等,2014)。森林土壤中碳含量遠高于氮,堿解氮含量較低,堿解氮成為土壤中微生物生長繁殖的限制因素。
DGGE技術對微生物群落中數(shù)量小于1%的種群檢測敏感度較低。兩種微生物16S rRNA的GC含量相同,但序列組成卻不同,如從DGGE圖譜上看它們是同一個條帶,這就導致不能準確的判定微生物群落的多樣性,分析結果會產生一定的誤差。Biolog實驗得到的數(shù)據(jù)量很大,但從微生物代謝功能信息中得到的群落結構的詳細信息還很有限,必須結合其他方法深入研究微生物群落結構與功能及其相互關系。
參考文獻:
EISENHAUER N, SCHEU S, JOUSSET A,? 2012.? Bacterial Diversity stabilizes community productivity [J].? PLoS ONE, 7(e345173).
FU LG, 1992. Chinese plant red book [M].? Beijing:Science Press.?? [付立國, 1992.? 中國紅皮書——稀有瀕危植物 [M].? 北京:科學出版社.]
HAREMANN A, ROTHBALLER M, SCHMID M,? 2008.? Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research [J].? Plant Soil, 312: 7-14.
HE TB, LIU YS, LI TZ, et al, 2000.? Soil characteristics of Zanthoxylum Bungeanum with soil and water conservation benefits in karst valley of Guizhou Province [J].? J Soil Water Conserv, 14(2):55-59.?? [何滕兵, 劉元生, 李天智, 等, 2000.? 貴州喀斯特峽谷水保經濟植物花椒土壤特性研究 [J].? 水土保持學報, 14(2): 55-59.]
JORGE RO, AXEL DE Z, TON B, et al, 2016.? Bacterial rhizosphere biodiversity from several pioneer desert sand plants near Jizan, Saudi Arabia [J].? Open Conf Proc J, (1):71-79.
KAUFMANN K, CHRISTOPHERSEN M, BUTTLER A, et al, 2004.? Microbial community response to petroleum hydrocarbon contamination in the unsaturated zone at the experimental
field site Vaerlose, Denmark [J].? Fems Microbiol Ecol, 48(3):387-399.
LIU SQ, PU YL, ZHANG SR, et al, 2004.? Spatial change and affecting factors of soilcation exchange capacity in Tibet [J].? J Soil Water Conserv, 18(5):1-5.?? [劉世全,蒲玉琳,張世熔, 2004.? 西藏土壤陽離子交換量的空間變化和影響因素研究 [J].? 水土保持學報,18(5):1-5.]
MACCI C, DONI S, PERUZZI E, et al, 2016.? Biostimulation of soil microbial activity through organic fertilizer and almond tree association [J].? Land Degrad Dev, 27(2):335-345.
PII Y, MIMMO T, TOMASI N, et al, 2015.? Microbial interactions in the rhizosphere: beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process [J].? Biol Fert Soils, 51(4): 403-415.
QIN HN, LIU Y, 2010. A checklist of vascular plants of Guangxi [M].? Beijing: Science Press.?? [覃海寧, 劉演, 2010.? 廣西植物名錄 [M].? 北京:科學出版社.]
SHI YC, TANG JM, CHAI SF, et al, 2017.? Genetic diversity and relationship of endangered plant Heteroplexis microcephala assessed with ISSR polymorphisms [J].? Guihaia, 37(1):9-14.?? [史艷財, 唐健民, 柴勝豐, 2017.? 廣西特有珍稀瀕危植物小花異裂菊遺傳多樣性分析 [J].? 廣西植物, 37(1): 9-14.]
SU CL, WANG HW, XIE XG, et al, 2016.? Effects ofendophytic fungi and Atractylodes lancea powder on rhizosphere microflora and trace elements during continuous peanut cropping [J].? Acta Ecol Sin, 36(7):2053-2065.?? [蘇春淪, 王宏偉, 謝星光, 等, 2016.? 內生真菌與蒼術粉對連作花生根際微生物區(qū)系和微量元素的影響 [J].? 生態(tài)學報, 36(7):2053-2065.]
WANG PC, MO BT, CHEN Y, et al, 2016.? Effect of karst rocky desertification on soil fungal communities in southwest China [J].? Genet Mol Res, 15(3):1-12.
WANG RH, ZHANG QF, ZHOU BL, et al, 2007.? Analysis on the interaction between root exudates andrhizosphere microbes [J].? Chin J Soil Sci, 38(1): 167-172.?? [王茹華,張啟發(fā),周寶利,等, 2007.? 淺析植物根分泌物與根際微生物的相互作用關系 [J].? 土壤通報, 38(1): 167-172.]
WEN Q, LI PP, LIN QM, et al, 2014.? Characteristics of microbial biomass attributes in soil dry aggregates from lands of different uses in the semi-arid area [J]. Acta Ecol Sin, 34(24): 7403-7410.?? [文倩,李培培,林啟美,等, 2014.? 半干旱地區(qū)不同土地利用方式下土壤團聚體的微生物量屬性 [J].? 生態(tài)學報, 34(24): 7403-7410.]
YI SR, HUANG Y, XIAO B, et al, 2012.? A preliminary study of the dynamic variation of rhizosphere microorganism communities of the endangered plant Cathaya argyrophylla [J].? J SW Univ (Nat Sci Ed), 34(9): 48-53.?? [易思榮, 黃婭, 肖波, 2012.? 瀕危植物銀杉根際微生物群落動態(tài)變化研究 [J].? 西南大學學報(自然科學版), 34(9): 48-53.]

