初中化學復雜反應的順序考慮
周春元
(浙江省象山縣文峰學校 315700)
在中考化學試題中,復雜反應的順序問題是個難點,也是考查的一個要點.因此對復雜反應的順序研究,不僅能提高學生對化學反應的實質認識,還能提高學生中考中的分數,解決初中化學教學存在的遺漏點.而考查的內容有三類,第一類是金屬與酸和鹽單純的置換反應與計算、圖表等結合;第二類是由資料提供的反應遷移到非金屬的置換反應;第三類是金屬和金屬氧化物與酸的反應判斷結果.現以中考中出現的試題為例,逐一加以分解.
一、金屬與酸和鹽單純的置換反應與計算、圖表等的結合
這一類試題,考查的目的之一是學生對于金屬活動性順序表的認識,常見的錯誤是,1.分不清哪一種金屬排在前?哪一種金屬派在后?2.置換反應只知道有順序,不知道順序的實質.所以,解題時既要考慮金屬在金屬活動性順序表的排列前后,也要考慮置換反應中順序的實質是:排列在前的金屬全部反應后,排列在后的金屬才能參加反應.
例1 (湖南省湘潭市2017年中考化學試題)現有一包由3.2g銅、13g鋅和2g 碳組成的粉末,放到一定量的AgNO3溶液中,完全反應后得到的固體為m種,溶液中溶質為n種.下列說法中不正確的是( ).
A.若m=2,則n=2或3
B.若固體中金屬的質量為48 g,則m=4
C.當m=3時,溶液可能呈藍色
D.反應后固體的質量不可能超過56g


65 216
13 gx
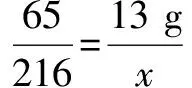

64 216
3.2 gy

由此看來,當只有鋅全部反應時,固體中金屬的質量是43.2g,當鋅和銅全部反應時,固體中金屬的質量是43.2g+10.8g=54g,這是最多的.所以48g是在43.2g和54g之間,只能判斷銅部分反應,完全反應后得到的固體為碳、銀、銅,m=3,故B選項若固體中金屬的質量為 48g,則m=4,是錯誤的.但D選項反應后固體的質量不可能超過56g,因為固體中金屬的質量最大的是54g,54g+2g=56g,故是正確的.因此正確的答案是B.
二、由資料提供的反應遷移到非金屬的置換反應
這類試題的特點是提供金屬與鹽溶液置換反應的情景,然后讓學生去遷移非金屬與相對應的鹽反應也符合置換反應規律.目的是使學生知道從已知的金屬與鹽溶液的置換反應,通過對比了解非金屬與鹽的置換反應.所以它的解法是:第一,在反應化學方程式中找到一對非金屬.第二,依據金屬活動性強弱的原理判斷非金屬元素的強弱.第三、依據金屬的置換反應的原理書寫化學反應方程式.
例2 (2017年大慶市中考化學試題)金屬活動性順序在工農業生產和科學研究中都有重要作用.現有A、B、C三種金屬,A、B可溶于鹽酸,C不溶于鹽酸,將A投入BCl2溶液中可發生反應:A+BCl2=ACl2+B.
(1)A、B、C三者金屬活動性由強到弱的順序為____.與金屬置換反應規律相同,非金屬單質之間的置換反應也有類似的規律,根據下列反應:


(2)Cl2、Br2和I2單質的活潑性由強到弱的順序為____.
(3)根據以上規律,下列反應可以發生的是____.


(4)經查閱資料,硫單質的活潑性比Cl2、Br2和I2都弱,請任寫一個化學方程式證明該結論____.

三、金屬和金屬氧化物與酸的反應判斷結果
這種試題比前面兩個反應都復雜了,不僅要考慮金屬活動性順序,還需要考慮金屬和金屬氧化物與酸是往往同時起反應.所以解題的要點,首先考查金屬與酸起反應和金屬氧化物與酸起反應;接著考察金屬與屬氧化物與酸反應后的鹽起反應,這三個反應基本處于同步的趨勢,也是學生失分的地方.
例3 (湖北鄂州市2017年中考化學試題)將一定質量的鐵粉和氧化銅粉末投入到一定質量的稀硫酸中,充分反應后過濾,得到濾液M和濾渣N,下列有關說法:①濾液M中一定含有硫酸鐵,可能含有硫酸和硫酸銅;②在濾液M中放入一塊剛打磨過的鋅片,一定有置換反應發生;③向濾渣N中滴加稀硫酸,可能有氣泡產生;④當濾液M中含有硫酸銅時,濾渣N中一定沒有氧化銅.其中一定正確的說法是( ).
A.①② B.②③ C.③④ D.①④
解析在這里鐵粉與稀硫酸反應有硫酸亞鐵生成,氧化銅與稀硫酸反應有硫酸銅生成,鐵與反應后生成的硫酸銅溶液也能反應,有銅和硫酸亞鐵生成,所以比較復雜.但①濾液M中一定含有硫酸鐵是錯誤的,因為無論怎么反應只生成硫酸亞鐵.②在濾液M中放入一塊剛打磨過的鋅片,那么鋅排在鐵和銅的前面,所以不管溶液中是否存在硫酸銅,起碼鋅與硫酸亞鐵能發生置換反應,因此②是正確的,而當鐵粉過多,氧化銅少,稀硫酸也少時,濾渣N中就含有鐵粉,這樣③向濾渣N中滴加稀硫酸,有氣泡產生,所以③是正確的.④當濾液M中含有硫酸銅時,只能說明鐵粉的量少,如果鐵粉量多,那么硫酸銅還要與鐵的,但不能得出氧化銅有沒有剩余的問題,所以濾渣N中一定沒有氧化銅是錯誤的,即④是不正確.故正確答案是B.
總之,復雜的反應,既要考慮反應前后順序問題,也要考慮反應的同步性的問題,才能完全理解題意,并解答問題.
參考文獻:
[1]袁運開.科學:九年級下[M].上海:華東師范出版社,2016.

