無機化學方程式書寫的教學策略
周 慧
(浙江省桐鄉市鳳鳴高級中學 314500)
化學方程式是化學的一種特殊語言,根據化學方程式能夠了解物質的性質,理解化學反應的原理,掌握各物質之間的定量關系,書寫出正確化學方程式是學好化學的必備條件.
一、學生書寫中常見的錯誤
為了解學生書寫中常見的錯誤,筆者對43位學生進行了《化學1》中七個經典化學方程式的問卷調查(見表1),經過分析發現了學生在化學方程式書寫中出錯的原因.
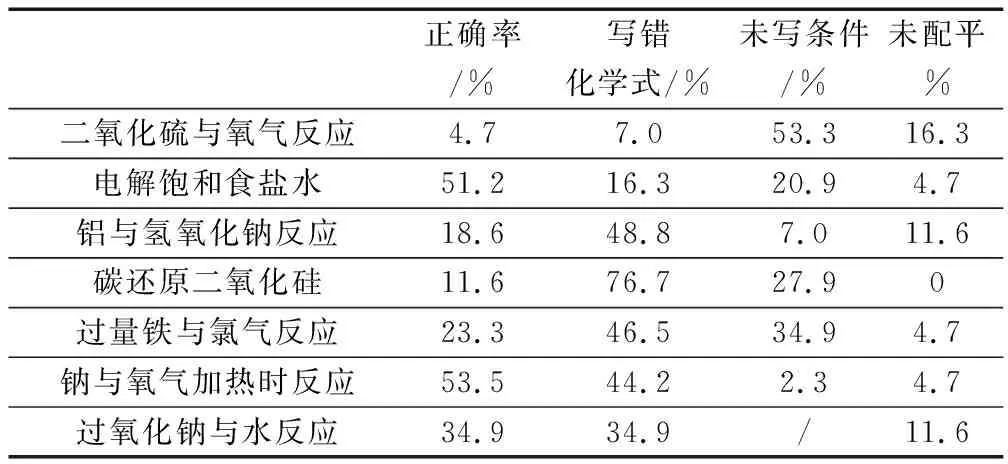
表1 化學方程式書寫錯誤統計
從以上數據可以看出,化學方程式的書寫是普通高中學生學好化學的一大難題,究其原因主要有以下三個方面:
其一,化學式書寫錯誤.正確書寫物質的化學式是正確書寫化學方程式的前提,這就要求學生會寫元素符號,記住常見原子和原子團的化合價,并明確“各元素正負化合價代數和為零”的規律,三者缺一不可.對于高中學生而言,寫對元素符號已不成問題,但是學生對元素的化合價尤其是部分變價元素的化合價不能很好地把握.然而學生寫錯化學式的最主要原因卻是沒有使各元素的正負化合價代數和為零,如次氯酸鈣寫成CaClO等,可見學生沒有養成嚴謹的學習習慣.
其二,未注明反應條件(包括等號和可逆符號的混用).一個反應的發生有其特定的反應條件,如電解飽和食鹽水,一定需要電解的條件,否則反應難以進行.有的反應條件不同時生成的產物也不同,如鈉和氧氣在常溫下生成氧化鈉,在加熱下生成過氧化鈉.條件漏寫往往是因為學生在學習時沒有很好地理解化學反應的原理,不明白等號和可逆符號代表的含義,僅憑機械性記憶,時間長了,難免弄混弄錯.
其三,化學方程式未配平.部分學生在寫好化學方程式后沒有養成檢查的習慣,然而更多的學生卻是對配平化學方程式有心無力.配平化學方程式是學生一種技能的體現,對于氧化還原反應,必須要有一定的邏輯順序,即先遵循得失電子守恒,再滿足電荷守恒,最后用觀察法將方程式配平,這些能力無法一蹴而就,需要在平時教學中不斷地加以訓練和培養.
二、針對性教學實施策略
1.聯系實驗,強化物質記憶
美國心理學家布魯納曾經說過:“對學生最好的刺激乃是所學的材料的興趣”.化學是一門實驗科學,實驗現象的豐富多彩能有效地引起學生的注意力,所以在教學中多采用演示實驗和學生實驗激發學生學習化學的興趣,同時也提升學生對實驗的觀察能力和分析能力.化學方程式的書寫是以實驗事實為基礎的,不能憑空捏造,所以實驗能加強學生對反應原理的感性認識,實驗現象豐富多彩,那么實驗原理也就不容易遺忘.
學生在化學方程式書寫中易把H2寫成O2,在學習鈉與水反應的知識時,教師應補充氣體檢驗部分的實驗,即將收集到的氣體靠近酒精燈火焰,就會有爆鳴聲,由此強化對產物氫氣的記憶.基于現象寫出物質的基礎上,只需用觀察法加以配平即可.因此在化學方程式的教學時,選擇性地多做演示實驗或者學生實驗,指導學生有目的地觀察實驗現象,加深對實驗的印象,見識各種顏色的化學物質,從而有效地記憶和書寫化學方程式,同時也鍛煉了學生的動手能力和思維能力.
2.梳理規律,提升分析能力
(1)歸類——尋找統一性策略
雖然化學反應眾多,但若能通過已有知識去推理記憶新的化學方程式,必將事半功倍.例如初中已有CO2的化學性質學習,在學習SO2時,可采用歸類法,抓住其酸性氧化物的屬性,類比于CO2,即可分析出它與水、堿和堿性氧化物的反應(見表2),化學方程式的書寫也可參照CO2引導學生進行獨立嘗試.

表2 CO2和SO2的化學性質
(2)對比——著眼差異性策略
有些化學方程式既有相似之處,但也有區別,學生在學習時容易將其弄混,教師在教學時指導學生可將這些化學方程式放在一起對比,尋找、歸納其中的規律,從而減少錯誤的產生.例如學生在學習硝酸性質的時候,講到鐵與硝酸的反應,涉及四個化學方程式:
鐵與過量濃硝酸加熱反應:

鐵與過量稀硝酸反應:

過量鐵與稀硝酸反應:

初看這三個化學方程式各不相同,但是仔細觀察還是有規律可循的:稀硝酸對應的還原產物為一氧化氮,而濃硝酸對應的產物為二氧化氮.不管稀硝酸還是濃硝酸都是強氧化劑,都有能力將鐵氧化到+3價,所以硝酸過量的時候,鐵均為Fe(NO3)3,但若鐵過量,產物Fe(NO3)3會與過量的鐵進一步反應生成Fe(NO3)2:

故鐵過量時最終產物均為Fe(NO3)2,所以在書寫化學方程式時,先根據反應物推斷出產物,再利用得失電子守恒的方法將化學方程式配平.
(3)整理——探究數量間關系

3.構建網絡,完善書寫技能
布魯納曾指出:“獲得的知識如果沒有完美的結構把它聯系在一起,那是一種多半會被遺忘的知識,一連串不連貫的論據在記憶中僅有短促的可憐的壽命.”元素化合物的每個知識點都會涉及相應的方程式,零碎而繁多,似乎沒有規律可尋,難以記憶.這就需要教師在教學中幫助學生理清思路,抓住知識的主線,將零碎的知識點串聯起來,尤其是在章節復習中可以選擇利用畫網絡圖的形式幫助學生將更多的化學知識點串聯起來,幫助學生理清各種物質之間的相互轉化,加深對所學知識的理解.這種網絡圖也可以在教師的指導下,由學生自己動手去畫,提高學生對知識的總結歸納能力,提升學生的科學素養.
例如在學習了硫及其主要化合物的性質后,可以將有關的化學反應整理成圖1.

圖1
從這張網絡圖中不僅清楚地告訴學生這一章所學的主要化合物,還能夠清楚地顯示各種物質之間的相互轉化,從圖中還可以發現縱列上的物質相互轉化時硫的化合價沒有變化,發生的是非氧化還原反應,而橫向物質間轉化時硫的價態發生了改變,所以屬于氧化還原反應,配平時需要注意得失電子守恒.
總之,方程式是化學獨特的語言,是一種特殊的表現形式,是學習化學和交流化學的基石.高水平的方程式書寫教學,其實質是對化學原理的理解,是個體化學素養的再現.
參考文獻:
[1]李朝章.高中化學方程式教學策略[J].科教文匯,2010(10):128-129.
[2]陶行知.陶行知全集[M].成都:四川教育出版社,2005.
[3]常如正.高中化學方程式教學思考[J].中學生數理化(學研版),2014(01):76.
[4]陳金星.略談“多方位、全到位”的有效教學策略-以“鈉和水反應”化學方程式的教學對策為例[J].科教文匯,2011(08):125-126.

