表皮生長因子對Hela細胞緊密連接蛋白3表達的影響及其可能機制*
劉芳,桂定清,張力憶
(四川省達州市中心醫院 婦產科,四川 達州 635000)
宮頸癌為常見婦科惡性腫瘤,腫瘤細胞侵襲轉移是影響患者預后的重要原因[1],探明其侵襲轉移機制有助于開展靶向性治療以提升預后。目前研究證實,細胞黏附能力的喪失可能導致細胞連接的破壞,進而促進腫瘤的浸潤和轉移[2],上皮細胞的黏附主要依靠黏附連接和緊密連接,Claudin蛋白是緊密連接的重要密閉蛋白[3]。已有報道[4-5]證實,多種Claudin蛋白在包括宮頸癌在內的多種癌癥組織中表達量增加,且有研究[6]證實表皮生長因子(epidermal growth factor,EGF)能夠促進宮頸癌細胞轉移。本文研究EGF對宮頸癌細胞緊密連接蛋白3(Claudin-3)表達的影響及該影響的形成機制,現報道如下。
1 材料與方法
1.1 材料、試劑及儀器
主要材料:人宮頸癌Hela細胞株[購自中國科學院細胞庫(上海)]。主要試劑:EGF(購自美國Peprotech),總RNA提取試劑盒(購自美國Invitrogen),總蛋白提取試劑盒(購自上海偉進),PCR試劑盒(購自日本TaKaRa),磷酸酶抑制劑、EGF受體(EGF receptor,EGFR)阻斷劑(ZD1839)、磷脂酰肌醇3-激酶(phosphatidylinositol-3 kinase,PI3-K)阻斷劑(LY294002及Wortmannin)、促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)阻斷劑(PD98059及 U0126)、p38阻斷劑(SB203580)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)阻斷劑(SP600125)(均購自美國Sigma),Western blot試劑盒(購自北京中山金橋),PCR引物由生工生物工程(上海)股份有限公司提供。
1.2 方法
1.2.1 前期細胞培養 Hela細胞株接種于含有10%小牛血清的DMEM培養基,在37℃、5%二氧化碳CO2、飽和濕度條件下培養。細胞生長至70%~80%融合后,消化并將細胞以2×106個/孔的密度接種于6孔板,同樣條件下培養24 h,達到貼壁生長狀態。去除培養基,以無血清DMEM培養基繼續培養16~18 h,開展后續處理。
1.2.2 實驗路徑 所培養的Hela細胞分別用于開展3項實驗,且各項研究均設3個復組:①分別加入含 有 EGF終 濃 度 0.0、0.5、5.0、10.0、100.0 ng/ml的DMEM培養基,培養8 h,搜集細胞,檢測Claudin-3蛋白及信使RNA(messenger RNA, mRNA)的表達情況;②加入含有EGF終濃度10 ng/ml的DMEM培養基,分別在培養0 min、10 min、30 min、1 h、2 h、4 h、8 h、24 h,搜集細胞,檢測不同時間Claudin-3蛋白及mRNA的表達情況和EGFR、蛋白激酶B(protein kinase B, AKT)、細胞外調節蛋白激酶1/2(extracellular regulated protein kinases 1/2, ERK1/2)、p38、JNK磷酸化情況;③分別加入不含任何阻斷劑、含ZD1839終濃度10 nmol/L、含LY294002終濃度20 nmol/L、含Wortmannin終濃度5 nmol/L、含PD98059終濃度20 nmol/L、含U0126終濃度10 nmol/L、含SB203580終濃度10 nmol/L、含SP600125終濃度10 nmol/L的DMEM中培養1 h,再加入終濃度為10 ng/ml的EGF培養后,搜集細胞,測評各阻斷劑特異性阻斷效果和Claudin-3蛋白及其mRNA的表達情況。
1.2.3 mRNA檢測 采用實時熒光定量聚合酶鏈反 應(quantitative real-time polymerase chain reaction,qRT-PCR)技術檢測Claudin-3 mRNA表達情況。引物設計見表1。反應條件:55℃水浴40 min;94℃變性40 s,55℃退火45 s,72℃延伸40 s,30個循環;72℃延伸 5 min。反應體系 :PCR Mater Mix 10 μl、cDNA模板5 μl,正向及反向引物20 nmol/L,無菌水定容至20 μl。檢測結果采用2-△△Ct表示。
1.2.4 蛋白水平檢測 采用Western bolt法檢測各蛋白水平。搜集細胞總蛋白,采用Bradford法測定蛋白濃度,取各樣本總蛋白50 μg,將體系混勻后,加熱煮沸5~10 min,立即置于冰上,完全冷卻后瞬間離心,上樣,加入一抗,4℃孵育過夜,洗膜后加入二抗,加入DAB底物顯色液,獲得并分析凝膠圖像。
1.3 統計學方法
數據分析采用SPSS 19.0統計軟件,計量資料以均數±標準差(±s)表示,兩組比較采用t檢驗;多組間比較采用單因素方差分析和SNK-q檢驗,P<0.05為差異有統計學意義。
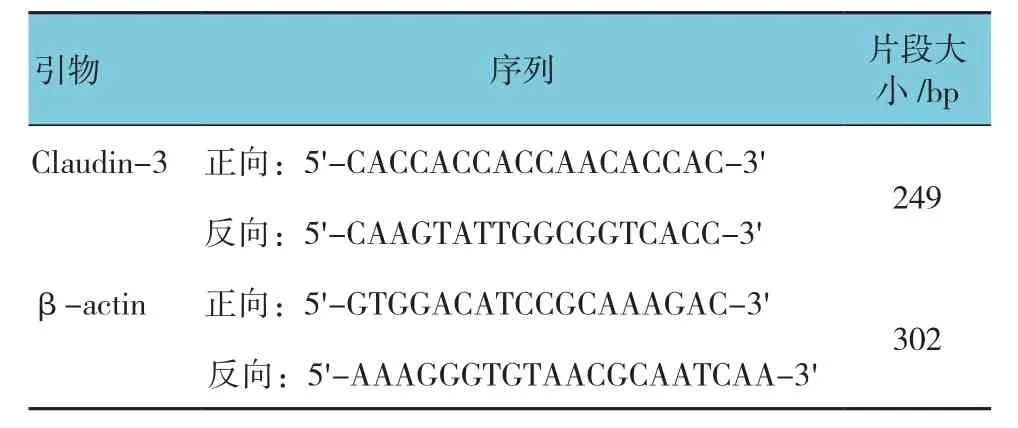
表1 Claudin-3 mRNA檢測引物設計
2 結果
2.1 細胞培養結果
接種至6孔板后,培養至24 h,細胞貼壁良好,可基本覆蓋孔壁,且細胞存活率高,經顯微鏡觀察,其細胞形態呈多邊形或不規則狀,且細胞有聚集生長特性,連接緊密。見圖1。
2.2 不同終濃度EGF對Claudin-3蛋白及mRNA表達的影響
總體分析顯示,不同終濃度處理后,Hela細胞中Claudin-3蛋白及mRNA表達水平比較,差異有統計學意義(均P=0.000)。經兩兩比較,顯示且以10 ng/ml終濃度EGF處理,上調幅度最大。見表2和圖2。
2.3 10 ng/ml EGF處理后Claudin-3蛋白及mRNA不同時間表達情況
處理24 h后,Claudin-3蛋白表達增加(t=75.685,P=0.000);隨著處理時間的延長,Claudin-3 mRNA表達呈上升趨勢(F時間=157.114,P=0.000)。見圖3。
2.4 EGF對EGFR、AKT、ERK1/2、p38和JNK磷酸化的影響
驗證顯示,EGF處理后,Hela細胞內EGFR、AKT、ERK1/2、p38和JNK均出現磷酸化現象,且AKT、JNK磷酸化在處理30 min最明顯,EGFR、ERK1/2、p38磷酸化在處理10 min最明顯。見表3。
2.5 信號阻斷劑對EGFR、AKT、ERK1/2、p38及JNK磷酸化的影響
驗證顯示,ZD1839能夠特異性阻斷EGFR磷酸化;LY294002、wortmannin能夠特異性阻斷AKT磷酸化;PU98059、U0126能夠特異性阻斷ERK1/2磷酸化;SB203580能夠特異性阻斷p38磷酸化;SP600125能夠特異性阻斷JNK磷酸化。
2.6 各信號通路阻斷對Claudin-3蛋白表達的影響
阻斷EGFR、AKT、ERK1/2、p38及JNK磷酸化后,經10 ng/ml EGF干預24 h后,Claudin-3蛋白表達均受到抑制(P<0.05),見圖4。

圖1 細胞培養結果
表2 不同終濃度EGF處理后Claudin-3蛋白及mRNA相對表達量比較 (±s)
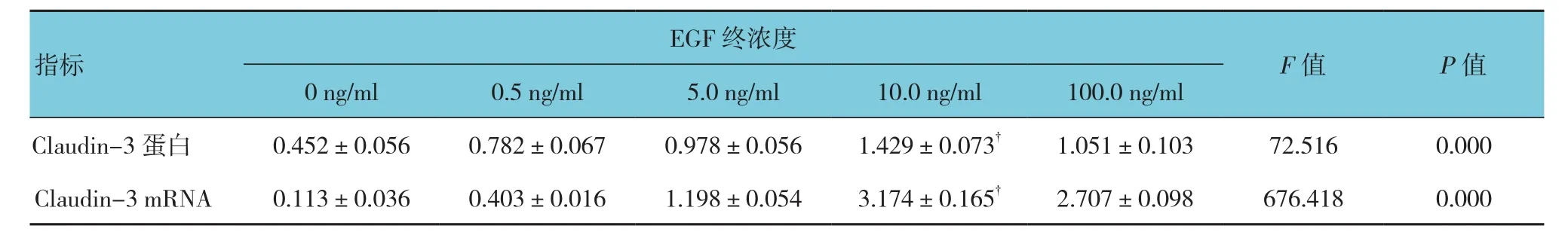
表2 不同終濃度EGF處理后Claudin-3蛋白及mRNA相對表達量比較 (±s)
注:?與其他濃度比較,P <0.05
EGF終濃度F值 P值0 ng/ml 0.5 ng/ml 5.0 ng/ml 10.0 ng/ml 100.0 ng/ml Claudin-3蛋白 0.452±0.056 0.782±0.067 0.978±0.056 1.429±0.073? 1.051±0.103 72.516 0.000 Claudin-3 mRNA 0.113±0.036 0.403±0.016 1.198±0.054 3.174±0.165? 2.707±0.098 676.418 0.000指標

圖2 不同終濃度EGF處理后Claudin-3蛋白及mRNA表達情況
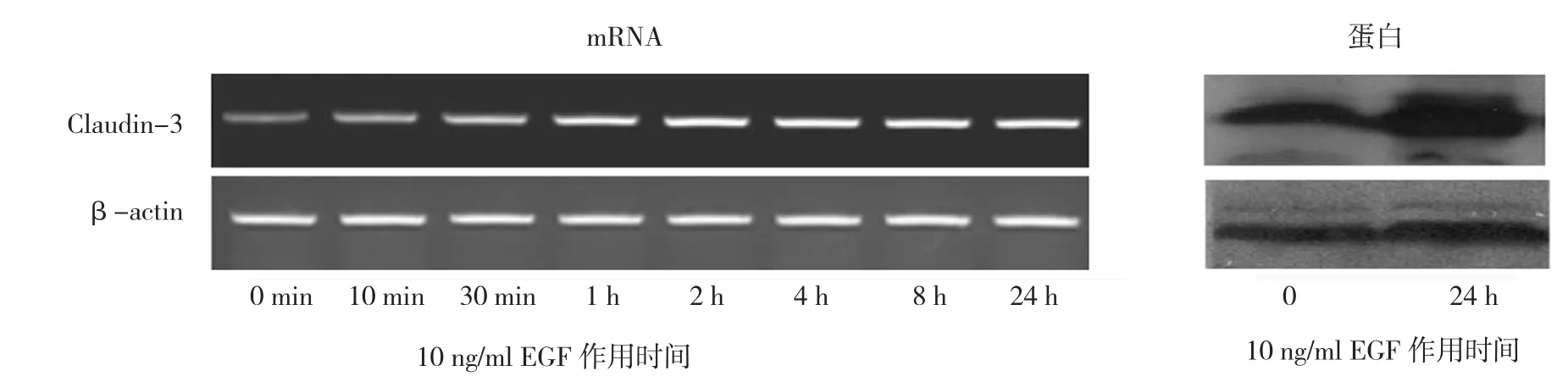
圖3 10 ng/ml EGF處理后Claudin-3蛋白及mRNA不同時間表達情況
表3 EGF處理后EGFR、AKT、ERK1/2、p38及JNK磷酸化情況 (±s)

表3 EGF處理后EGFR、AKT、ERK1/2、p38及JNK磷酸化情況 (±s)
注:?與其他時間比較,P <0.05
?
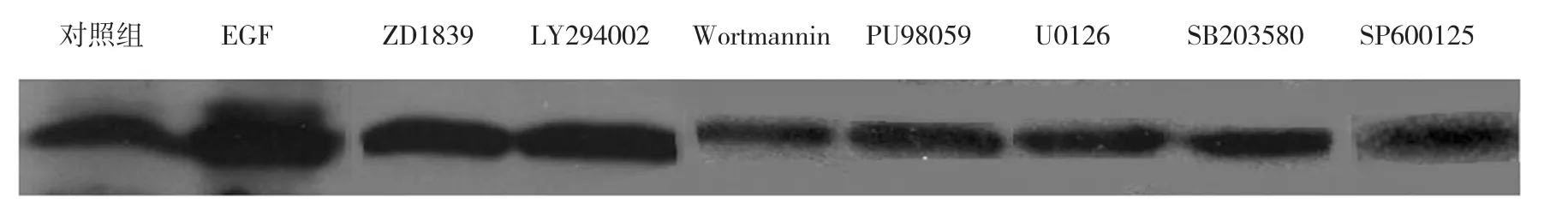
圖4 各信號通路阻斷對Claudin-3蛋白表達的影響
3 討論
侵襲和轉移是影響宮頸癌患者預后的重要因素,目前研究顯示細胞間黏附力的喪失可導致細胞連接破壞,為腫瘤細胞侵襲和轉移創造條件[7],Claudins是形成緊密連接的主要骨架[8],其表達的上調或下降均可導致緊密連接的重組,CUNNIFFE等[9]報道指出Claudin-1、Claudin-7單一過表達不增加宮頸癌發生率,但均過表達可能預示宮頸惡性病變,同時兩者過表達有助于抑制Hela細胞的侵襲和轉移能力,針對性研究Claudin-3與宮頸癌相關性的報道較少,但針對乳腺癌[10]、胃癌等[11]惡性腫瘤的報道提示其過表達可能與腫瘤惡性程度正相關,本研究則發現Cluadin-3在宮頸癌Hela細胞系中也存在高表達現象,這與Claudin-3生物學作用有關,其能促進細胞受體二聚化,并使細胞質位點磷酸化而與多種不同信號序列蛋白結合而促使信號傳導。大量研究證實EGFR在宮頸癌等惡性腫瘤細胞中存在過表達,其活化后能夠促進腫瘤細胞的浸潤、增殖及腫瘤血管的形成[12-13],但該過程是否有Claudin-3的參與,及EGFR對Claudin-3的調節機制,目前尚未完全明確,本研究則有助于解決該問題。
本研究發現,EGF在轉錄和翻譯水平,均誘導Hela細胞上調Claudin-3的表達,且該作用存在時間和濃度依賴型,說明EGFR信號通路能夠影響Claudin-3的表達,可能是EGFR過表達導致腫瘤惡性化程度升高的機制之一,ZHANG等[14]針對肺癌的病例研究有類似結論。EGFR的主要下游信號涉及MAPK和PI3-K通路,其中前者又包括ERK1/2、p38和JNKs等不同類型[15],本研究應用相應阻斷劑阻斷EGFR下游信號通路,EGF處理后,Hela細胞內EGFR、AKT、ERK1/2、p38及JNK均出現磷酸化現象,提示Hela細胞中EGFR信號通路激活后,各下游通路均被激活,經阻斷劑預處理則能夠特異性阻斷對應下游通路的激活,說明研究方案是可行的。本研究發現EGFR對Claudin-3的調節作用與AKT、ERK1/2、p38及JNK信號通路均有關,這說明在Hela細胞中,EGFR能夠通過多種信號通路調節Claudin-3的表達,de SOUZA WF等[16]針對結直腸癌的報道也提示ERK1/2、PI3-K/AKT信號通路能夠影響Claudin-3的表達,進而影響結直腸癌的侵襲與轉移能力;LI等[17]報道則顯示p38通路也可影響Claudins蛋白的表達;其他亦有研究[18]提示,JNK信號通路與Claudin-3表達有關。可見,由于EGFR多個下游信號通路均可影響Claudin-3的表達,可能難以通過對單一下游信號通路的阻斷抑制Claudin-3的表達,進而提升患者預后,直接干預上游信號通路可能是更好的解決方案。
綜上所述,本研究顯示EGF能夠增加Hela細胞Claudin-3的表達,其機制可能涉及EGFR、PI3-K、MAPK、p38及JNK信號通路。
[1]OBEL J, SOUARES Y, HOY D, et al. A systematic review of cervical cancer incidence and mortality in the Pacific Region[J].Asian Pac J Cancer Prev, 2014, 15(21): 9433-9437.
[2]RUNKLE E A, MU D. Tight junction proteins: from barrier to tumorigenesis[J]. Cancer Lett, 2013, 337(1): 41-48.
[3]GüNZEL D, YU A S. Claudins and the modulation of tight junction permeability[J]. Physiol Rev, 2013, 93(2): 525-569.
[4]李波, 肖鳳儀, 李小洲, 等. 生長抑素對Hela細胞中Claudin-3和Claudin-4基因表達的調節作用[J]. 現代生物醫學進展,2015, 15(7): 1249-1252.
[5]LI X, IIDA M, TADA M, et al. Development of an anti-claudin-3 and -4 bispecific monoclonal antibody for cancer diagnosis and therapy[J]. J Pharmacol Exp Ther, 2014, 351(1): 206-213.
[6]MUTHUSAMI S, PRABAKARAN D S, YU J R, et al. EGF-induced expression of fused toes homolog (FTS) facilitates epithelial-mesenchymal transition and promotes cell migration in ME180 cervical cancer cells[J]. Cancer Lett, 2014, 351(2): 252-259.
[7]KWON M J. Emerging roles of claudins in human cancer [J]. Int J Mol Sci, 2013, 14(9): 18148-18180.
[8]ZHANG X, RUAN Y, LI Y, et al. Tight junction protein claudin-6 inhibits growth and induces the apoptosis of cervical carcinoma cells in vitro and in vivo[J]. Med Oncol, 2015, 32(5): 148.
[9]CUNNIFFE C, BRANKIN B, LAMBKIN H, et al. The role of claudin-1 and claudin-7 in cervical tumorigenesis[J]. Anticancer Res, 2014, 34(6): 2851-2857.
[10]KOLOKYTHA P, YIANNOU P, KERAMOPOULOS D, et al.Claudin-3 and claudin-4: distinct prognostic significance in triplenegative and luminal breast cancer[J]. Appl Immunohistochem Mol Morphol, 2014, 22(2): 125-131.
[11]WANG H, YANG X. The expression patterns of tight junction protein claudin-1, -3, and -4 in human gastric neoplasms and adjacent non-neoplastic tissues[J]. Int J Clin Exp Pathol, 2015,8(1): 881-887.
[12]SHOSTAK K, CHARIOT A. EGFR and NF-κB: partners in cancer[J]. Trends Mol Med, 2015, 21(6): 385-393.
[13]SONG X, SHI B, HUANG K, et al. miR-133a inhibits cervical cancer growth by targeting EGFR[J]. Oncol Rep, 2015, 34(3):1573-1580.
[14]ZHANG L, WANG Y, ZHANG B, et al. Claudin-3 expression increases the malignant potential of lung adenocarcinoma cells:role of epidermal growth factor receptor activation[J]. Oncotarget,2017, 8(14): 23033-23047.
[15]TOMAS A, FUTTER C E, EDEN E R. EGF receptor trafficking:consequences for signaling and cancer[J]. Trends Cell Biol, 2014,24(1): 26-34.
[16]de SOUZA W F, FORTUNATO-MIRANDA N, ROBBS B K, et al. Claudin-3 overexpression increases the malignant potential of colorectal cancer cells: roles of ERK1/2 and PI3K-Akt as modulators of EGFR signaling[J]. PLoS One, 2013, 8(9): e74994.
[17]LI H J, GUO L M, YANG L L, et al. Electromagnetic-pulseinduced activation of p38 MAPK pathway and disruption of blood-retinal barrier[J]. Toxicol Lett, 2013, 220(1): 35-43.
[18]WANG Y, SUN T, SUN H, et al. SCF/C-Kit/JNK/AP-1 signaling pathway promotes claudin-3 expression in colonic epithelium and colorectal carcinoma[J]. Int J Mol Sci, 2017, 18(4): 765.

