兩種檢測HAV-IgM試劑的敏感性評價
張海瑩,王震宇,孔祥沙,季穎,朱凌,魏來
[北京大學人民醫院 北京大學肝病研究所(丙型肝炎和肝病免疫治療北京市重點實驗室),北京 100044]
甲型肝炎病毒(hepatitis A virus, HAV)感染及所導致的疾病成為我國嚴重的社會公共衛生問題[1]。我國屬于甲型肝炎的高發區,HAV感染可導致肝衰竭甚至死亡[2]。人感染HAV后多表現為亞臨床癥狀,檢測性能好的HAV診斷試劑,對HAV的防治尤為重要。HAV實驗室檢測主要包括HAV-IgM和HAV-IgG兩種抗體。HAV-IgG陽性表明患者既往感染過HAV,HAV-IgM是用于診斷HAV新近感染的血清學標志[3]。近年來HAV檢測試劑已得到廣泛應用,但關于不同HAV-IgM檢測試劑的敏感性如何?目前相關研究較少。為加強HAV抗體實驗室檢測的質量控制,確保檢測結果的準確性,以及為甲肝抗體人群血清流行病學調查選擇試劑提供參考,本文旨在全面評價國內市場上應用較廣的2種HAV-IgM檢測試劑,并探討其原因。
1 資料與方法
1.1 一般資料
選取2015年5月-2017年6月該院就診的疑似急性HAV感染門診和住院患者血清樣本196例。其中,男性108例,女性88例;年齡11~84歲,中位43歲。患者均轉氨酶異常升高或伴有黃疸,且均排除乙型、丙型、丁型及戊型肝炎病毒感染。
1.2 試劑與儀器
HAV-IgM檢測甲型肝炎病毒IgM抗體檢測試劑盒[化學發光微粒子免疫檢測法(chemiluminesent microparticle immuno assay, CMIA),批號:72366LI00、配套儀器為ARCHITECT i2000SR,美國雅培公司,S/CO為0.00~0.79]。當S/CO≤0.79,儀器報告結果判為陰性;S/CO為0.80~1.20是HAV-IgM試劑檢測灰區;當S/CO≥1.21,儀器報告結果判為陽性。萬泰甲型肝炎病毒IgM抗體檢測試劑盒[酶聯免疫法(enzyme-linked immunosorbent assay, ELISA)],批號:AM20170609,北京萬泰生物藥業股份有限公司,檢測波長450 nm,陽性對照吸光度值(optical delnsity, OD)平均值≥0.80,陰性對照OD值平均值≤0.10,樣本臨界值(Cut-off)=陰性對照孔OD均值×2.1,凡樣本OD值>Cut-off值為陽性。北京高達甲型肝炎病毒IgM抗體檢測試劑盒(ELISA),批號:201707006,北京現代高達生物技術有限責任公司,檢測波長450 nm,陽性對照OD值平均值≥1.00,陰性對照OD值平均值≤0.10,Cut-off=0.7116,凡樣本OD值>Cut-off值為陽性。
1.3 統計學方法
數據分析采用SPSS 19.0統計軟件,兩組間數據比較采用獨立樣本t檢驗,相關性檢驗采用Spearman相關分析,一致性檢驗采用Kappa檢驗分析,P<0.05為差異有統計學意義。
2 結果
2.1 兩種HAV-IgM敏感性和特異性
雅培HAV-IgM陽性35例,萬泰HAV-IgM陽性58例,高達HAV-IgM陽性48例。以雅培HAV-IgM檢測試劑為金標準,萬泰和高達HAV-IgM的敏感性、特異性。見表1。
萬泰、高達試劑與雅培檢測HAV-IgM有檢測結

表1 兩種HAV-IgM試劑檢測性能分析 %
果不一致的標本,其中1例雅培HAV-IgM陽性但其S/CO值較低(1.30~1.47),萬泰和高達HAV-IgM均陰性;1例雅培HAV-IgM陽性,高達HAV-IgM陽性,萬泰HAV-IgM陰性;4例雅培HAV-IgM灰區(0.80~1.20),萬泰HAV-IgM陽性但S/CO值較低(0.50~1.10),高達HAV-IgM陽性但S/CO值較低(0.80~1.10);5例雅培HAV-IgM陰性,萬泰HAVIgM陽性,其中4例S/CO值較低(均>1.00),高達HAV-IgM陽性但S/CO值為弱陽性(0.75~1.00);14例雅培HAV-IgM陰性,高達HAV-IgM陰性,萬泰HAV-IgM陽性。
2.2 兩種HAV-IgM S/CO值相關性
萬泰和雅培試劑檢測HAV-IgMS/CO值相關(r=0.597,P=0.000);高達和雅培試劑檢測HAVIgMS/CO 值相關(r=0.541,P=0.000)。見圖1、2。

圖1 萬泰和雅培試劑檢測HAV-IgM S/CO值相關性
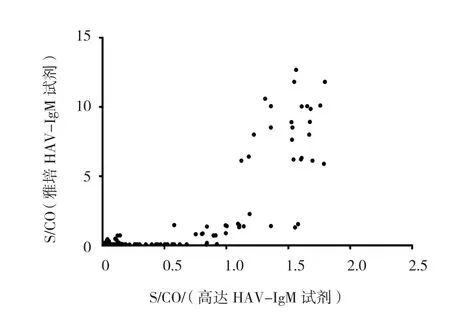
圖2 高達和雅培試劑檢測HAV-IgM S/CO值相關性比較
2.3 兩種HAV-IgM檢測試劑一致性比較
Kappa系數解釋如下,<0.00:沒有一致性;0.00~0.19:極低的一致性;0.20~0.39:一般的一致性;0.40~0.59:中等的一致性;0.60~0.79:高度的一致性;0.80~1.00:幾乎完全一致。萬泰HAV-IgM檢測試劑與雅培HAV-IgM試劑高度一致(K=0.648,P=0.000);高達HAV-IgM檢測試劑與雅培HAV-IgM檢測試劑高度一致(K=0.772,P=0.000)。見表2。
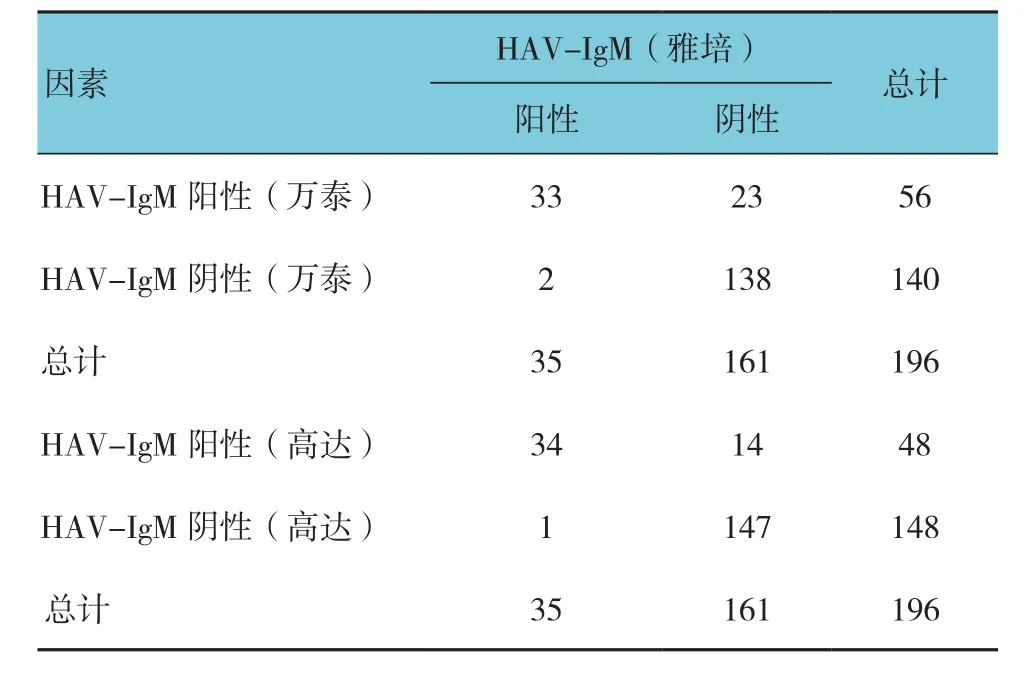
表2 兩種HAV-IgM試劑一致性比較
3 討論
甲型肝炎是世界范圍內最常見的急性病毒性肝炎[4],為許多國家嚴重的公共衛生問題之一[5]。它主要經糞-口途徑傳播,通過污染水源、食物及食具等廣泛流行[6-10],也可通過器官移植傳播[11]。甲型肝炎的實驗室診斷主要包括ELISA、CMIA及電化學發光免疫分析法(electro chemi luminescence immuno assay,ECLIA)檢測血清中HAV-IgM。雅培全自動化學發光免疫分析儀利用化學發光原理結合免疫技術進行檢測,具有敏感性好、特異性高及受干擾小的特點,與其他電化學發光免疫分析法有相關性,在臨床檢驗中有廣泛的應用,是公認的臨床檢測HAV-IgM金標準[12-14]。
本研究發現,高達試劑的敏感性、特異性均高于萬泰試劑,高達試劑和萬泰試劑均有較高的陰性預測值。研究還發現萬泰、高達試劑與雅培HAV-IgM試劑S/CO值均有相關性;萬泰、高達試劑與雅培試劑均有高度的一致性。說明兩種試劑均有很好的診斷性和可靠性,為臨床檢測試劑的選擇提供更多的依據。國內外研究對臨床常用的甲型肝炎檢測方法進行比較,黃嫵姣等[15]比較瑞士羅氏公司的ECLIA方法和上海科華生物工程股份有限公司的ELISA方法檢測HAV-IgM,發現兩種檢測結果的一致性較低。該研究使用ECLIA方法不同于筆者研究的雅培CMIA方法以及ELISA。HYEWON等[12]比較雅培CMIA、羅氏ECLIA及德國西門子公司的ADVIA Centaur全自動化學發光免疫分析系統檢測HAV-IgM,發現3種方法有高度的一致性,對16例檢測不一致的結果,雅培試劑顯示灰區,其他兩種方法均為陰性。
兩種試劑盒在檢測IgM低水平患者標本時,出現結果不一致的情況,不排除有假陽性或假陰性的可能,是臨床檢測、臨床診斷及人群血清流行病學調查時選擇檢測試劑需注意的問題。黃嫵姣等[15]研究發現,ELISA法檢驗敏感性高,但易出假陽性,羅氏ECLIA特異性好,檢測結果更符合臨床。本研究發現,雖然兩種檢測HAV-IgM試劑有不一致結果,但兩種試劑檢測的S/CO值有相關性。但HYEWON等[12]比較雅培CMIA、羅氏ECLIA及西門子ADVIA Centaur檢測HAV-IgM的S/CO值有相關性。
萬泰、高達試劑均采用ELISA法檢測HAV-IgM。ELISA法檢測HAV-IgM假陽性的主要原因:①類風濕因子,自身免疫性疾病及腎衰竭等的干擾,都可導致HAV-IgM假陽性[16-17];②標本性狀的影響,標本溶血、乳糜血或分離血清不徹底而使血清中含有纖維蛋白原影響檢測結果引起假陽性。為降低檢測假陽性率,可增大標本離心轉速(3 000 r/min),延長標本離心時間,使抗凝血標本得以徹底離心分離。ELISA法洗板機洗板時,保證洗板針無纖維蛋白或異物堵塞,將洗液注滿各反應孔,防止產生假陽性[18]。
綜上所述,國內常用的兩種HAV-IgM檢測試劑盒有很好的檢測性和一致性,可在臨床實驗室廣泛應用,為HAV診斷提供有力的支持,防止甲型肝炎流行。但在部分IgM水平較低的患者中,兩種抗體檢測試劑會存在不一致的結果,對這一部分結果還有待進一步研究,應是臨床檢測、臨床診斷及人群血清流行病學調查時選擇參考試劑需要注意的問題。進一步研發HAV-IgM的定量試劑有助于診斷不典型的HAV感染及移植后的HAV再激活。
[1]寧桂軍, 程萱芹, 陳園生, 等. 貴州省旱災期間一起甲型病毒性肝炎爆發的流行病學調查[J]. 中國疫苗和免疫, 2013, 19(5):435-438.
[2]BOSE M, BOSE S, SAIKIA A, et al. Molecular epidemiology of hepatitis A virus infection in Northeast India[J]. J Med Virol, 2015,87(7): 1218-1224.
[3]BARZAGA B N. Hepatitis A shifting epidemiology in South-East Asia and China[J]. Vaccine, 2000, 18(Suppl 1): S61-S64.
[4]FRANCO E, MELELEO C, SERINO L, et al. Hepatitis A:epidemiology and prevention in developing countries[J]. World J Hepatol, 2012, 4(3): 68-73.
[5]LIMA L R, DE ALMEIDAl A J, TOURINHO RDOS S, et al.Evidence of hepatitis A virus person-to-person transmission in household outbreaks[J]. PLoS One, 2014, 9(7): e102925.
[6]NEFFATTI H, LEBRAUD P, HOTTELET C, et al. Southern Tunisia: A still high endemicity area for hepatitis A[J]. PLoS One,2017, 12(4): e0175887.
[7]SEVERI E, VENNEMA H, TAKKINEN J, et al. Hepatitis A outbreaks[J]. Lancet Infect Dis, 2015, 15(6): 632-634.
[8]CHI H, HAAGSMA E B, RIEZEBOS-BRILMAN A, et al. Hepatitis A related acute liver failure by consumption of contaminated food[J]. J Clin Virol, 2014, 61(3): 456-458.
[9]SHIN E, KIM J S, OH K H, et al. A waterborne outbreak involving hepatitis A virus genotype IA at a residential facility in the Republic of Korea in 2015[J]. J Clin Virol, 2017, 94: 63-66.
[10]MESSENS W, FERNANDEZ-ESCAMEZ P S, LEES D, et al.Thermal processing of live bivalve molluscs for controlling viruses:on the need for a risk-based design[J]. Crit Rev Food Sci Nutr, 2017, 19: 1-12.
[11]FOSTER M A, WEIL L M, JIN S, et al. Transmission of hepatitis A virus through combined liver-small intestine-pancreas transplantation[J]. Emerg Infect Dis, 2017, 23(4): 590-596.
[12]PARK H, LEE Y J, SEONG M W, et al. Comparison of 3 automated immunoassays for detection of anti-hepatitis A virus immunoglobulin M in a tertiary care hospital[J]. Ann Lab Med,2013, 33(2): 121-124.
[13]馬紅霞, 楊藺. MODULAR ANALYTICS E170全自動免疫分析儀精密度驗證情況分析[J]. 國際檢驗醫學雜志, 2012, 33(4):476-478.
[14]周文亭, 王鋒, 尹文嬌, 等. 國產甲型肝炎病毒總抗體檢測試劑的評價[J]. 中國疫苗和免疫, 2013, 19(3): 240-245.
[15]黃嫵姣, 薛元霞, 楊佩樺, 等. 電化學發光免疫分析和酶聯免疫吸附試驗檢測甲型肝炎病毒IgM抗體的比較[J]. 現代醫院,2016, 16(3): 383-385.
[16]張海軍. 類風濕因子對酶聯免疫法檢測HBsAg的影響[J]. 內蒙古醫學雜志, 2013, 45(3): 295-297.
[17]MYLONAKIS E, PALIOU M, LALLY M, et al. Laboratory testing for infection with the human immunodeficiency virus:established and novel approaches[J]. Am J Med, 2000, 109(7):568-576.
[18]吳玉紅. ELSIA法檢測HBsAg出現假陽性的原因探討[J]. 中國現代醫生, 2010, 48(19): 81-82.

