胸腺素α1對重癥急性胰腺炎大鼠肺損傷作用的實驗研究*
邱兆磊,王振杰,程峰,鄭傳明,李磊,姜海,杜召輝
(蚌埠醫學院第一附屬醫院 急診外科,安徽 蚌埠 233004)
重癥急性胰腺炎(severe acute pancreatitis,SAP)是急性胰腺炎發展的重癥階段,常伴有重要臟器功能障礙,仍是并發癥多、死亡率高的疾病之一[1]。急性肺損傷是(acute lung injury,ALI)是SAP常見且嚴重并發癥,據統計SAP出現肺損傷等多臟器衰竭的死亡率高達54%。
胸腺素α1(Thymosinα1,Tα1)是一種細胞免疫增強劑[2],具有促進體內細胞因子的分泌以及淋巴細胞的功能,而Tα1對SAP大鼠相關肺損傷的作用國內外鮮見報道。本文通過復制SAP肺損傷大鼠動物模型,探討Tα1在SAP大鼠肺臟損傷中的作用,觀察肺組織病理以及腫瘤壞死因子α(tumor necrosis factor α,TNF-α)的變化,為探索SAP肺損傷相關機制和保護性治療提供新策略。
1 材料與方法
1.1 實驗動物與分組
清潔級成年雄性Sprague-Dawley(SD)大鼠24只,體重180~210 g,隨機平均分為3組:對照組(A組)、SAP組(B組)和Tα1 干預組(C組),每組各8只。
1.2 SAP模型復制和處理
所有大鼠術前禁食12 h,自由飲水。吸入性麻醉藥異氟烷(上海雅培制藥有限公司)對大鼠進行麻醉,無菌條件下行腹正中切口入腹。A組大鼠入腹后僅翻動十二指腸及胰腺后即刻關腹;B組大鼠采用5%牛磺膽酸鈉(0.1 ml/100 g,美國Sigma公司)經膽胰管逆行勻速緩慢注入(0.1 ml/min)復制SAP動物模型;C組大鼠在復制模型前0.5 h經腹皮下注射Tα1(6 mg/kg)(上海實業聯合集團長城藥業有限公司)。
1.3 觀察指標與檢測方法
分別于復制模型成功后12 h處死各組大鼠,經腹主動脈采血備用,取肺組織和胰腺組織用于光鏡病理學檢查。另一部分肺組織經液氮置入-80℃冰箱冷凍保存,用于檢測肺組織細胞間黏附分子(intercellular adhesion molecule,ICAM-I)及TNF-α的蛋白表達。
1.3.1 各組大鼠血清淀粉酶檢測 采用全自動生化分析儀檢測各組大鼠血清淀粉酶水平。
1.3.2 胰腺組織和肺組織病理學檢查 ①病理學檢查:胰腺、肺組織標本以10%甲醛溶液常規固定、石蠟包埋、蘇木素-伊紅染色。②Western blot法檢測肺組織ICAM-I蛋白和TNF-α蛋白表達情況。
1.4 統計學方法
數據分析采用SPSS 16.0統計軟件,計量資料以均數±標準差(±s)表示,比較采用方差分析和q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 血清淀粉酶及肺濕干比比較
3組血清淀粉酶及肺濕干比(W/D)比較,差異有統計學意義(P<0.05),C組與B組比較,C組降低(q=12.133,P=0.000),B組與A組比較,B組升高(q=35.688,P=0.000)。見表1。
2.2 胰腺、肺臟組織病理改變
B、C組胰腺組織可見腺泡水腫、炎癥細胞浸潤,有的間質壞死,損傷較A組重;而C組胰腺組織損傷較B組減輕;A組胰腺組織未見明顯病理改變。見圖1~3。
B、C組肺組織間質炎癥細胞的浸潤、水腫,損傷較A組加重;C組肺組織損傷較B組減輕;A組肺組織未見明顯病理改變。見圖4~6。
表1 3組大鼠血清淀粉酶及肺W/D比較 (n=8,±s)
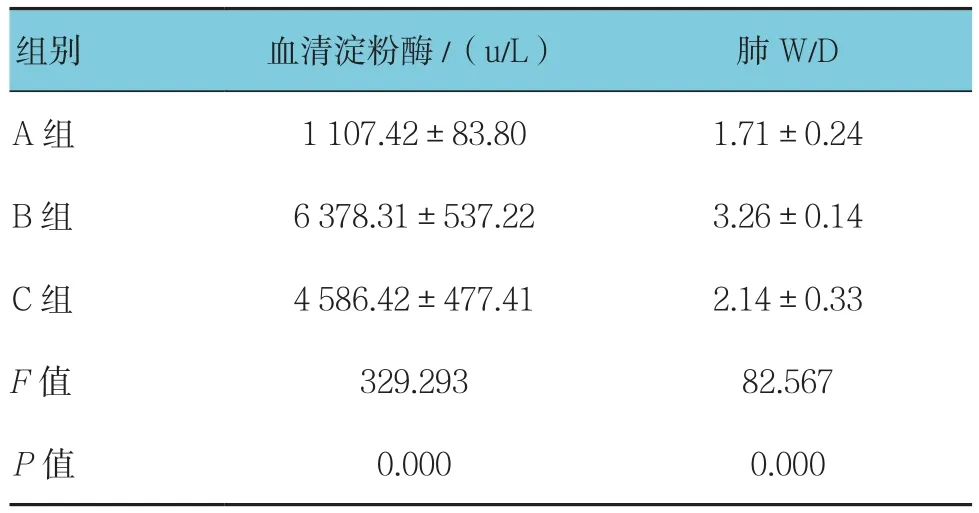
表1 3組大鼠血清淀粉酶及肺W/D比較 (n=8,±s)
組別 血清淀粉酶/(u/L) 肺W/D A組 1 107.42±83.80 1.71±0.24 B 組 6 378.31±537.22 3.26±0.14 C 組 4 586.42±477.41 2.14±0.33 F值 329.293 82.567 P值 0.000 0.000
2.3 各組肺組織ICAM-1和TNF-α蛋白表達比較
3組肺組織ICAM-1和TNF-α蛋白表達比較,差異有統計學意義(P<0.05),B、C組較A組升高(q=10.850和3.574,均P=0.000),C組較B組降低(q=7.276,P=0.000)。見表2和圖7。
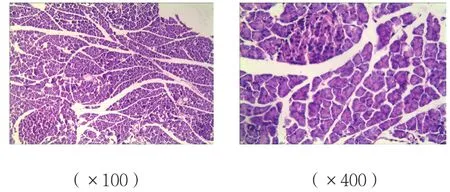
圖1 A組胰腺組織病理改變 (HE染色)
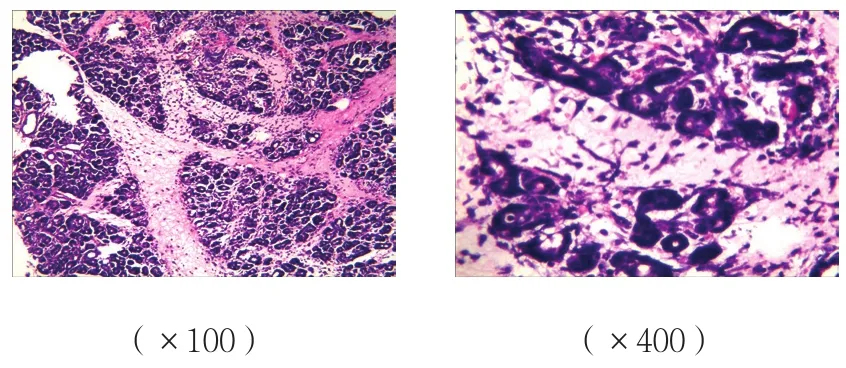
圖2 B組胰腺組織病理改變 (HE染色)
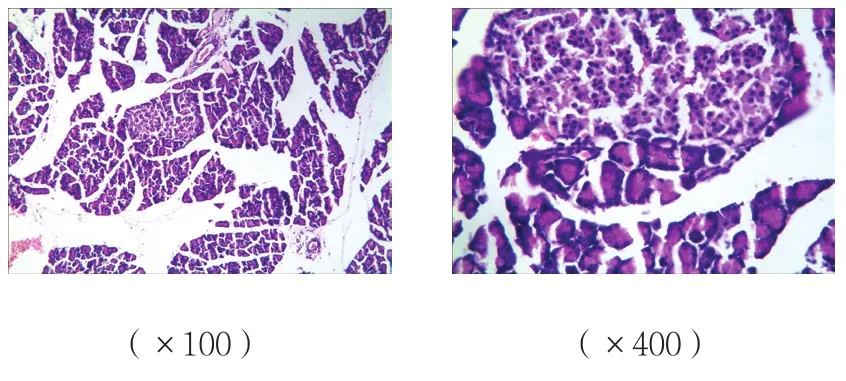
圖3 C組胰腺組織病理改變 (HE染色)
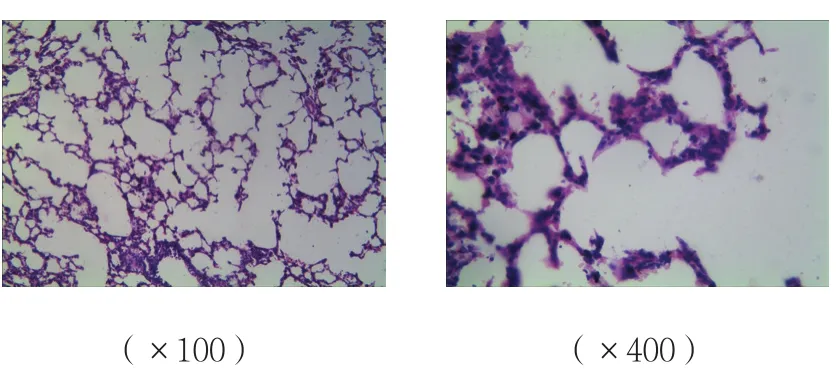
圖4 A組肺組織病理改變 (HE染色)
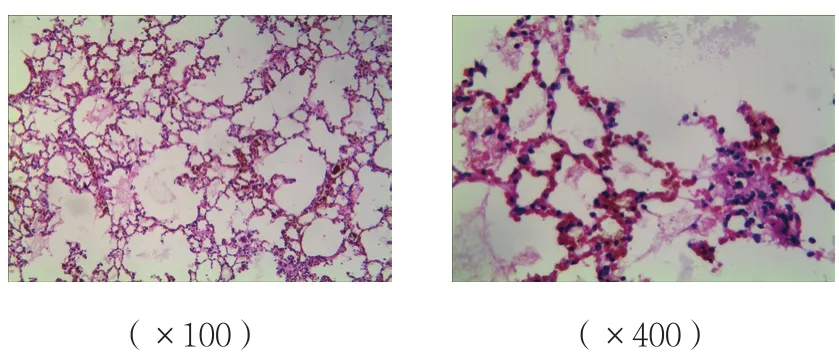
圖5 B組肺組織病理改變 (HE染色)
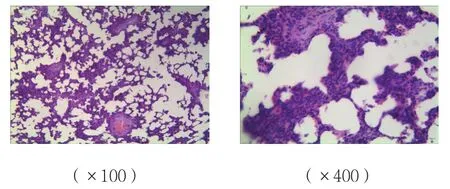
圖6 C組肺組織病理圖 (HE染色)
表2 3組肺組織ICAM-1和TNF-α蛋白表達比較(n=8,±s)
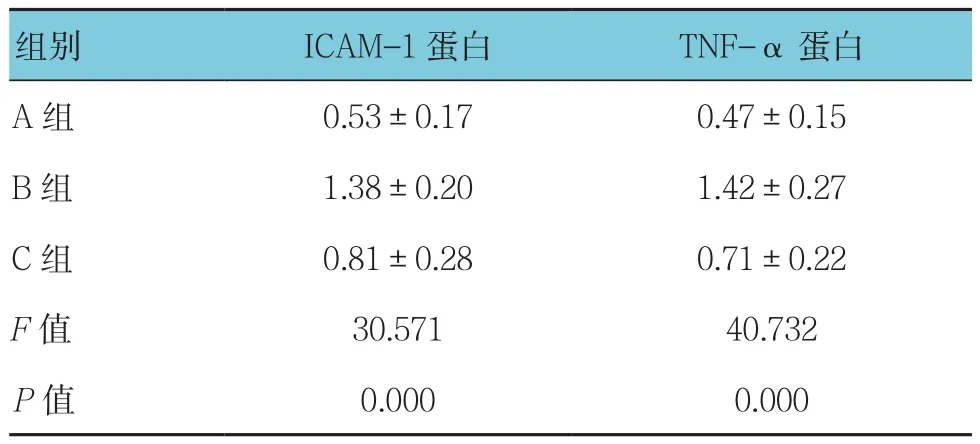
表2 3組肺組織ICAM-1和TNF-α蛋白表達比較(n=8,±s)
組別 ICAM-1蛋白 TNF-α蛋白A組 0.53±0.17 0.47±0.15 B 組 1.38±0.20 1.42±0.27 C 組 0.81±0.28 0.71±0.22 F值 30.571 40.732 P值 0.000 0.000
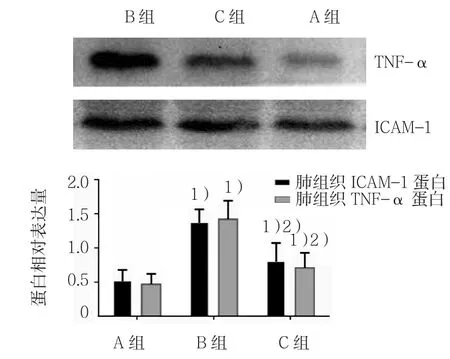
圖7 3組肺組織ICAM-1和TNF-α蛋白表達
3 討論
SAP發病機制錯綜復雜,病情危重,迄今缺乏特異性治療方法。SAP時會促使炎癥細胞釋放大量細胞因子,導致的全身炎癥反應綜合征(systemic inflammatory response syndrome,SIRS)及多臟器衰竭(multiple organ failure,MOF)是SAP死亡的重要因素[3]。目前研究認為[4],TNF-α、IL-6等是SAP引起全身炎癥反應綜合征的強效介質,其中TNF-α是最早產生并起關鍵作用的炎癥介質,并且TNF-α可直接促使組織細胞壞死及蛋白酶激活[5],作用于血管內皮細胞,導致組織出血及壞死。TNF-α可作為啟動因子可引起瀑布樣連鎖及級聯效應[6],促使機體釋放氧自由基、前列環素、IL-6、緩激肽等,形成復雜和高度偶聯的網絡體系,這種失控性的炎癥級聯反應在SAP組織持續性損傷中起關鍵作用,可導致組織結構與功能的改變、細胞壞死,產生ARDS、SIRS、MODS及DIC等。在炎癥反應過程中,ICAM-1的表達受TNF-α調節,ICAM-1可和粒細胞的整合素相作用,介導白細胞的游出和緊密連接,導致組織器官損傷[7]。
本實驗中B組大鼠復制模型成功12 h后血清淀粉酶、肺組織ICAM-1及TNF-α蛋白水平較A、C組升高,肺組織可見炎癥細胞浸潤、組織水腫,損傷較重。肺是SAP發生時最先累及的胰腺外臟器,肺損傷時大量的炎癥介質遷移到肺組織,釋放大量的炎癥介質,對肺泡上皮及肺毛細血管上皮嚴重造成損害,引起肺不張及肺水腫等,最終導致多器官衰竭,病死率高達40%~50%[8-9]。SAP發生時,肺組織脂質過氧化物迅速增高,NF-kB激活,TNF-α、IL-6等炎癥介質及ICAM-1等基因表達上調,炎癥介質大量釋放,中性粒細胞的活化、浸潤,產生過多的活性氧,導致肺組織炎癥介質浸潤,可導致肺組織及毛細血管的損害,從而加重肺損傷[10]。本實驗中B組大鼠肺組織損傷較A、C組重,肺組織ICAM-1及TNF-α蛋白水平較A、C組升高。
Tα1是胸腺肽組分中活性最強的成分,在細胞免疫等方面具有重要調節作用[11]。Tα1在機體炎癥調節、細胞凋亡等病理生理過程中可通過作用于胸腺細胞,刺激T淋巴細胞的分化成熟,激活NK細胞、CD3+、CD4+、CD8+T淋巴細胞,促進前NK細胞的補充、成熟,增強NK細胞的殺傷能力,增強機體的免疫功能[12],并可抑制有害炎癥介質的產生。因此,Tα1具有增強機體的細胞免疫及體液免疫功能。Tα1調節作用是雙向性,其可以上調有益的細胞因子如干擾素、IL-2等,對有害的炎癥因子如TFN-α等可以下調。研究表明[13],Tα1在聯合動脈導管化療藥物灌注栓塞治療原發性肝癌安全性高,療效顯著;在治療惡性腫瘤過程中可提高CD4+/CD8+比值及NK細胞數量、功能,對于T淋巴細胞功能和骨髓造血功能均具有一定的保護作用[14];在治療丙型肝炎肝硬化患者方面已取得滿意的效果[15],而Tα1對SAP肺損傷的療效如何目前鮮見報道。本實驗通過用Tα1對SAP大鼠肺損傷進行干預,結果表明,B組大鼠肺組織TNF-α、ICAM-1及淀粉酶水平至復制模型成功后12 h升高,胰腺及肺組織可見炎癥細胞浸潤,組織水腫、出血。使用Tα1干預后,C組大鼠血清淀粉酶和肺組織TNF-α、ICAM-1蛋白水平較B組降低,胰腺及肺組織損害情況較B組減輕,但仍高于A組,本結果表明Tα1能夠降低SAP肺損傷大鼠炎癥介質及細胞因子水平,能夠減輕SAP的肺組織壞死及炎癥細胞浸潤,具有一定的保護作用。本實驗通過血清學檢查、蛋白水平分析Tα1對SAP大鼠肺損傷的保護作用,ICAM-1及TNF-α等炎癥介質的下調,肺組織損傷減輕。由于SAP并發肺損傷是多炎癥因子參與的動態過程[16],早期安全有效地抑制這些炎癥介質活性將有利于控制肺損傷的進一步惡化,為臨床治療SAP患者提供了新的策略,其保護機制仍有待進一步探討。
[1]FROSSARD J L,STEER M,PASTOR C M.Acute pancreatitis[J].Landcet,2008,371(9607): 143-152.
[2]GARACI E.Thymosin alpha-l: a historical overview[J].Ann NY Acad Sci,2007,1112(1): 14-20.
[3]WANG Y Z,WANG S W,ZHANG Y C,et al.Protective effect of exogenous IGF-I on the intestinal mucosal barrier in rats with severe acute pancreatitis[J].World J Emerg Med,2012,3(3): 213-220.
[4]MOTHOFER K,CASTILLO CFD,FRICH T W,et al.Increased intrapancreatic trypsinogenactive ischemia induced experimental pancreatitis[J].Annual of Surgery,1995,221(4): 364-371.
[5]SENDLER M,DUMMER A,WEISS F U,et al.Tumour necrosis factor alpha secretion induces protease activation and acinar cell necrosis in acute experimental pancreatitis in mice[J].Gut,2013,62(3): 430-439.
[6]余佳,金浩,陳辰,等.聚ADP核糖聚合酶抑制劑對重癥急性胰腺炎大鼠肺炎癥介質表達和肺損傷的影響[J].中華急診醫學雜志,2012,21(1): 38-42.
[7]HSU W Y,CHAO Y W,TSAI Y L,et al.Resistin induces monocyte-endothelial cell adhesion by increasing ICAM-1 and VCAM-1 expression in endothelial cells via p38MAPK-dependent pathway[J].J Cell Physiol,2011,226(8): 2181-2188.
[8]劉松橋,邱海波.急性呼吸窘迫綜合征診治進展[J].中華急診醫學雜志,2014,23(3): 248-251.
[9]MIKKELSEN M E,SHAH C V,MEYER N J,et al.The epidemiology of acute respiratory distress syndrome in patients presenting to the emergency department with severesepsis[J].Shock,2013,40(5): 375-381.
[10]武雅琴,蔣峰,黃建峰.辛伐他汀通過PI3K/Akt通路緩解肺泡Ⅱ型細胞缺氧復氧損傷[J].中華實驗外科雜志,2011,28(11):1941-1943.
[11]呂永豐,陳清霞,李國成,等.烏司他丁對氟尿嘧啶植入劑治療肝癌手術后惡性胸腹水患者免疫功能的影響觀察[J].成都醫學院學報,2011,6(3): 254-256.
[12]MOODY T W.Thymosin alphal as a chemopreventive agent in lung and breast cancer[J].Ann N Y Acad Sci,2007,112(1): 297-304.
[13]黃祥忠,高峰,任冬青,等.胸腺素αl聯合動脈導管化療藥物灌注栓塞治療原發性肝癌的療效觀察[J].實用臨床醫藥雜志,2012,16(15): 11-13.
[14]NAYLOR P H,QUADRINI K,GARACI E,et al.Immunopharmacology of thymosin alpha l and cytokine synergy[J].Ann NY Acad Sci,2007,1112: 235-244.
[15]章前標,范磊.胸腺素α1治療丙型肝炎肝硬化29例臨床分析[J/CD].中華臨床醫師雜志: 電子版,2013,7(24): 11873-11874.
[16]魏明,劉佳,涂玲,等.重癥急性胰腺炎肺損傷大鼠磷脂酰肌醇-3激酶表達及其抑制劑對腫瘤壞死因子-α表達的影響[J].中華急診醫學雜志,2015,24(1): 51-54.

