新型核素分子探針18F-NT靶向前列腺癌的實驗研究
鄒開力,唐永祥,周明,李建,胡碩
(中南大學湘雅醫院 PE中心,湖南 長沙 410008)
前列腺癌是老年男性常見惡性腫瘤,其發病率和病死率都很高。在美國,老年男性的健康受到前列腺癌的嚴重威脅,其發病率位居男性惡性腫瘤的首位。根據美國最新數據顯示,2016年美國前列腺癌新發病例以及死亡人數分別為180 890人和26 120人,占男性癌癥死亡率的第2位[1]。在歐洲,其死亡率也位居癌癥死亡率的第3位。在中國,隨著老齡化時代的到來、飲食習慣的變化,前列腺癌的發病率和死亡率呈現逐年上升趨勢,增長速度超過歐美。在前列腺癌診治過程中,如何早期發現腫瘤,以及對前列腺癌患者進行準確的分期、分級判斷對于治療方案制定和預后及時評估都有著重要的意義。由于前列腺癌的腫瘤異質性,超聲和MRI等常規的影像檢查方法不能對疾病的分期尤其治療后復發再分期進行有效地評估[2-3]。近年來,隨著分子影像技術不斷發展,針對腫瘤特異性生物靶點和代謝途徑的特點,進行精準診斷和臨床分期,受到研究者和臨床專家的的重視和認可。神經降壓素(Neurotensin,NT)是一種由13個氨基酸組成的神經內分泌肽,有降壓、鎮痛、刺激垂體腺分泌激素、降低體溫、調節情緒、調節胃腸等功能。近年的研究表明[4],NT在多種腫瘤組織和細胞中有高表達,NT及其主要受體NTR1介導的信號途徑對于腫瘤的發生和發展進程有明顯的促進作用。NT有3種受體,神經降壓素受體1(NTR1)、神經降壓素受體2(NTR2)和神經降壓素受體3(NTR3),其中NTR1被證明在前列腺癌高表達,而在相應正常前列腺組織中則很少表達[5-6],此外,NT通過NTR1發揮其促腫瘤增殖作用,且3種受體中NTR1與配體NT的親和力最強。本研究制備一種靶向NTR1的新型PET分子顯像劑18FNT,用前列腺癌細胞特異性結合實驗和荷瘤裸鼠生物分布實驗,來驗證其對NTR1的靶向性,為今后的前列腺癌個體化靶向在體顯像及治療提供實驗依據。
1 材料與方法
1.1 細胞株和實驗動物
人前列腺癌細胞系PC3細胞購于中國科學院上海細胞庫,裸鼠購自湖南斯萊克景達公司。
1.2 設備與試劑
1.2.1 設備 Qilin回旋加速器(美國通用電氣公司),Fastlab FN型正電子藥物合成模塊(美國通用電氣公司),1260型高效液相色譜儀、Biocan Flow Count放射性檢測器、紫外檢測器(美國Agilent公司),Bioscan system 2000型薄層色譜掃描儀(美國Bioscan公司),HH6603型γ放射免疫分析儀(北京核海高技術有限公司),EX125DZH型電子天平(常州奧豪斯儀器有限公司)。
1.2.2 試劑和材料 NT(前體)(美國北卡羅來納大學惠贈),乙腈(美國TEDIA公司),QMA(Sep Pak Light)、C18(Sep Pak Plus)( 美 國 Waters公 司 ),色譜柱[德國MN公司VP NUCLEOSIL 100-7-C18(5μm,16×250mm)],Millex GS 0.22μm 除菌過濾器(美國Millipore公司),RPMI 1640培養基(美國Gibco公司),磷酸鹽緩沖液(PBS)(武漢博士德生物技術有限公司),其余試劑均為國產。
1.3 實驗方法
1.3.118F-NT的制備 取300μg前體NT用1ml乙腈溶解,加入500μl pH=4的醋酸緩沖液和30μl 2mmol氯化鋁AlCl3后轉移到模塊反應管中。18F-(700mCi)經0.3ml 0.9%氯化鈉NaCl溶液淋洗到反應管后80℃反應10 min,隨后體系經HPLC純化(30%乙腈)并收集產品峰至中轉瓶,最后再經固相萃取得最終無色澄清產品注射液(60mCi)。
1.3.218F-NT的質控 用pH試紙檢測18F-NT的pH值。取0.5ml稀釋后的產品溶液(0.2mCi)和0.5ml NT前體溶液分別置于不同的進樣瓶中,用HPLC法分析產品純度,以0.1% TFA、30∶70(體積比)的乙腈∶水體系做流動相為30%乙腈溶液。
1.4 細胞實驗
1.4.1 細胞培養 將人前列腺癌細胞PC3置于10%FBS的RPMI 1640完全培養基的培養瓶中,放入37℃、5% CO2的培養箱常規傳代培養。實驗前以1×105個/孔將細胞種入12孔板中,每孔加2 ml RPMI 1640培養液繼續培養。
1.4.2 細胞結合實驗 取培養PC3細胞的12孔板,每孔約含1×106個的對數生長期細胞,做PC3的18F-NT細胞結合實驗。分3組,每組3個復孔,分別為實驗組、阻斷組和對照組(游離18F離子)。具體步驟如下:①培養板中的細胞去上清液,用PBS洗滌3次。②每孔加0.5 ml培養液,阻斷組加入濃度為1 000 μg/ml的NT 0.2 ml,其他兩組加0.2 ml PBS緩沖液,室溫25℃下孵育30 min。③實驗組、阻斷組分別加入放射性活度濃度為0.185 MBq/ml的18F-NT 4 ml,對照組加入同等放射性活度濃度的游離18F 4 ml,每孔放射性活度0.74 MBq,室溫25℃下孵育60 min。④吸取上清液,用PBS緩沖液洗滌3次,以去除細胞外放射性物質。洗滌完畢后,每孔加入1 mol/ml的NaOH 0.5 ml裂解細胞,將每孔物質移入試管。⑤用γ計數儀讀取每管放射性計數值。
1.5 動物實驗
1.5.1 復制動物模型 將處于對數生長期的PC3(細胞消化,制成單細胞懸液,調整細胞濃度接近于1×107個/ml)接種0.2ml于裸鼠頸背部皮下,待腫瘤直徑0.8~1.0cm時用于生物學分布實驗。
1.5.218F-NT生物學分布 實驗6只PC3荷瘤裸鼠,隨機分成兩組(每組3只),實驗組尾靜脈注射0.2ml生理鹽水,阻斷組尾靜脈注射0.2ml的NT,30min后每只裸鼠尾靜脈注射濃度為37MBq/ml的18F-NT 0.2ml。1h后摘除眼球取血,用脫臼法處死小鼠。分離腫瘤、心臟、肝臟、腎臟、脾臟、小腸、肌肉、骨、肺、腦等器官組織,分別稱重,測定放射性計數,計算%ID/g。
1.5.3 HE染色 將分離出的PC3腫瘤組織以及湘雅醫院病理科所取正常前列腺組織,用中性甲醛固定,經脫水、透明、浸蠟、包埋后切片,對切片行常規HE染色。
1.6 統計學方法
數據分析采用SPSS 19.0統計軟件,符合正態分布的計量數據以均數±標準差(±s)表示,采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 18F-NT質量控制及穩定性
HPLC分析結果顯示,18F-NT的出峰時間為14 min,標記率為8.6%,標記后6 h放化純仍高達99%。
2.2 18F-NT細胞結合實驗結果
孵育1 h后,PC3細胞系1h18F-NT計數值:實驗組(5825.00±1074.52)/min,阻斷組(1941.66±173.58)/min,對照組(170.33±56.59)/min。實驗組是阻斷組的3倍,兩組間比較的差異有統計學意義(t=7.227,P=0.003)。實驗組約是對照組的34.34倍,兩者間比較差異有統計學意義(t=9.102,P=0.001)。
2.3 18F-NT在荷瘤小鼠體內的生物分布
兩組在注射18F-NT后1 h的生物學分布顯示(見表1):實驗組、阻斷組的血液攝取值分別為(0.10±0.06)和(0.14±0.11)%ID/g,在兩組中均較低,說明18F-NT在血液中清除快。腎臟攝取較高,實驗組和阻斷組分別為(0.84±0.20)和(0.76±0.46)%ID/g,表明該標志物主要經腎臟排泄。實驗組腫瘤和阻斷組移植瘤放射性攝取差異明顯,分別為(1.02±0.49)和(0.21±0.03)%ID/g,差異有統計學意義(t=2.815,P=0.049)。18F-NT在其他各正常組織器官的分布均低于腫瘤(見圖1和表2)。表2中,腫瘤/腎臟的T/NT值為(1.29±0.83),因為放射性藥物從腎臟排出。腫瘤與其余各正常組織器官的比值T/NT均大于6,其中腫瘤/肌肉的T/NT為(6.97±1.44),說明注射后1 h的放射性本底較低;腫瘤/腦的T/NT最高,為(38.27±19.9),說明腦組織攝取最少。
表1 瘤鼠體內注射18F-NT后1 h體內分布 (n=3,%ID/g,±s)
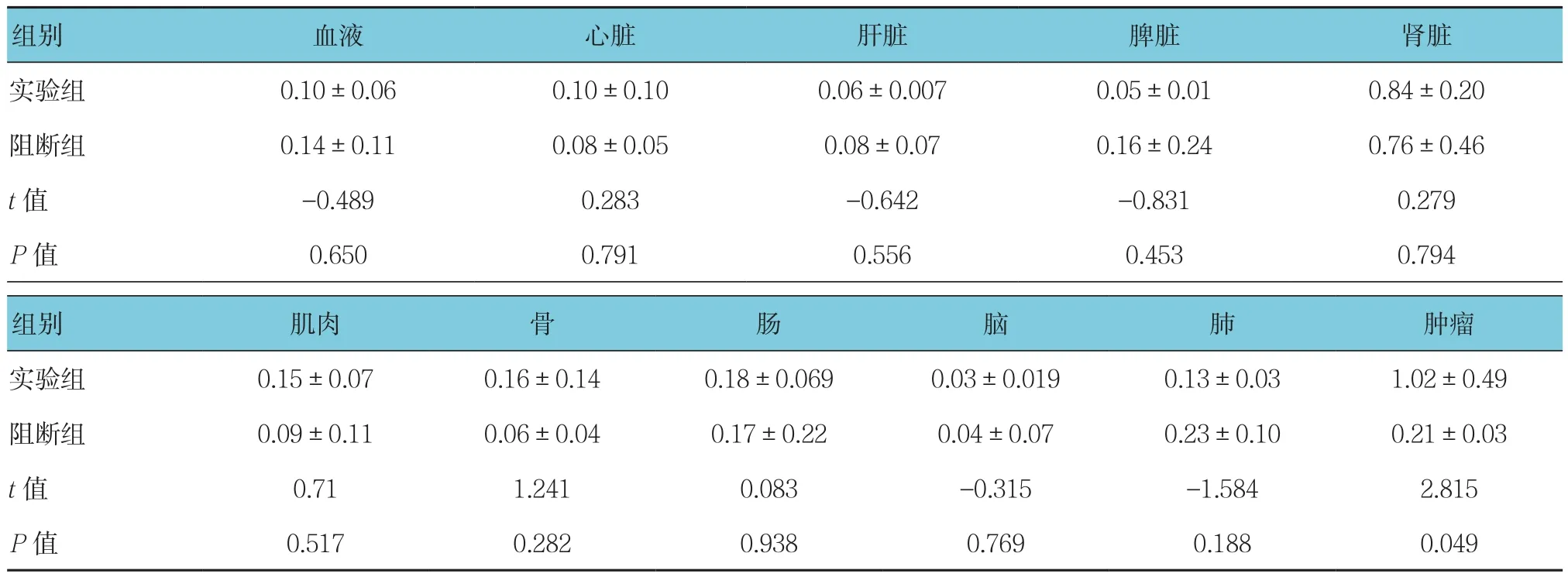
表1 瘤鼠體內注射18F-NT后1 h體內分布 (n=3,%ID/g,±s)
注:%ID/g經時間衰減校正
組別 血液 心臟 肝臟 脾臟 腎臟實驗組 0.10±0.06 0.10±0.10 0.06±0.007 0.05±0.01 0.84±0.20阻斷組 0.14±0.11 0.08±0.05 0.08±0.07 0.16±0.24 0.76±0.46 t值 -0.489 0.283 -0.642 -0.831 0.279 P值 0.650 0.791 0.556 0.453 0.794組別 肌肉 骨 腸 腦 肺 腫瘤實驗組 0.15±0.07 0.16±0.14 0.18±0.069 0.03±0.019 0.13±0.03 1.02±0.49阻斷組 0.09±0.11 0.06±0.04 0.17±0.22 0.04±0.07 0.23±0.10 0.21±0.03 t值 0.71 1.241 0.083 -0.315 -1.584 2.815 P值 0.517 0.282 0.938 0.769 0.188 0.049
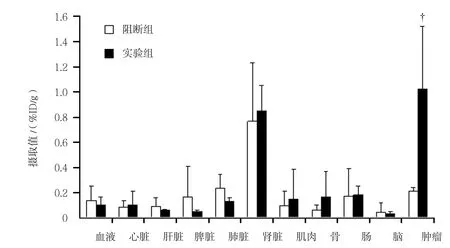
圖1 荷瘤鼠體內注射18F-NT后1 h體內分布經時間衰減校正
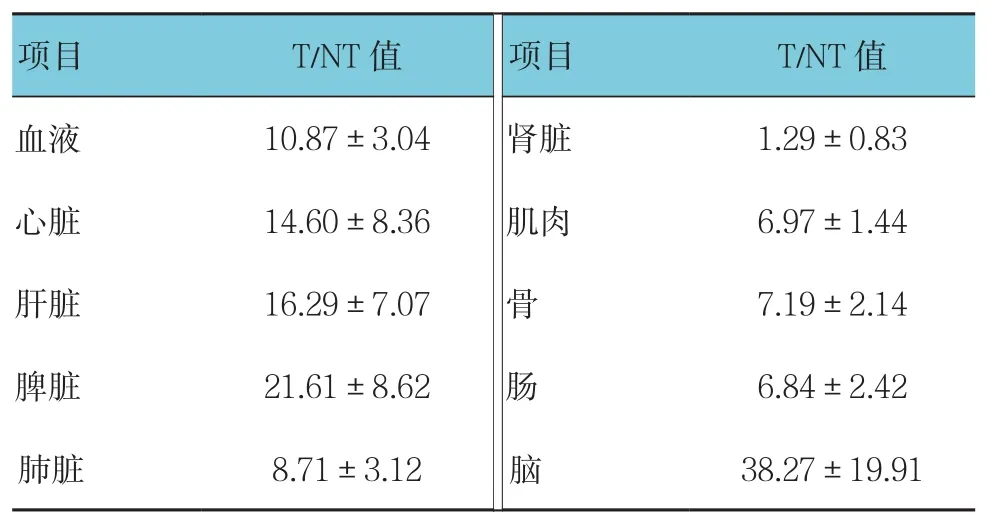
表2 腫瘤與各正常器官組織對18F-NT攝取的比值
注:T/NT為實驗組中腫瘤與各組織攝取18F-NT的比值
2.4 腫瘤HE染色
常規HE染色,正常人前列腺組織見圖2,PC3荷瘤鼠腫瘤組織見圖3。
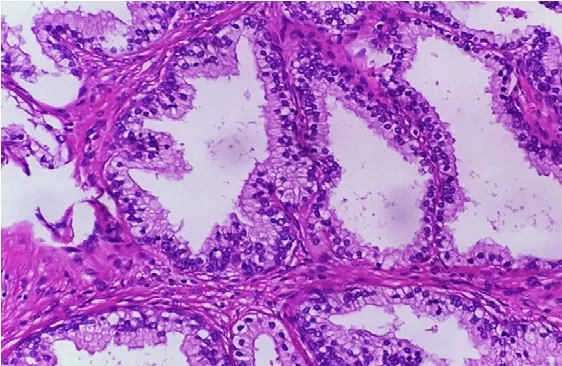
圖2 正常人前列腺病理檢查結果 (HE×200)
圖3 裸鼠PC3腫瘤病理檢查結果 (HE×200)
3 討論
前列腺癌的診斷、分期,尤其是治療后生化復發的影像學證據,決定患者的治療方案,目前還沒有十分滿意的特異性診斷手段。研究表明[7],NTR1在正常的前列腺細胞中不表達,而在前列腺癌中表達。SEHGAL等[8]研究表明,在缺乏雄激素的晚期前列腺癌中,NT/NTR能促進腫瘤的生長。在TAYLOR等[9]的細胞實驗中,隨著前列腺癌細胞致瘤潛力的增加,NTR1的表達也隨之增加。有學者[10]證實,在前列腺癌細胞系PC3有NTR1的過表達,SUTHERLAND等[11]研究也表明,NTR1在前列腺癌細胞系PC3有過度表達。因此NTR1有可能成為新型顯像靶點。本研究臨床常用的核素18F標記與NRT1特異性結合的NT,制作完成正電子顯像劑,通過細胞結合實驗,結果顯示,PC3細胞實驗組對18F-NT的攝取計數值為5 825/min,阻斷組的攝取計數值為1 941/min,對照組的攝取計數值為170/min,說明前列腺癌PC3細胞對18F-NT有極強的攝取能力,且該攝取能力可被未標記的NT有效阻斷,說明NT與NTR1之間的結合是特異性的。
兩組荷瘤鼠在注射18F-NT后1 h,血液攝取值較低[實驗組(0.10±0.06)%ID/g,阻斷組(0.14±0.11)%ID/g],說明18F-NT在血液中清除較快,血本底很低。心臟、肝臟、脾臟、肺、腸、腦等臟器的攝取值與血本底接近。腎臟藥物積聚較多[實驗組(0.84±0.20)%ID/g,阻斷組(0.76±0.46)%ID/g],說明18F-NT主要通過腎臟排泄。兩組移植瘤中,阻斷組攝取值[(0.21±0.03)%ID/g]大大低于實驗組[(1.05±0.46)%ID/g],表明NT能有效阻斷組18F-NT的攝取,進一步說明18F-NT與NTR1之間的結合特異性。綜上所述,18F-NT對于前列腺癌將是一個理想的特異性靶向顯像劑,尤其可以作為雄激素非依賴型前列腺癌原發灶、轉移灶的顯像診斷的一種新型分子探針。
本研究中,18F-NT制配步驟簡單,放化純度高,體外穩定性好。綜合細胞結合實驗和荷瘤鼠生物分布實驗分析,筆者認為,18F-NT對NTR1有較好的特異性,在移植瘤中的攝取較高,其T/TN值較高,1 h后腫瘤攝取值甚至比腎臟還高,可為后續前列腺癌(包括非雄激素依賴前列腺癌轉移)的動物PET顯像以及臨床PET顯像研究提供實驗依據,為遠期的前列腺癌臨床分期與再分期以及治療方案制定與調整提供幫助。
[1]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1): 7-30.
[2]KIRBY R.Optimising the management of early prostate cancer[J].Practitioner,2014,258(1770): 15-18.
[3]李穎,張彤迪,宋奕寧,等.經直腸超聲與磁共振顯像對前列腺癌診斷價值的對比研究[J].中華超聲影像學雜志,2010,19(6):549-550.
[4]DUPOUY S,MOURRA N,DOAN V K,et al.The potential use of the neurotensin high affinity receptor 1 as a biomarker for cancer progression and as a component of personalized medicine in selective cancers[J].Biochimie,2011,93(9): 1369.
[5]VALERIE N C,CASAREZ E V,DASILVA J O,et al.Inhibition of neurotensin receptor 1 selectively sensitizes prostate cancer to ionizing radiation[J].Cancer research,2011,71(21): 6817.
[6]ELEK J,PINZON W,PARK K H,et al.Relevant genomics of neurotensin receptor in cancer[J].Anticancer Res,2000,20: 53-58.[7]SWIFT S L,BURNS J E,MAITLAND N J.Altered expression of neurotensin receptors is associated with the differentiation state of prostate cancer[J].Cancer Research,2010,70(1): 347-56.
[8]SEHGAL I,POWERS S,HUNTLEY B,et al.Neurotensin is an autocrine trophic factor stimulated by androgen withdrawal in human prostate cancer[J].Proceedings of the National Academy of Sciences,1994,91(11): 4673-4677.
[9]TAYLOR R M,SEVERNS V,BROWN D C,et al.Prostate cancer targeting motifs: expression of ανβ3,neurotensin receptor 1,prostate specif i c membrane antigen,and prostate stem cell antigen in human prostate cancer cell lines and xenografts[J].Prostate,2012,72(5): 523-532.
[10]AMORINO G P,DEEBLE P D,PARSONS S J.Neurotensin stimulates mitogenesis of prostate cancer cells through a novel c-Src/Stat 5b pathway[J].Nature Publishing Group,2007,26: 745-756.
[11] SUTHERLAND M,GORDON A,SHNYDER S D,et al.RGD-binding integrins in prostate cancer: expression patterns and therapeutic prospects against bone metastasis[J].Cancers (Basel),2012,4(4): 1106-1145.

