應用絮凝基因表達量分析技術評價酵母菌株的絮凝性
郭立蕓,謝鑫,梁云
(北京燕京啤酒股份有限公司,燕京啤酒釀造技術北京市重點實驗室,北京,101300)
酵母絮凝是酵母細胞在多種因素影響下形成可逆的、無形聚集并可以再次擴散到發酵介質中的一種能力的體現。對于啤酒工業來說,酵母細胞的絮凝是相當重要的。
STRATFORD[1]根據糖對酵母絮凝抑制的情況,區分酵母的2種絮凝表型,一種稱之為FLO1型,另一種為NewFLO型,這2個表型主要體現在糖抑制特征上,不同的糖類對于2種不同絮凝表型的酵母其抑制作用存在差別,FLO1型受FLO1、FLO5、FLO8等基因調控,NewFLO型受Lg-FLO1基因調控,FLO1型和NewFLO型酵母其絮凝性及其生理性狀存在較大差異(圖1)。
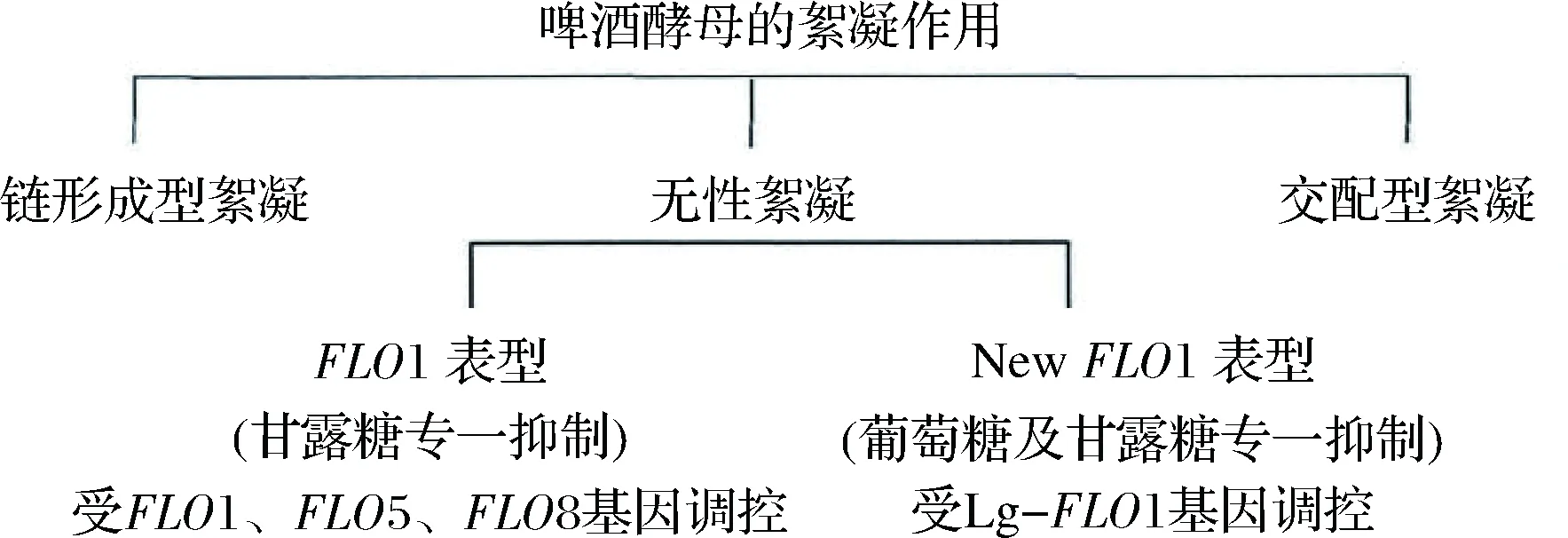
圖1 啤酒酵母的絮凝作用分類Fig.1 The classification of yeast flocculation
釀酒酵母攜有5個FLO家族絮凝基因[2-3]:FLO1、FLO5、FLO9、FLO10和FLO11。其中FLO1、FLO5、FLO9和FLO10功能是實現細胞與細胞間的黏附,而FLO11使細胞與基質產生黏附;另外的Lg-FLO1基因主要負責甘露糖、葡萄糖和麥芽糖敏感的NewFLO類型的啤酒酵母菌株絮凝(表1)。

表1 絮凝基因的基因功能Table 1 The function of flocculation gene
絮凝性是酵母細胞本身一種固有的特性,菌株遺傳背景的特異性起著決定性作用,其他各種因素作用都是通過影響絮凝基因的表達或者絮凝基因編碼蛋白的活性來影響酵母最終的絮凝性能。
熒光定量PCR是近年來發展起來的一項新技術,可用于目標基因的表達、基因突變分析及多態性研究,是一種高效的基因表達量分析技術。該技術是在PCR反應體系中加入熒光基團,利用熒光信號積累實施檢測整個PCR進程。它可以從復雜的樣品中加測中微量的目標核酸,具有高準確性、高特異性[4-5]。張中保等[6]應用實時熒光定量PCR(real-time quantitative, PCR)技術,研究了玉米中10個水分脅迫誘導基因的相對表達量及表達模式,趙鮮仙[7]以釀酒酵母BY4742基因組DNA為模板, 采用PCR技術擴增獲得ADH7啟動子、CYC1終止子以及MSN2編碼框序列, 采用熒光定量PCR技術檢測MSN2基因及其調控代表基因的轉錄變化水平。
目前針對于酵母絮凝性基因方面的研究并不深入,本研究在前期實驗中篩選獲得1株弱絮凝性釀酒酵母,在此基礎上,通過糖抑制實驗確定了弱絮凝性和對照酵母菌株的絮凝表型,采用分子生物學技術測定酵母絮凝基因,從分子層面確定,弱凝聚性釀酒酵母與對照菌株在基因層面的差異性,確定酵母絮凝關鍵基因。
1 材料與方法
1.1 實驗材料
1.1.1 實驗菌株
弱凝聚性酵母菌株YJ085及對照菌株均由公司菌種保藏中心提供。
1.1.2 培養基
13°P麥汁培養基(糖化車間生產)、PDA培養基(北京陸橋)、YPD-Broth培養基(上海生工)。
1.1.3 主要試劑
糖類:甘露糖、麥芽糖、葡萄糖。
pH 3.9 50 mmol/L醋酸鈉-醋酸-0.1% CaCl2的絮凝緩沖液:稱取4.1 g醋酸鈉、3 g醋酸和1 g CaCl2溶解后定容至1 L,用醋酸調節pH為3.9。
PCR反應相關試劑:Taq酶、dNTP、TaqReaction Buffer、Loading Buffer、QuantScript RT Kit、Real Master Mix(SYBR Green)(天根生化);Goldview核酸染料;柱型酵母RNA提取試劑盒(上海生工),RNAstore樣本保存液。
1.1.4 主要儀器
恒溫搖床培養箱(ZWY-C2112B型),上海智城分析儀器制造有限公司;可見光分光光度計(WFJ2100型,Unico);恒溫水浴鍋,美國polyscience;PCR儀(GeneAmp 9700 型),美國Applied Biosystems公司;熒光定量PCR儀(Light cycler2.0型),瑞士羅氏公司;水平電泳儀(DYY-8B型),北京市六一儀器廠;凝膠成像系統(JY04S-3C型),北京君意東方電泳設備有限公司;生化培養箱(INCUBATOR型),日本SANYO公司;超凈工作臺,蘇州凈化設備有限公司。
1.2 酵母絮凝表型的分型
1.2.1 酵母培養
挑取1環實驗菌株,于25 ℃液體的麥汁培養基中活化1次,轉接至三角瓶中,25 ℃,200 r/min搖床培養48 h。
1.2.2 絮凝水平的測定
參照STRATFORD[1]、張博潤[8]、常玉廣等[9]采用的分光光度法:取48 h培養物離心收集菌體,用250 mmol/L溶液及無菌水各洗滌2次,60 ℃處理5 min以殺死細胞(為避免代謝旺盛的酵母細胞消耗糖而降低其濃度,該處理不影響細胞的絮凝),然后測定絮凝水平離心收集菌體并懸于絮凝緩沖液中,立刻在600 nm處測OD值,然后細胞懸液轉移至三角瓶中,25 ℃,120 r/min振蕩2 h至絮凝完成,室溫靜置30 min,取上清在600 nm 處測OD值。以振蕩處理后測定的OD值除以振蕩處理前的OD值,再乘以100%(即自由細胞濃度)表示絮凝水平。
1.2.3 酵母菌的絮凝表型分型
分別將不同濃度的甘露糖、麥芽糖、葡萄糖溶于絮凝緩沖液中,濃度分別為0、0.2、0.4、0.6、0.8、1 mol/L,測定絮凝水平。
根據FLO1型酵母菌株絮凝僅受甘露糖抑制,而NewFLO型酵母菌株受多種糖抑制對酵母菌株進行絮凝表型分型。
1.3 酵母絮凝表型基因型的測定
1.3.1 特異性引物設計
針對酵母絮凝基因FLO1、FLO5、FLO8、FLO9、FLO10、FLO11、Lg-FLO1設計特異性引物,經過查閱相關文獻,確定并設計引物見表2。
1.3.2 菌株培養
從原始瓊脂斜面挑取菌苔1環,使用10 mL 13 °P麥汁培養基活化培養48 h,吸取1 mL轉入10 mL 13 °P麥汁培養基活化培養24 h,挑取1環接種PDA培養基劃線培養3 d。
1.3.3 酵母DNA的提取
酵母的DNA使用TIANGEN酵母基因組DNA提取試劑盒進行提取,并使用0.8%的瓊脂糖凝膠電泳(80 V,30 min)檢測所得DNA的質量。

表2 酵母絮凝基因特異性引物Table 2 Specific primers of yeast flocculation gene
1.3.4 PCR反應體系及反應條件
A:反應體系的優化
反應體系:10×Buffer 5 μL,2.5 mmol/L dNTP 1μL,10 μmol/L上游引物1 μL,10 μmol/L下游引物1 μL,Taq酶0.5 μL,模板3 μL,ddH2O 38.5 μL。
反應條件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30個循環;72 ℃ 5 min。
1.3.5 酵母絮凝基因分型
對酵母的絮凝基因FLO1、FLO5、FLO8、FLO9、FLO10、FLO11、Lg-FLO1進行擴增,產物進行2%瓊脂糖凝膠電泳,若目的基因擴增出現陽性條帶,則代表酵母具有該基因,若無目的基因條帶,則代表酵母不具有該基因。
1.4 酵母絮凝基因表達量分析
1.4.1 特異性引物設計
針對酵母絮凝基因FLO1、FLO5、FLO8、FLO9、FLO10、FLO11、Lg-FLO1設計特異性引物,并以ACT1管家基因作為內參基因,引物序列見表2。
1.4.2 菌株培養
將酵母菌用接種針從原始瓊脂斜面無菌挑取菌苔1環到10 mL YPD-Broth培養基中,25 ℃恒溫培養24 h;用移液管無菌移取1 mL菌液到10 mL YPD-Broth培養基中,25 ℃恒溫培養24 h;將試管中的10 mL菌液全部轉移到裝有90 mL YPD-Broth的250 mL三角瓶中,25 ℃恒溫培養,在固定時間段取發酵液1 mL,先離心收集菌體,用PBS緩沖液洗1次,再用100 μL PBS緩沖液懸浮細胞,加入2倍體積的RNAstore保存于4 ℃,待測。
1.4.3 酵母RNA提取
使用柱式酵母RNA提取試劑盒(上海生工)進行提取,得到的產物使用0.8%的瓊脂糖進行凝膠電泳(120 V,20 min)檢測是否成功提取RNA。
1.4.4 絮凝基因表達量分析
使用相對定量熒光PCR的方法進行分析,使用QuantScript RT Kit進行RNA的逆轉錄,使用Real Master Mix(SYBR Green)進行熒光定量PCR分析。
逆轉錄體系:10×RT Mix 2 μL,Super pure dNTPs 2 μL,Random(10 μmol/L) 2 μL,Quant Reverse Transcriptase 1 μL,模板RNA 50 ng-2 μg,RNase-Free水補充至20 μL。
逆轉錄反應條件:37 ℃孵育60 min。
熒光定量PCR反應體系:2.5×Real Master Mix(添加20×SYBR溶液)9 μL,10μmol/L正向引物 0.5 μL,10 μmol/L反向引物0.5 μL,DNA模板10~100 ng,ddH2O 補充至20 μL。
熒光定量PCR反應條件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s(結束采集熒光信號),68 ℃ 30 s,45個循環。
按照反應體系及條件對各絮凝基因與內參基因進行熒光定量PCR,使用所得Cp值換算比率,根據比率的大小即可得出基因表達量變化的差異,按公式(1)計算:
比率=2-ΔΔCp
(1)
(ΔCp=Cp目的基因-Cp內參基因,ΔΔCp=ΔCp目的時間點-ΔCp對照時間點,用于生長過程中絮凝基因的表達變化分析)
根據得出的比率值,得知酵母絮凝基因的表達量差異,比率越高說明表達量越高,比率越低說明表達量越低。
1.4.5 酵母生長過程中的絮凝基因表達量變化
考察篩選菌株與對照菌株在發酵過程(YPD-Broth)中的基因表達量變化,每6 h取樣1次(搖勻),進行熒光定量PCR分析絮凝基因表達量,同時跟蹤各時間點的酵母數、出芽率、死亡率。
2 結果與討論
2.1 酵母絮凝表型分型實驗結果分析
2.1.1 甘露糖對酵母菌株絮凝性的影響
在0.2、0.4、0.6、0.8、1.0 mol/L不同濃度的甘露糖作用下,對篩選菌株YJ085及對照菌株進行絮凝水平的測定,其絮凝性見圖2。
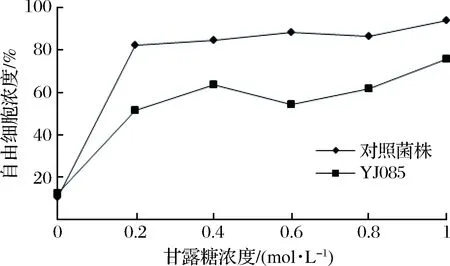
圖2 甘露糖對酵母菌株絮凝性的影響Fig.2 The effect of mannose on the flocculation of yeast strains
由圖2可知,YJ085菌株在0.2 mol/L甘露糖作用下,其絮凝抑制率達到50%左右,隨著糖濃度的增加,其絮凝抑制作用略有增加。對照菌株在0.2 mol/L低濃度甘露糖作用下,其絮凝抑制率約為80%,濃度為0.6 mol/L時,對照菌株基本完全抑制絮凝,甘露糖對弱凝聚性酵母菌株YJ085的絮凝抑制性要低于對照酵母菌株。
2.1.2 麥芽糖對酵母菌株絮凝性的影響
在0.2、0.4、0.6、0.8、1.0 mol/L不同濃度的麥芽糖作用下,對篩選菌株YJ085及對照菌株進行絮凝水平的測定,其絮凝性見圖3。
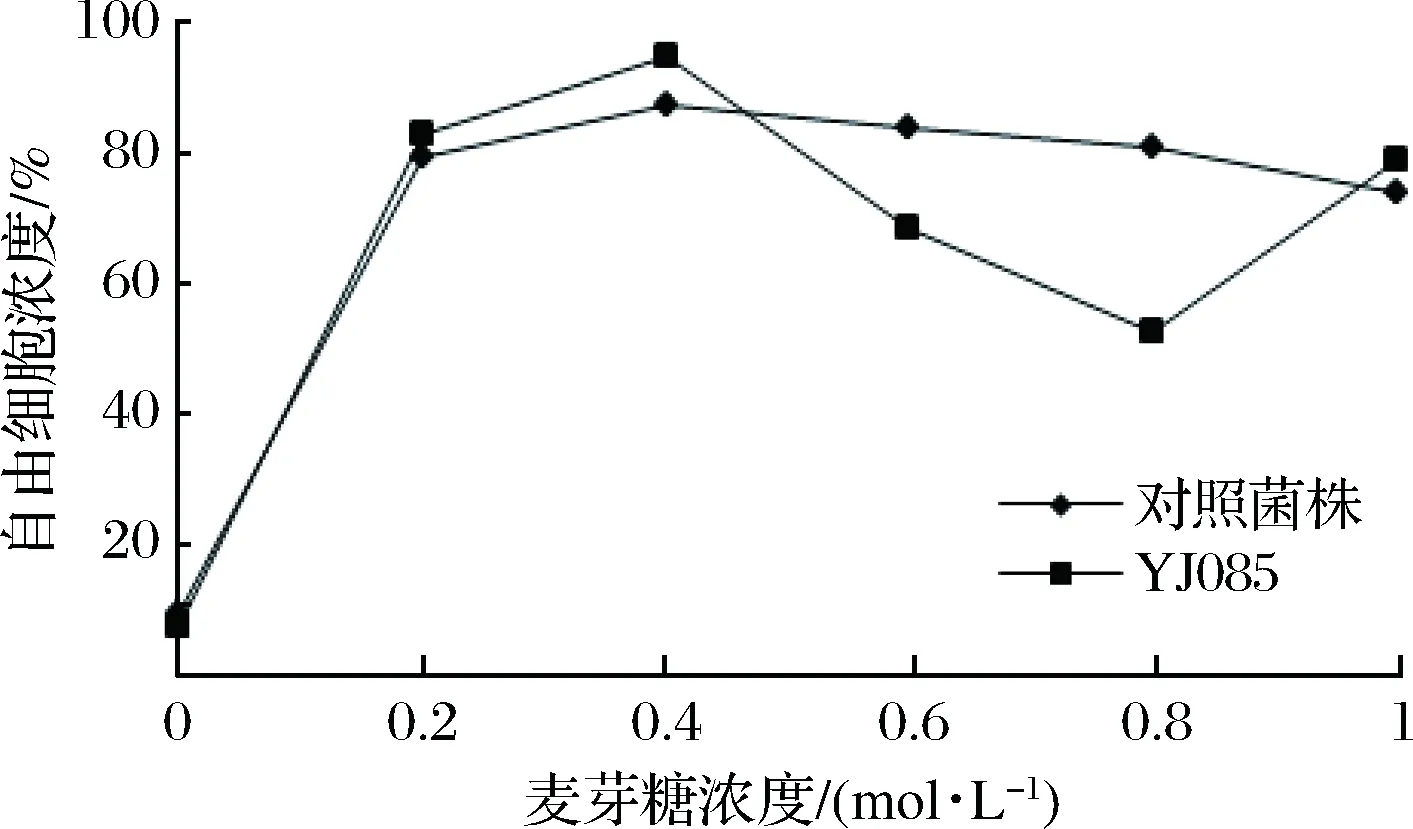
圖3 麥芽糖對酵母菌株絮凝性的影響Fig.3 The effect of maltose on the flocculation of yeast strains
由圖3可知,YJ085與對照菌株在麥芽糖濃度僅為0.2 mol/L時,絮凝抑制率高達到80%左右,隨著糖濃度的增加,絮凝抑制率基本保持在該水平。與對照酵母菌株相比,麥芽糖對弱凝聚性酵母菌株YJ085的絮凝抑制無顯著差異。
2.1.3 葡萄糖對酵母菌株絮凝性的影響
在0.2、0.4、0.6、0.8、1.0 mol/L不同濃度的葡萄糖作用下,對篩選菌株YJ085及對照菌株進行絮凝水平的測定,其絮凝性見圖4。
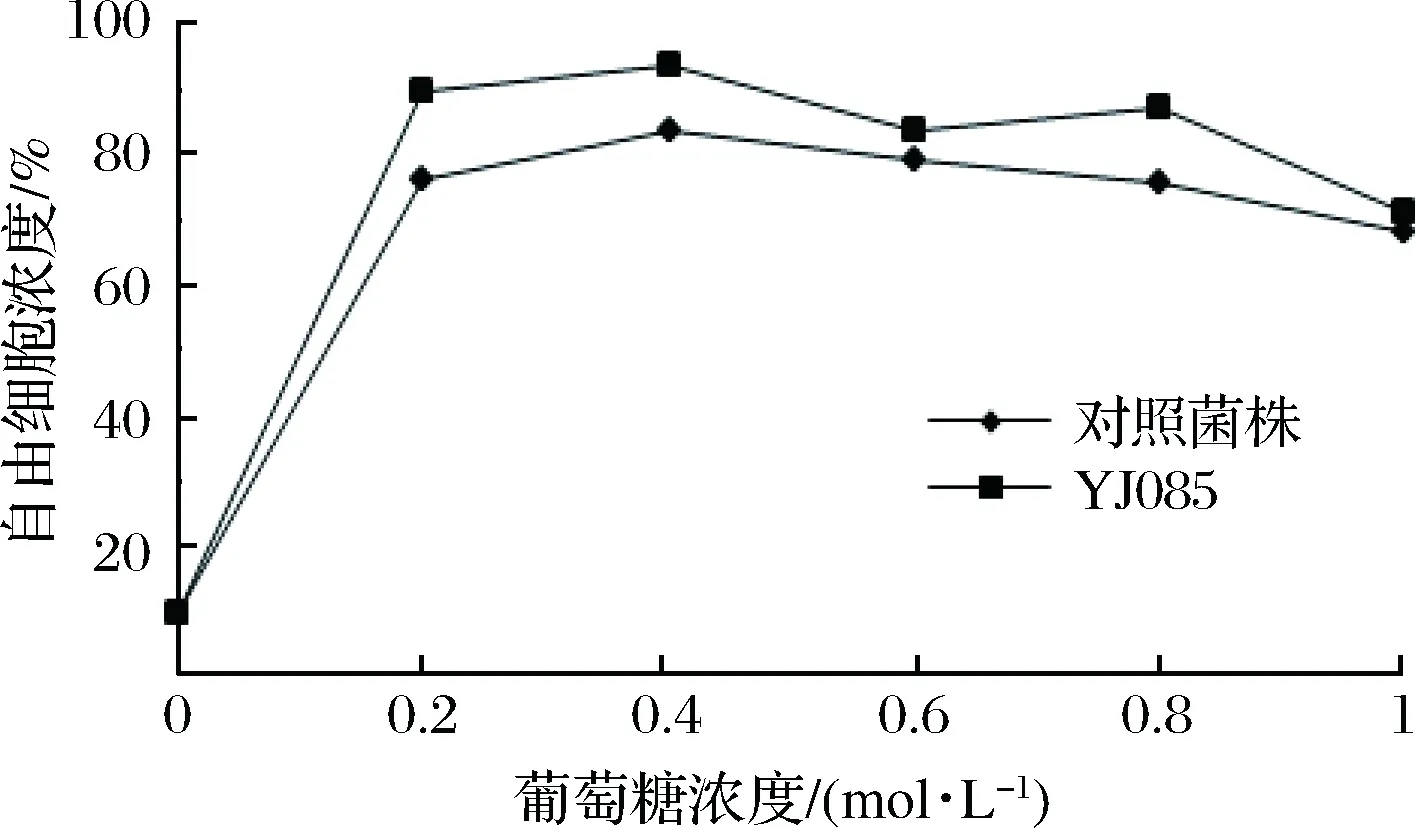
圖4 葡萄糖對酵母菌株絮凝性的影響Fig.4 The effect of glucose on the flocculation of yeast strains
由圖4可知,YJ085與對照菌株在葡萄糖濃度僅為0.2 mol/L時,絮凝抑制率達80%左右,隨著糖濃度的增加,基本維持在該水平。與對照菌株相比,葡萄糖對弱凝聚性酵母菌株YJ085的絮凝抑制要高于對照酵母菌株。
雖然從絮凝表型上可分為2類,但不同糖類對酵母菌株絮凝抑制效果不同,具體分析結果見表3。

表3 酵母菌株的分型Table 3 The flocculation phenotype of yeast strains
按照根據FLO1型酵母菌株絮凝僅受甘露糖抑制,而NewFLO型酵母菌株受多種糖抑制對酵母菌株進行絮凝表型分型。YJ085與對照菌株均為不僅受甘露糖抑制,還受麥芽糖、葡萄糖的抑制,絮凝表型均為NewFLO型。
與對照相比,弱凝聚性酵母YJ085在甘露糖作用下絮凝性抑制低于對照酵母菌株。
2.2 酵母絮凝表型基因型的測定
對篩選獲得的凝聚性釀酒酵母菌株YJ085與對照菌株進行絮凝基因分型,驗證其絮凝表型的同時確定各絮凝基因的基因型見圖5和圖6。
從電泳圖可以看出,篩選弱凝聚性菌株YJ085與對照菌株絮凝基因存在狀況均一致,YJ085和對照酵母菌株中菌存在FLO1、FLO5、FLO8、FLO9、FLO11、Lg-FLO1基因,菌株的FLO10基因均不存在,均為NewFLO型。
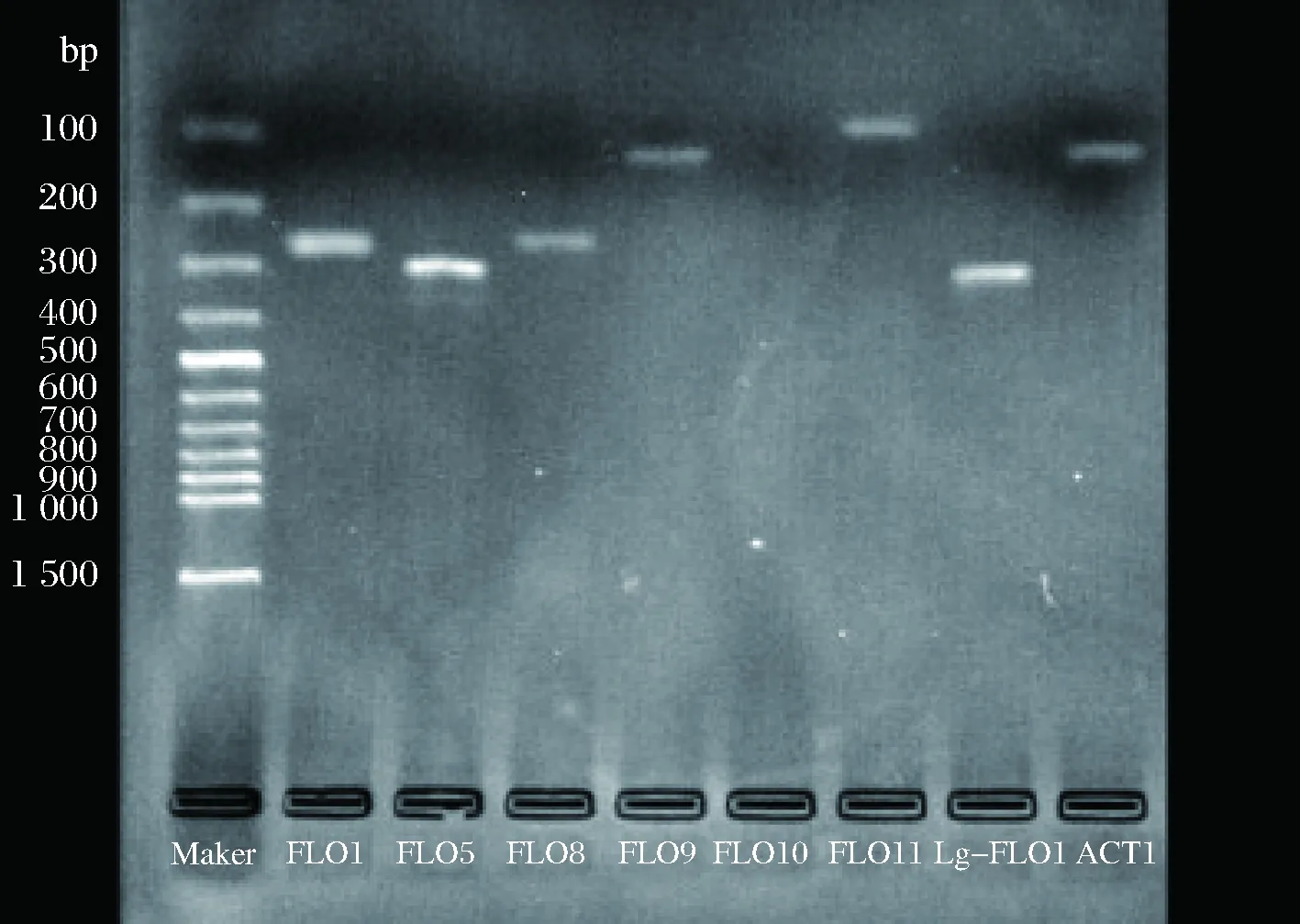
圖5 對照菌株絮凝基因分型Fig.5 The flocculation genotype of the control strain
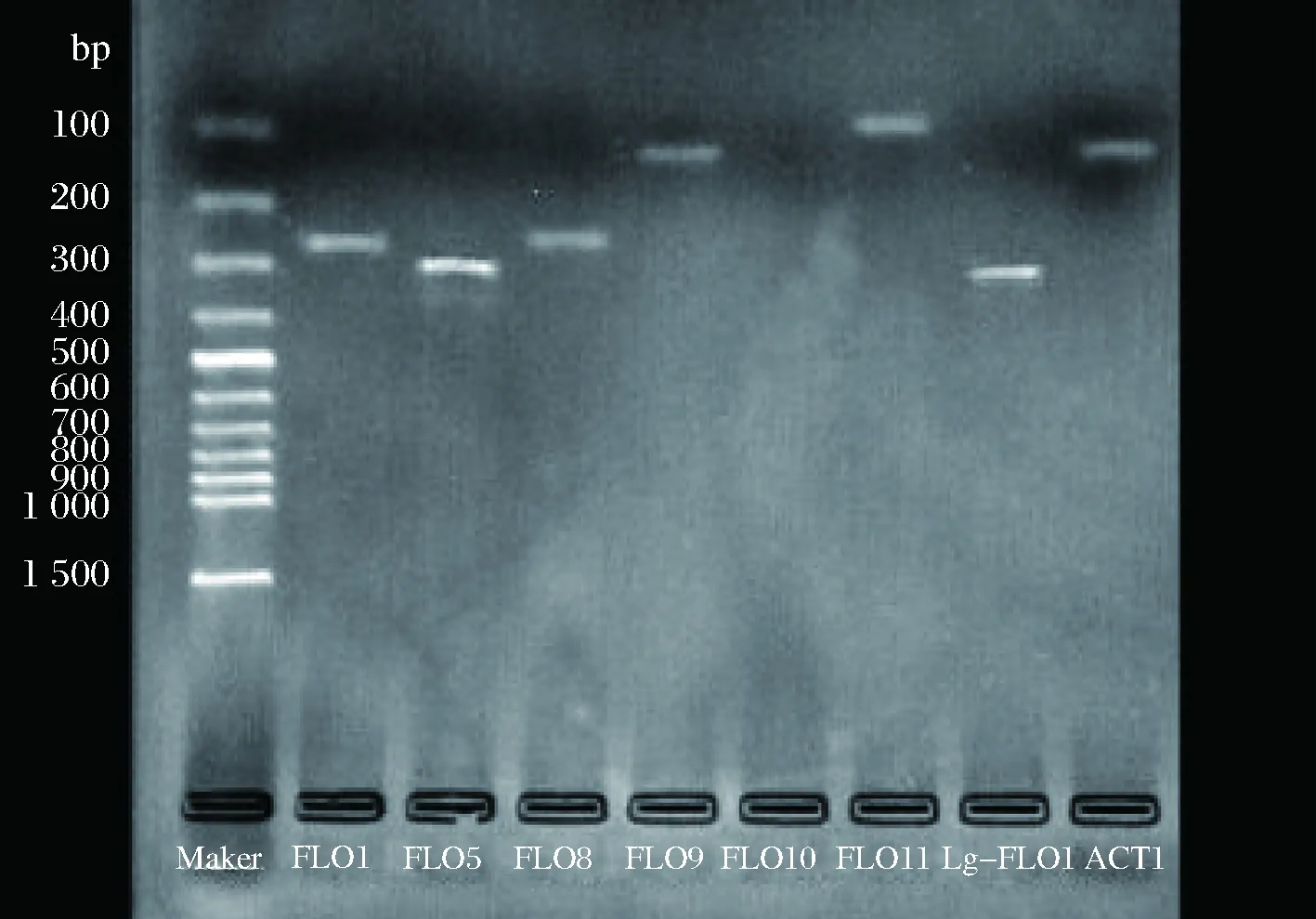
圖6 弱凝聚性酵母菌株YJ085基因分型Fig.6 The flocculation genotype of the YJ085 strain
2.3 酵母絮凝基因表達量分析
2.3.1 篩選菌株在生長過程中絮凝基因表達量的變化
以篩選菌株YJ085為研究對象,考察其在發酵過程(YPD-Broth)中的基因表達量變化,同時測定對照菌株基因表達量進行比較,每6 h,搖勻取樣,進行熒光定量PCR分析絮凝基因表達量,同時跟蹤各時間點的酵母數、出芽率、死亡率。在0~72 h發酵過程中,篩選菌株YJ085及對照菌株均在24 h達到高峰期,隨后呈小幅下降直至基本穩定的趨勢,出芽率均由發酵初期的13%~18%至發酵后期穩定在8%左右,死亡率在發酵過程中均維持在2%左右,生長曲線見圖7。
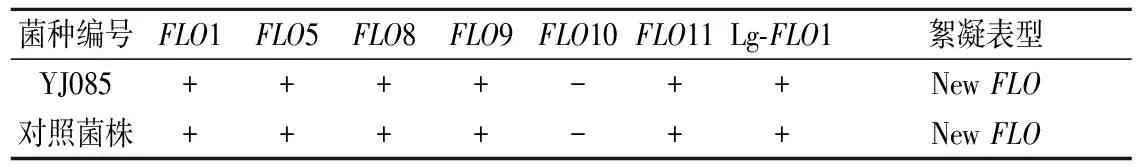
表4 酵母菌株絮凝基因分型Table 4 The flocculation genotype of the yeast strains
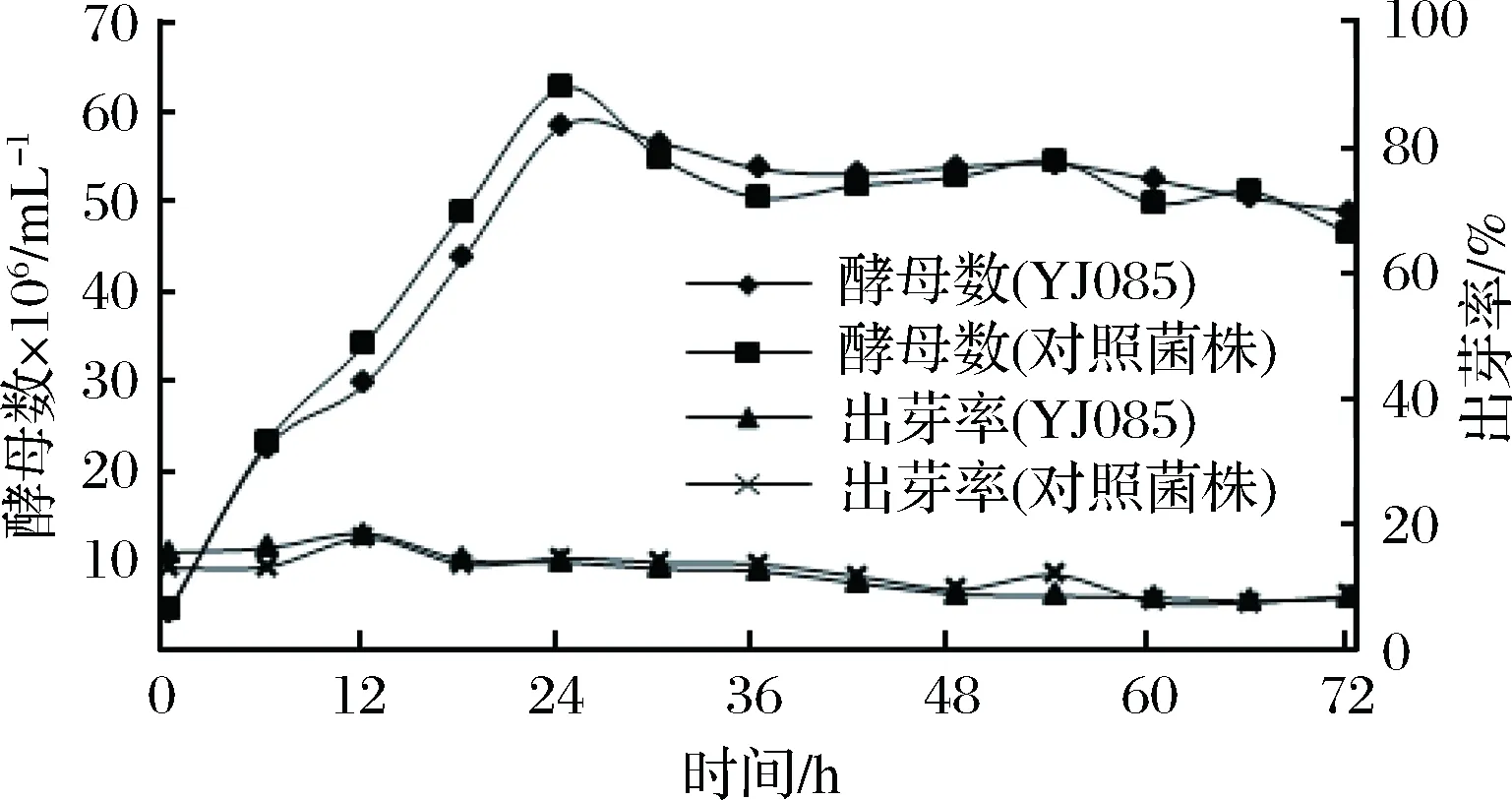
圖7 篩選菌株YJ085的生長曲線Fig.7 The growth curve of YJ085 strain
對不同時間點的發酵液取樣,提取酵母RNA進行熒光定量PCR分析,篩選菌株YJ085與對照菌株在生長過程中絮凝基因的表達量變化見圖8。
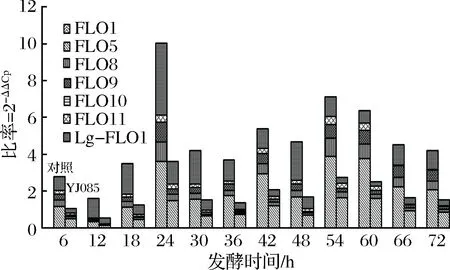
圖8 菌株生長過程中絮凝基因的表達量變化Fig.8 The expression of flocculation gene in the growth of strain
從圖8可以看出,篩選菌株YJ085各絮凝基因表達量顯著低于對照菌株,篩選菌株YJ085的絮凝主要受FLO絮凝基因家族中的FLO5及Lg-FLO1基因調控,FLO1、FLO11表達量在發酵過程始終維持在較低表達量,FLO10基因不表達;在接種初期隨著酵母的大量繁殖,FLO家族絮凝基因(FLO5、FLO8、FLO9、FLO11)表達出現抑制,隨著酵母數在24 h左右達到高峰期,絮凝基因FLO5、FLO8、FLO9及Lg-FLO1表達量達到峰值;隨后酵母數開始下降,絮凝基因的表達量也出現大幅下降;至36 h左右酵母數基本穩定,FLO8、FLO9基因開始維持在較低表達量,并呈現小幅波動趨勢,而FLO5基因的表達量則呈現較大波動,并在42 h及54 h左右出現峰值,FLO11基因發酵后期表達量有小幅上漲趨勢,Lg-FLO1基因表達量在48 h出現小幅升高后便穩定在較低水平。表明無論是篩選菌株或對照菌株,在下面酵母的發酵過程中,絮凝基因的表達量與酵母增殖數量呈負相關。
2.3.2 酵母菌株絮凝基因的表達量差異
熒光定量PCR分析篩選菌株YJ085與對照菌株在發酵過程酵母增值高峰期(24 h)的絮凝基因表達量,分析結果見圖9。
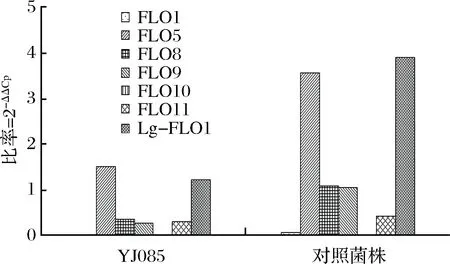
圖9 不同酵母增殖高峰期的絮凝基因表達量Fig.9 The expression of flocculation gene in the proliferation peak of different yeast strains
經絮凝基因表達量分析發現,弱凝聚性釀酒酵母菌株YJ085絮凝基因FLO1、FLO5、FLO8、FLO10、FLO11、Lg-FLO1表達量均小于對照菌株,尤其是FLO5和Lg-FLO1絮凝基因表達量顯著低于對照菌株。與對照菌株相比,YJ085絮凝家族基因整體表達量降低了63.98%,絮凝基因表達量的下降導致其凝聚性變化,從基因層面闡述了弱凝聚性酵母絮凝水平低于對照菌株的分子機制。
3 結論
通過甘露糖、麥芽糖、葡萄糖作用,確定弱凝聚性釀酒酵母絮凝表型為NewFLO型,與對照菌株相比,受甘露糖絮凝抑制更為明顯。
通過PCR技術對篩選弱凝聚性酵母菌株和對照菌株的基因分型,確定YJ085和對照菌株中均存在FLO5、FLO8、FLO9、FLO11、Lg-FLO1基因,菌株的FLO10基因均不存在,均為NewFLO型。
基因表達分析方法——熒光定量PCR方法的測定結果表明,釀酒酵母發酵過程中,絮凝基因的表達量與酵母增殖數量呈負相關。通過對不同時間點的發酵液進行取樣,提取酵母RNA分析得出YJ085與對照菌株在生長過程中絮凝基因的表達量變化主要受FLO絮凝基因家族中的FLO5及Lg-FLO1基因調控,FLO1、FLO11表達量在發酵過程始終維持在較低表達量,FLO10基因不表達,經絮凝基因表達量分析發現,YJ085各絮凝基因表達量均小于對照菌株,絮凝基因表達量的變化導致其凝聚性變化,降低了63.98%,從基因層面闡述了菌株凝聚性弱的原因。
[1] STRATFORD M, ASSINDER S.Yeast flocculation: Flo1 and NewFlophenotypes and receptor structure[J].Yeast, 1991, 7(6): 559-574.
[2] BARNEY M C, JANSEN G P, HELBERT J R.Use of genetic transformation for the introduction of flocculence into yeast[J].Journal of the American Society of Brewing Chemists, 1980, 102(4):S17-22.
[3] RUSSELL I, STEWART G G, READER H P, et al.Revised nomenclature of genes that control yeast flocculation[J].Journal of the Institute of Brewing, 1980, 86(3): 120-121.
[4] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-ΔΔCp)Method[J].Methods, 2001, 25(4):402-408.
[5] MIKAEL K A, JOSé M A B, MARTIN B A, et al.The real-time polymerase chain reaction[J].Molecular Aspects of Medicine, 2006, 27(27):95-125.
[6] 張中保, 李會勇, 石云素,等.應用實時熒光定量PCR技術分析玉米水分脅迫誘導基因的表達模式[J].植物遺傳資源學報, 2007, 8(4):421-425.
[7] 趙鮮仙, 周玚, 張思偉,等.ADH7啟動子精細調控表達MSN2釀酒酵母菌株對糠醛耐受的研究[J].微生物學通報, 2015, 42(10):1 903-1 911.
[8] 張博潤, 陳蔚, 鐵翠娟, 等.酵母菌絮凝的分型及其生理生化特性的研究[J].微生物學報, 1999, 39(6): 527-532.
[9] 常玉廣, 夏四清,馬放,等.絮凝微生物 F2 的絮凝表型分析[J].同濟大學學報: 自然科學版, 2009, 37(6): 801-804.
[10] GOVENDER P, DOMINGO J L, BESTER M C, et al.Controlled expression of the dominant flocculation genesFLO1,FLO5, andFLO11 inSaccharomycescerevisiae[J].Applied & Environmental Microbiology, 2008, 74(19):6 041-6 052.
[11] TOFALO R, PERPETUINI G, DI G P, et al.Genetic diversity ofFLO1 andFLO5 genes in wine flocculentSaccharomycescerevisiaestrains[J].International Journal of Food Microbiology, 2014, 191(2):45-52.

