益腎蠲痹丸對破骨細胞-調(diào)節(jié)性T細胞共培養(yǎng)體系中破骨細胞分化及功能的影響?
郭明慧,徐慧慧,李曉亞,王 貴,黃 晶,呂 爽,路相臣,趙宏艷,肖 誠
(1.北京中醫(yī)藥大學(xué),北京 100029; 2. 中日友好醫(yī)院臨床醫(yī)學(xué)研究所,北京 100029; 3. 中國醫(yī)學(xué)科學(xué)院/北京協(xié)和醫(yī)科大學(xué),北京 100193; 4. 中國中醫(yī)科學(xué)院醫(yī)學(xué)實驗中心,北京 100700)
骨骼處于不斷更新的動態(tài)平衡中,重復(fù)著骨吸收-骨形成的過程,免疫系統(tǒng)能影響骨組織的動態(tài)平衡[1]。調(diào)節(jié)性T細胞(regulatory t cells,Tregs)是一類控制體內(nèi)自身免疫反應(yīng)性的T細胞亞群,與自身免疫性疾病的發(fā)生關(guān)系密切,增強Tregs細胞的活性有助于治療類風(fēng)濕關(guān)節(jié)炎(RA)誘發(fā)的骨丟失[2]。破骨細胞(osteoclast,OC)在骨破壞的過程中發(fā)揮著重要的作用。有證據(jù)表明,Treg細胞可以在體外和體內(nèi)抑制OC分化,這與其通過分泌轉(zhuǎn)化生長因子β(TGF-β)、白介素(IL)-10和IL-4調(diào)節(jié)破骨細胞生成有關(guān)。Tregs不僅通過細胞因子途徑發(fā)揮對OC的抑制作用,還可通過直接接觸途徑抑制破骨細胞分化及功能[3-4],因此本課題組建立了OC-Tregs共培養(yǎng)體系[4]。益腎蠲痹丸(YSJB)是著名醫(yī)家朱良春先生的名方,可以調(diào)節(jié)RA患者的免疫功能,臨床療效顯著[5-6]。本研究通過此建立的OC-Tregs共培養(yǎng)體系,探討益腎蠲痹丸對共培養(yǎng)體系中OC分化及功能的影響。
1 材料
1.1 動物
6~8周齡雄性C57BL/6小鼠,由北京斯貝福生物技術(shù)有限公司提供,飼養(yǎng)于首都醫(yī)科大學(xué)附屬安貞醫(yī)院清潔級實驗動物室(實驗動物使用許可證號SCXK(京)2016-0002)。6周齡雄性SD大鼠,由中國食品藥品檢定研究所提供,飼養(yǎng)于中國中醫(yī)科學(xué)院中醫(yī)基礎(chǔ)理論研究所(實驗動物使用許可證號SCXK(京)2016-0021)。
1.2 藥品及主要試劑
YSJB由江蘇正大清江制藥公司提供;來氟米特(LEF),蘇州長征-欣凱制藥有限公司提供。α-MEM培養(yǎng)基、RPMI-1640培養(yǎng)基,美國Hyclone公司;青霉素、鏈霉素,美國Gibco公司;FBS胎牛血清,美國BioTech公司;小鼠重組核因子κв受體活化因子配基(RANKL)、巨噬細胞集落刺激因子(M-CSF)、小鼠重組IL-2,美國Peprotech公司;小鼠TGF-β1,美國R&D公司;抗小鼠CD3抗體、抗小鼠CD28抗體,美國BD公司;小鼠CD4+T細胞預(yù)富集試劑盒、小鼠CD25+T細胞分選試劑盒、Blocking Solution,加拿大Stemcell公司;甲苯胺藍、抗酒石酸磷酸酶(TRAP)試劑盒,美國Sigma公司;牛骨片,英國Immunodiagnostic Systems Limited公司;小鼠IL-10 ELISA試劑盒,法國Diaclone公司;小鼠高遷移率族蛋白1(HMGB1)ELISA試劑盒,美國Chondrex公司;總RNA提取試劑盒、PrimeScriptTMRTreagent Kit試劑盒、SYBR Premix Ex TaqTMⅡRT-PCR試劑盒,日本Takara公司。
1.3 主要儀器
二氧化碳細胞培養(yǎng)箱、NanoDrop 2000C超微量分光光度計,美國 Thermo Scientific 公司;PCR儀,美國 Bio-RAD公司。
2 方法
2.1 制備含藥血清
40只6周齡雄性SD大鼠按隨機數(shù)字表法分為假免疫組、CIA 組、CIA+LEF組、CIA+YSJB 4組各10只,采用Ⅱ型膠原免疫制作CIA模型免疫2周后, LEF組灌服LEF(2.15 mg/kg/d),每日1次,連續(xù)灌胃給藥3 d,YSJB組灌服YSJB(3.702 g/kg/d),每日2次,連續(xù)灌胃給藥3 d;末次給藥1 h 后,戊巴比妥鈉麻醉,無菌條件下經(jīng)腹主動脈采血,靜置 1 h 后離心,分離血清是為含藥血清。CIA 組和假免疫組灌服等容積的蒸餾水,按以上程序分離血清,所取血清分別為 CIA 組血清和假免疫組血清。血清于-80 ℃冰箱保存?zhèn)溆谩?/p>
2.2 Tregs-OC共培養(yǎng)體系的建立
2.2.1 破骨細胞前體細胞的分離與培養(yǎng) C57BL/6 小鼠脫頸處死,無菌分離股骨、脛骨,收集骨髓細胞懸液,用含20ng/ml M -CSF 的 α -MEM 培養(yǎng)液(含10% FBS、100U/ml 青霉素、100μg/ml鏈霉素)接種于培養(yǎng)瓶中。24 h后收集未貼壁細胞,以1×105個/孔加入96 孔培養(yǎng)板內(nèi),5×105個/孔加入24孔培養(yǎng)板內(nèi)。培養(yǎng)3 d后得到破骨前體細胞。
2.2.2 CD4+CD25+Tregs的誘導(dǎo)激活 C57BL/6 小鼠脫頸處死,無菌分離脾臟制備脾細胞懸液,將細胞濃度調(diào)整至1×108個/ml,用小鼠CD4+T細胞預(yù)富集、小鼠CD25+T細胞分選試劑盒及磁珠分選器進行分選,用分化培養(yǎng)液(RPMI-1640培養(yǎng)基+2 μg/ml抗小鼠CD28+1000 U/ml IL-2+10 ng/ml TGF-β+10%FBS+100 U/ml 青霉素、100 μg/ml鏈霉素)重懸細胞,接種于用抗小鼠CD3(10 μg/ml,50 μl/孔)包被過的圓底96孔板內(nèi),此為誘導(dǎo)成功的Tregs,陽選的CD4+CD25+Tregs用于進行后續(xù)實驗。此為本課題前期摸索的實驗方法,經(jīng)流式細胞術(shù)鑒定Tregs表型[4]。
2.2.3 OC-Tregs共培養(yǎng)體系的建立 按前期方法[4],將M-CSF預(yù)誘導(dǎo)3 d后的破骨前體細胞與誘導(dǎo)激活后陽選的Tregs以1∶25比例加入96孔/24孔板內(nèi),建立共培養(yǎng)體系,所采用的培養(yǎng)液為OC分化培養(yǎng)基(20 ng/mlM-CSF、100ng/mlRANKL、10%FBS、100 U/ml 青霉素、100 μg/ml鏈霉素的α-MEM培養(yǎng)基)。
2.3 共培養(yǎng)體系中破骨細胞分化及骨吸收功能的檢測
按上述方法,將M-CSF預(yù)誘導(dǎo)3 d后的破骨前體細胞與誘導(dǎo)激活后陽選的Tregs以1∶25的比例加入96孔板內(nèi)(孔板內(nèi)預(yù)置蓋玻片或牛骨片),第3天加入10%含藥血清,分別是假免疫組血清(OC+Tregs+Control組)、CIA模型組血清(OC+Tregs+CIA組)、CIA+LEF組血清(OC+Tregs+LEF組)、CIA+YSJB組血清(OC+Tregs+YSJB組),隔日半量換液,保持含藥血清濃度不變。培養(yǎng)第6天,TRAP染色后倒置相差顯微鏡下計數(shù)96孔板內(nèi)TRAP染色陽性的OC(細胞核≥3)數(shù)目;培養(yǎng)至第12天,取出牛骨片進行甲苯胺藍染色,顯微鏡下觀察骨吸收陷窩形態(tài),用Leica Qwin圖像分析系統(tǒng)分析骨吸收陷窩面積。
2.4 共培養(yǎng)體系上清中IL-10和HMGB1含量的檢測
培養(yǎng)至第6天取各組的培養(yǎng)上清,采用ELISA法測定細胞上清中IL-10和HMGB1的含量。
2.5 共培養(yǎng)體系中HMGB1、晚期糖基化終末產(chǎn)物受體(RAGE)和IL-10基因表達的檢測
表1顯示,培養(yǎng)至第6天,采用Real-time PCR法檢測Tregs中的IL-10mRNA和OC內(nèi)的HMGB1、RAGE mRNA表達水平。各組細胞按Takara RNA 提取試劑盒說明書提取總RNA,并測定總RNA純度和濃度,根據(jù)總RNA用PrimeScriptTMRTreagent Kit試劑盒合成cDNA。引物根據(jù)基因庫同源基因序列進行設(shè)計,由上海生工合成。Real-time PCR 步驟按照SYBR Premix Ex TaqTMⅡRT-PCR試劑盒說明書進行,擴增條件為95 ℃變性30 s,95 ℃ 5 s,60 ℃ 30 s,擴增45個循環(huán),實驗數(shù)據(jù)由PCR檢測儀收集,按照2-△△ct相對定量公式計算各組目的基因表達量。

表1 引物序列
2.6 統(tǒng)計學(xué)方法

3 結(jié)果
3.1 益腎蠲痹丸對OC-Tregs共培養(yǎng)體系中破骨細胞分化及骨吸收功能的影響
表2圖1顯示,與OC+Tregs+Control組比較,OC+Tregs+CIA組、OC+Tregs+LEF組、OC+Tregs+YSJB組OC數(shù)目及骨吸收陷窩面積明顯增加(P<0.01,P<0.05);與OC+Tregs+CIA組比較,OC+Tregs+LEF組和OC+Tregs+YSJB組OC分化數(shù)目和骨吸收陷窩面積顯著減少(P<0.01)。
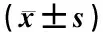
表2 OC-Tregs共培養(yǎng)體系內(nèi)OC數(shù)量和骨陷窩吸收面積的變化
注:與OC+Tregs+Control組比較:*P<0.05,**P<0.01;與OC+Tregs+CIA組比較:##P<0.01

圖1 OC-Tregs共培養(yǎng)體系中OC數(shù)量和骨吸收陷窩的變化(×100)注:a.OC+Tregs+Control組;b.OC+Tregs+CIA組;c.OC+Tregs+LEF組;d.OC+Tregs+YSJB組
3.2 益腎蠲痹丸對OC-Tregs共培養(yǎng)內(nèi)IL-10 和HMGB1蛋白表達的影響
與OC+Tregs+Control組比較,OC+Tregs+CIA組、OC+Tregs+LEF組和OC+Tregs+YSJB組Tregs分泌的IL-10含量顯著降低(P<0.01);與OC+Tregs+CIA組比較,OC+Tregs+LEF組和OC+Tregs+YSJB組Tregs分泌的IL-10含量顯著增加(P<0.01)。
表3顯示,與OC+Tregs+Control組比較,OC+Tregs+CIA組、OC+Tregs+LEF組和OC+Tregs+YSJB組破骨細胞分泌的HMGB1含量顯著增加(P<0.01);與OC+Tregs+CIA組比較,OC+Tregs+LEF組和OC+Tregs+YSJB組破骨細胞分泌的HMGB1含量顯著減少(P<0.01)。
3.3 益腎蠲痹丸對OC-Tregs共培養(yǎng)內(nèi)IL-10 mRNA和HMGB1、RAGE mRNA表達的影響
與OC+Tregs+Control組比較,OC+Tregs+CIA組Tregs中IL-10 mRNA表達量顯著降低(P<0.01);與OC+Tregs+CIA組比較,OC+Tregs+LEF組和OC+Tregs+YSJB組Tregs中IL-10 mRNA表達量顯著增加(P<0.01)。
表3顯示,與OC+Tregs+Control組比較,OC+Tregs+CIA組、OC+Tregs+YSJB組中破骨細胞HMGB1 mRNA表達量明顯增加(P<0.01,P<0.05),OC+Tregs+CIA組中破骨細胞RAGE mRNA表達量明顯升高(P<0.05);與OC+Tregs+CIA組比較,OC+Tregs+LEF組和OC+Tregs+YSJB組中破骨細胞HMGB1、RAGE mRNA表達量明顯減少(P<0.01,P<0.05)。

表3 OC-Tregs共培養(yǎng)體系內(nèi)IL-10、HMGB1、RAGE 表達的變化
注:與OC+Tregs+Control組比較:**P<0.01,*P<0.05;與OC+Tregs+CIA組比較:##P<0.01,#P<0.05
4 討論
益腎蠲痹丸以熟地黃、淫羊藿、骨碎補補肝腎、扶正氣;以烏梢蛇、白僵蠶、全蝎、露蜂房蠲痹通絡(luò),搜剔病邪,諸藥相合、標本兼顧、扶正祛邪對痹癥有較好的療效[7-8]。實驗研究也表明,益腎蠲痹丸能減輕CIA大鼠踝關(guān)節(jié)腫脹程度,顯著抑制CIA大鼠組織病理改變,且對腎虛證和脾虛證CIA大鼠也有明顯的療效[9-11]。大鼠的病理學(xué)研究表明,益腎蠲痹丸能使滑膜組織炎癥減輕,膠原纖維沉著減少,軟骨細胞增生修復(fù)[12]。
RA是最常見的自身免疫性疾病,可以導(dǎo)致關(guān)節(jié)畸形及功能喪失,抑制RA患者關(guān)節(jié)局部破壞對于治療RA有重要意義。研究表明,骨組織和免疫系統(tǒng)之間相互影響[13]。因此本課題組建立了OC-Tregs共培養(yǎng)體系,以期探討骨與免疫系統(tǒng)之間的關(guān)系,并應(yīng)用此培養(yǎng)體系探討雷公藤甲素對該培養(yǎng)體系中OC分化的影響[4]。YSJB是臨床治療類風(fēng)濕關(guān)節(jié)炎的常用中成藥,研究表明該藥對免疫系統(tǒng)有調(diào)節(jié)作用,因此本研究以該共培養(yǎng)體系為研究對象,探討YSJB治療RA 的作用機制。結(jié)果顯示,OC+Tregs+CIA組OC數(shù)目和骨陷窩吸收面積顯著高于OC+Tregs+Control組,而YSJB能明顯抑制共培養(yǎng)體系中OC 的分化,減少OC的骨吸收。
有研究表明,Tregs調(diào)節(jié)作用部分依賴于IL-10抑制促炎因子生成[14]。HMGB1是RA中重要的促炎介質(zhì),血清HMGB1水平升高與更具破壞性的關(guān)節(jié)炎有關(guān)[15];而且RAGE是HMGB1的受體, HMGB1的分泌增加和RAGE的表達增加能促進炎癥的發(fā)展[16]。本實驗結(jié)果表明,共培養(yǎng)體系Tregs IL-10分泌OC+Tregs+CIA組明顯低于OC+Tregs+Control組,OC HMGB1、RAGE分泌和表達OC+Tregs+CIA組明顯高于OC+Tregs+Control組;而OC+Tregs+YSJB組IL-10含量明顯高于OC+Tregs+CIA組,HMGB1、RAGE表達明顯低于OC+Tregs+CIA組,說明YSJB能促進共培養(yǎng)體系中Tregs對IL-10的分泌,抑制OC中HMGB1和RAGE的表達。
綜上所述,益腎蠲痹丸能抑制OC-Tregs共培養(yǎng)體系中OC分化和骨吸收功能,其機制與促進Tregs IL-10的分泌,抑制OC HMGB1、RAGE表達有關(guān),這可能是其治療RA的作用機制之一。
參考文獻:
[1] CRISCITIELLO C,VIALE G,GELAO L,et al. Crosstalk between bone niche and immune system:osteoimmunology signaling as a potential target for cancer treatment[J]. Cancer Treat Rev,2015,41(2):61-68.
[2] ZAISS MM,F(xiàn)REY B,HESS A,et al. Regulatory T cells protect from local and systemic bone destruction in arthritis [J]. J Immunol,2010,184(12):7238-7246.
[3] BOZEC A,ZAISS MM. T Regulatory Cells in Bone Remodelling [J]. Curr Osteoporos Rep,2017,15(3):121-125.
[4] HUIHUI XU,HONGYAN ZHAO,CHENG LU, et al. Triptolide Inhibits Osteoclast Differentiation and Bone Resorption In Vitro via Enhancing the Production of IL-10 and TGF-β by Regulatory T Cells [J]. Mediators Inflamm,2016,2016:8048170.
[5] 郭會卿.益腎蠲痹丸治療頑痹150例療效觀察[J].時珍國醫(yī)國藥,2006,17(10):2039-2040.
[6] 李雪芬,鐘詩婷,鄧矢明.益腎蠲痹丸治療類風(fēng)濕性關(guān)節(jié)炎臨床研究[J]. 河南中醫(yī),2017,37(2):313-315.
[7] 華江. 益腎蠲痹丸治療痹癥60例[J]. 浙江中醫(yī)學(xué)院學(xué)報,2002,26(3):39.
[8] 王露,黃云臺,孟慶良. 益腎蠲痹丸治療骨性關(guān)節(jié)炎的臨床療效及安全性研究[J]. 中國中醫(yī)藥現(xiàn)代遠程,2010,8(13):192-193.
[9] 趙宏艷,王燕,于崢,等. 益腎蠲痹丸對腎虛證與脾虛證CIA大鼠免疫因子的調(diào)節(jié)作用研究[J]. 中國中醫(yī)基礎(chǔ)醫(yī)學(xué)雜志,2013,19(3):261-263.
[10] 王晶晶,劉靜,裴天仙,等. 益腎蠲痹丸對Ⅱ型膠原致關(guān)節(jié)炎大鼠踝關(guān)節(jié)組織病理改變的影響及其機制研究[J]. 中草藥,2016,47(17):3064-3069.
[11] 肖誠,趙宏艷,王燕,等. 益腎蠲痹丸對腎虛證與脾虛證膠原誘導(dǎo)性關(guān)節(jié)炎大鼠的療效比較[J]. 中日友好醫(yī)院學(xué)報,2014,28(2):102-107.
[12] 呂愛平,王安民, 曾曉蓮. 益腎蠲痹丸對大鼠實驗性痹癥影響的病理學(xué)研究[J]. 中醫(yī)雜志,1998,6:49-51.
[14] 汪錫金,葉民,張宇紅,等. 白介素-10抑制促炎因子生成保護多巴胺能神經(jīng)元[J]. 上海交通大學(xué)學(xué)報,2008,28(5):521-524.
[15] PULLERITS R,SCHIERBECK H,UIBO K,et al. High mobility group box protein 1-A prognostic marker for structural joint damage in 10-year follow-up of patients with juvenile idiopathic arthritis[J]. Semin Arthritis Rheum,2017,46 (4):444-450.
[16] BEIJNUM JR,BUURMAN WA,GRIFFIOEN AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1 (HMGB1)[J]. Angiogenesis, 2008,11(1):91-99.

