黃芪多糖對缺血再灌注損傷臍靜脈內皮細胞抗氧化應激機制探討?
王紅芹,孫明杰,武 乾,石曉路,孫麗華,吳 旸
(1. 北京市中醫藥防治重大疾病基礎研究重點實驗室,中國中醫科學院醫學實驗中心機能室,北京 100700; 2. 北京中醫藥大學東方醫院心血管內科,北京 100078)
缺血性心臟病是全人類發病率和死亡率最高的常見疾病之一,臨床表明及時恢復缺血心肌的血運供應(再灌注治療)可有效減少心肌梗塞面積,提高長期的心肌功能,降低死亡率[1]。但研究發現,再灌注療法可加重缺血區域組織的損傷,臨床主要表現為心肌頓抑、心律失常、心臟微血管“無復流”現象的發生[2]。其中,心臟微血管“無復流”的發生與內皮細胞功能障礙密切相關[3],內皮細胞功能障礙在心肌缺血的起始和發展階段均起到重要作用[4]。因此,保護內皮細胞功能對抗心肌缺血再灌注損傷(myocardial ischemia reperfusion injury,MIRI)有重要意義。中醫理論認為,心肌缺血再灌注損傷“無復流”現象的發生與氣虛血瘀密切相關,其中心氣虛是造成血瘀的重要原因[5],益氣活血法是中醫治療MIRI 的主要手段。黃芪是傳統的補氣中藥,臨床治療心肌缺血再灌注損傷療效確定。黃芪多糖是黃芪的主要成分之一,研究表明黃芪多糖具有抗氧化、抗炎、增加內皮細胞活性等作用[6]。本實驗以臍靜脈內皮細胞(human umbilical Vein Endothelial cell,HUVEC)為靶細胞,探討黃芪多糖對缺血再灌注損傷內皮細胞氧化應激機制的影響。
1 材料
1.1 細胞
臍靜脈內皮細胞(原代細胞株,ScienCell,8000)。
1.2 試劑
內皮細胞培養基(ScienCell,1001)內含500 ml內皮培養基、25 ml胎牛血清、5 ml內皮細胞生長因子、5 ml青/鏈霉素溶液,RIRP裂解液(碧云天生物技術,P0013B), PMSF(碧云天生物技術,ST506),黃芪多糖(貴州迪大生物科技有限公司,GZDD-2490),美托洛爾(Sigma,80337), 活性氧檢測試劑盒(碧云天生物技術,S0033),LDH檢測試劑盒(碧云天生物技術,C0016),MDA檢測試劑盒(碧云天生物技術,S0131),JC-1檢測試劑盒(碧云天生物技術,C2006),BCA蛋白濃度測定試劑盒(碧云天生物技術,P0010)。儀器:倒置相差顯微鏡(Olympus,IMT-2),CO2培養箱(Thermo,51030999),三氣培養箱(Thermo,3131),全自動酶標儀(Biotec,synergyH1),離心機(Ependorff,5804R)
2 方法
2.1 細胞培養
原代細胞株復蘇后,待細胞長到85%左右融合,將其消化、離心重懸后按照1∶3比例傳代,細胞周期為24 h。
2.2 模型建立
將培養至5代85%左右融合的HUVEC消化重懸后(密度 1×10-5/ml)隨機分為正常對照組、模型組、黃芪多糖組(25 μg·ml-1)、美托洛爾組(20 μmol·L-1)。2 h細胞貼壁后,模型組與藥物組原培養液吸出,PBS洗1遍,模型組換為無糖造模液(NaCl 6.80、KCl 0.40、NaHCO32.20、CaCl20.20、MgSO4·7H2O 0.20、NaH2PO4·2H2O 0.140 g/L),藥物組換為含有相應藥物濃度的無糖造模液,將其放入三氣培養箱(94%N2、5%CO2、1%O2)中培養4 h模擬缺血缺氧,之后更換為內皮細胞培養基(含5%FBS、1%ECGS、1%P/S)放入正常培養箱(95%O2、5%CO2)中培養16 h模擬再灌注,模型和各藥物組分別于缺氧和復氧的同時加入相應濃度的藥物,正常對照組始終在正常條件下培養24 h。
2.3 MTT法檢測細胞活性
將培養至5代的85%左右融合的HUVEC消化重懸后(密度 1×10-5/ml)隨機分為正常對照組、模型組、黃芪多糖 12.5 μg·ml-1組、黃芪多糖 25 μg·ml-1組、 黃芪多糖 50 μg·ml-1組、美托洛爾組(20 μmol·L-1),按照上述模型建立的方法造模結束后,將孔內的培養液吸出,每孔加入含有MTT溶液(5 mg/ml)的內皮細胞培養基100 μl(MTT溶液∶培養基=1∶10),放入37℃ CO2培養箱避光孵育4 h,孵育結束后將孔內液體吸出,每孔加入100 μl DMSO,搖床中搖10 min,酶標儀490 nm檢測吸光值。
2.4 細胞內ROS檢測
將鋪到6孔板的HUVEC按照模型建立的方法分組、造模,結束后將6孔板內的細胞消化離心后倒掉上清,PBS洗1遍,按照試劑盒操作說明書懸浮細胞檢測方法進行后續操作,酶標儀488 nm激發波長,525 nm發射波長進行檢測。
2.5 細胞內MDA檢測
將鋪到培養皿(10×10 mm)的HUVEC按照模型建立的方法分組、造模,結束后將各培養皿內細胞消化離心后PBS洗1遍,1000 r/5 min離心倒掉上清,每組加入200 μl 含有1 mmol PMSF的RIPA裂解液,冰上裂解20 min,裂解結束后10000 r/5 min 離心,使用BCA蛋白測定試劑盒進行蛋白定量,按照試劑盒說明書進行后續操作,酶標儀530 nm進行檢測。
2.6 LDH漏出率檢測
將鋪到96孔板的HUVEC按照模型建立的方法分組、造模,分別收集缺氧結束后的無糖造模液和復氧結束后的細胞培養液,按照試劑盒方法檢測OD值。細胞內LDH OD值測定:復氧結束后收集細胞培養液,按照試劑盒操作說明書每孔加入含有LDH釋放試劑的無血清培養基120 μl,室溫避光孵育30 min,400 g/5 min離心,按照試劑盒操作說明書進行后續操作,酶標儀490 nm檢測,600 nm作為參考波長。LDH漏出率=[(無糖造模液OD值-相應空白對照組OD值)+(復氧細胞培養液OD值-細胞培養液空白對照OD值)]/[(無糖造模液OD值-相應空白對照組OD值)+(復氧細胞培養液OD值-細胞培養液空白對照OD值)+含LDH釋放試劑的無血清培養基OD值]。
2.7 線粒體膜電位(JC-1)檢測
將鋪到6孔板的HUVEC按照模型建立的方法分組、造模,結束后將6孔板內的細胞消化離心后倒掉上清,PBS洗1遍,按照試劑盒操作說明書上懸浮細胞檢測方法進行后續操作,酶標儀490 nm激發波長,530 nm發射波長檢測單體,500 nm激發波長、540 nm發射波長檢測聚合物。
2.8 統計學方法

3 結果
3.1 不同濃度黃芪多糖對缺血再灌注損傷HUVEC活性的影響
表1顯示,與正常對照組比較,模型組及模型加各加藥組的OD值均降低,差異有統計學意義(P<0.05),表明HUVEC缺氧4 h、復氧16 h后細胞活性降低,模型成功;與模型組比較,黃芪多糖25 μg·ml-1組與美托洛爾組(20 μmol·L-1)OD值升高且差異有統計學意義(P<0.05),而黃芪多糖12.5 μg·ml-1、50 μg·ml-1組與模型組OD值比較差異無統計學意義(P>0.05),表明黃芪多糖25 μg·ml-1對缺血再灌注損傷HUVEC的保護作用最為明顯,故后續實驗選用黃芪多糖25 μg·ml-1作為最佳實驗濃度。
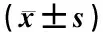
表1 不同濃度黃芪多糖對缺血再灌注損傷HUVEC活性比較
注:與正常對照組比較:*P<0.05;與模型組比較:△P<0.05
3.2 黃芪多糖對缺血再灌注損傷HUVEC ROS、MDA含量及線粒體膜電位、LDH漏出率影響
表2顯示,與正常對照組比較,模型組、黃芪多糖組及美托洛爾組細胞內ROS、MDA含量、LDH漏出率顯著升高(P<0.05),線粒體膜電位顯著降低(P<0.05);與模型組比較,黃芪多糖組、美托洛爾組細胞內ROS、MDA含量、LDH漏出率顯著降低(P<0.05),線粒體膜電位顯著升高(P<0.05)。
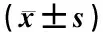
表2 黃芪多糖對缺血再灌注損傷HUVEC ROS、MDA含量及線粒體膜電位、LDH漏出率影響比較
注:與正常對照組比較:*P<0.05;與模型組比較:△P<0.05
4 討論
心肌缺血再灌注時由于氧氣的大量涌入,ROS生成增多,超過了抗氧化系統的清除能力,使體內氧化/抗氧化失衡發生氧化應激[7]。ROS可促進中性粒細胞、炎癥主效應細胞的活化和募集,使內皮細胞與炎性細胞發生黏附,造成血管內微血栓形成,血流減少,最終導致心臟微血管“無復流”現象的發生[8];ROS還是引起細胞死亡的主要因素,因此抗氧化應激對于減少缺血再灌注造成的“無復流”現象具有重要作用。細胞缺氧時糖酵解增加,LDH生成增多,缺血再灌注可造成細胞損傷,細胞膜通透性增加,LDH從細胞內漏出增多;過氧自由基與細胞膜上的不飽和脂肪酸反應生成脂質氫過氧化物,脂質氫過氧化物可分解生成MDA[7],使細胞內MDA含量增多。ROS還能影響線粒體膜電位,心肌缺血再灌注時可造成線粒體膜電位下降[9]。減少氧化應激反應的發生,是抗心肌缺血再灌注造成的血管內皮細胞功能障礙的重要靶點。
傳統中醫理論認為,氣虛血瘀是心肌缺血再灌注損傷的基本病機。在臨床應用中,益氣活血法常被用于改善心肌缺血再灌注后癥狀。何志明[10]等在觀察自擬益氣復脈通絡方對冠心病介入治療后心絞痛療效中發現,益氣復脈通絡方可改善冠心病介入治療后心絞痛癥狀,提高中醫證候積分,并能降低其炎癥反應。傅廣[11]等在觀察芪參益氣滴丸對經皮冠狀動脈介入治療圍手術期心肌損傷的影響中發現,芪參益氣滴丸可降低PCI圍手術期Tn1和CK-MB濃度,減輕穩定型心絞痛患者PCI圍手術期心肌損傷。黃芪是傳統的中醫補氣要藥,黃芪多糖是黃芪的主要成分之一,既往研究報道黃芪多糖可通過抗氧化、抗炎、保護線粒體功能、減少內皮細胞-中性粒細胞相互作用、抑制內皮細胞凋亡發揮抗心肌缺血再灌注損傷作用。朱海燕等[12]發現,黃芪多糖可減少缺血再灌注損傷人心臟微血管內皮ICAM-1、VCAM-1的表達,抑制白細胞浸潤,減輕心肌缺血再灌注損傷。范宗靜[13-14]等在觀察黃芪多糖對心肌線粒體影響研究中發現,黃芪多糖可減輕缺血再灌注損傷大鼠心肌細胞內鈣超載,降低線粒體膜電位,抑制mPTP開放,減輕線粒體損傷,通過保護線粒體功能,從而保護缺血再灌注損傷心臟;黃芪多糖還可上調缺血再灌注損傷人心臟微血管內皮細胞Bcl-2的表達,抑制Bax的升高,減少微血管內皮細胞凋亡,發揮抗心肌缺血再灌注損傷作用,但對于內皮細胞的影響研究仍較少。
本研究結果表明,體外培養HUVEC缺氧4 h、復氧16 h后,模型組細胞活性下降,模型組細胞內MDA、ROS顯著增多,LDH漏出率增高;當給予黃芪多糖干預后,細胞活性增加,LDH漏出率、細胞內MDA、ROS含量顯著減少。既往研究中[15]有報道,黃芪多糖對乳鼠心肌細胞缺氧/復氧損傷存在保護作用, 可提高缺氧/復氧損傷乳鼠心肌細胞活性,減少LDH漏出和MDA含量,與本實驗結果相符。此外從實驗結果可以看出,黃芪多糖可顯著提高缺血再灌注損傷HUVEC線粒體膜電位。但既往黃芪多糖抗心肌缺血再灌注損傷線粒體機制研究中發現,黃芪多糖可減少大鼠心肌細胞線粒體膜電位[14]。考慮到心肌缺血發生時電子傳遞鏈被抑制,線粒體膜電位下降;當再灌注發生時,電子傳遞鏈的恢復可使膜電位升高,但ROS增多誘導MPTP開放,線粒體內膜通透性增加,Ca2+超載,消散膜電位,會造成膜電位下降[16-17];黃芪多糖可能通過減少ROS生成,抑制線粒體通透性轉換孔開放,從而減少Ca2+超載而升高膜電位。
內皮細胞功能障礙貫穿于心肌缺血再灌注損傷的起始和發展階段,維護內皮細胞功能對抗心肌缺血再灌注損傷有重大意義。本研究結果表明,黃芪多糖可減少缺血再灌注損傷內皮細胞ROS、脂質過氧化產物的生成,減少氧化應激發生,通過抗氧化應激機制拮抗缺血再灌注造成的內皮細胞損傷,進而發揮抗MIRI的作用。
參考文獻:
[1] IBANEZ B,HEUSCH G,OVIZE M,et al.Evolving therapies for myocardial ischemia/reperfusion injury[J].Journal CME activity,2015,65(14):735-1097.
[2] KLONER R A.Mitochondrial Protective Agents for Ischemia/Reperfusion Injury[J].Circulation:Cardiovascular Interventions,2017,10:1-3.
[3] HOFFMAN J W,GILBERT T B,POSTEN R S,et al.Myocardial reperfusion injury:Etiology,mechanisms,and therapies[J].The journal of the American society of extra-Corporeal technology,2004,36:391-411.
[4] VANHOUTTE PM.Endothelial dysfunction:the first step toward coronary arteriosclerosis[J]. Circ J,2009,73:595-601.
[5] 謝連娣,劉洋,周琨,等.心肌缺血再灌注損傷的中醫病機淺識[J].中華中醫藥雜志,2015,30(9):3139-3141.
[6] 楊慶珍,劉德旺,田義新,等.黃芪多糖化學結構與藥理作用研究進展[J].北方園藝,2015,7:168-175.
[7] BIRBEN E,SAHINERAL U M,SACKESEN C,et al.Oxidative Stress and Antioxidant Defense[J].WAO journal,2012:9-19.
[8] YANG Q,HE G Y,UNDERWOOD M J.Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury:perspectives and implications for postischemic myocardial protection[J].Am J Transl Res,2016,8(2):765-777.
[9] SEIDLMAYER L K,JUETTNER V V,KETTLEWELL S, et al.Distinct mPTP activation mechanisms in ischaemia-reperfusion:contributions of Ca2+,ROS, pH,and inorganic polyphosphate[J].Cardiovascular Research,2015,106:237-248.
[10] 何志明,陳冬清,呂小強,等.自擬益氣復脈通絡方對冠心病介入治療后心絞痛療效及對VEGF、sICAM-1、MMPs-9、炎癥因子表達的影響[J].中國中醫急癥,2017,26(7):1306-1308.
[11] 傅廣,馬麗霞,石順華,等.芪參益氣滴丸對經皮冠狀動脈介入治療圍手術期心肌損傷的影響[J].中國循證心血管醫學雜志,2014,6(1):71-73.
[12] 朱海燕,陳立新,朱陵群.黃芪多糖對缺氧復氧后人心臟微血管內皮細胞ICAM-1、VCAM-1表達的影響[J].遼寧中醫雜志,2008,35(2):293-295.
[13] 范宗靜,謝連娣,董巧稚,等.黃芪多糖抗心肌缺血再灌注損傷的線粒體機研究[J].中國中醫基礎醫學雜志,2017,23(4):484-487.
[14] 范宗靜,吳旸,劉洋,等.心肌缺血再灌注損傷引發的線粒體功能障礙與黃芪多糖的干預作用[J].遼寧中醫雜志,2016,43(4):867-869.
[15] 閔清,白育庭,余薇,等.黃芪多糖對乳鼠心肌細胞缺氧/復氧損傷的保護作用[J].中國藥理學通報,2010,26(12):1661-1664.
[16] SANDERSON T H,REYNOLDS C A,KUMAR R, et al.Molecular Mechanisms of Ischemia-Reperfusion Injury in Brain: Pivotal Role of the Mitochondrial Membrane Potential in Reactive Oxygen Species Generation [J].Mol Neurobiol,2012:1-15.
[17] HüTTEMANN M,HELLING S,SANDERSON T H,et al.Regulation of mitochondrial respiration and apoptosis through cell signaling:Cytochrome c oxidase and cytochrome c in ischemia/reperfusion injury and inflammation[J].Biochimica et Biophysica Acta,2011,1817(2012):598-609.

