NH4+對次生鐵礦物形成及重金屬去除的影響
宋永偉,王鶴茹,曹艷曉,朱祎涵,周立祥 (.中南財經政法大學環境科學與工程系,湖北 武漢 430073;.南京農業大學環境工程系,江蘇 南京 0095)
酸性礦山廢水(AMD)具有酸度高且含有大量 Fe、SO42–及重(類)金屬元素的特點[1-4].AMD主要采用石灰中和法治理[5-7],但其處理成本高且中和效率低,并會導致大量Fe(OH)3、Fe(OH)2、CaSO4等廢渣產生.嗜酸性氧化亞鐵硫桿菌(A.ferrooxidans)能高效催化酸性環境中 Fe2+向Fe3+轉化,并伴隨Fe3+水解產生施氏礦物、黃鐵礬等次生鐵礦物[8-9].施氏礦物化學組成可表示為Fe8O8(OH)8-2x(SO4)x(1≤x≤1.75)[10],呈管狀隧道結構,含有活性較強的—OH,SO42–與Fe配位殼層絡合,同時礦物表面吸附有大量的、對其結構起穩定作用的 SO42–[11-13].隧道內 SO42–可以被離子半徑相當、但與 Fe配位能力更強的陰離子(如CrO42–等)所取代[14].黃鐵礬化學組成可表示為MFe3(SO4)2(OH)6(M 通常指 K+、Na+、NH4+等),為黃色或淡黃色晶體[15],具有易沉淀和過濾脫水等優點,是性能優異、稀有昂貴的赭黃色無機顏料[16],且作為固定化載體時有助于A.ferrooxidans生物膜的形成[17-20].已經證實,施氏礦物和黃鐵礬對重(類)金屬元素均有較大的吸附或共沉淀作用,是較為理想的吸附材料[21-24],對含重金屬廢水(如酸性礦山廢水、電鍍廢水、制革廠含鉻廢水等)的治理具有潛在應用價值.
次生鐵礦物形成的影響因素主要包括反應時間、溫度、體系酸度、能源物質Fe2+濃度、陽(陽)離子種類/濃度等[25-30].次生鐵礦物形成的實質是 Fe2+氧化(耗酸)和 Fe3+水解(產酸)過程,Fe3+供應速率決定了其合成行為.本課題組推測,A.ferrooxidans介導的次生鐵礦物礦相和礦量可能主要受體系中酸效應、Fe2+濃度、以及 Fe與M(K+、Na+、NH4+等)的比例 3 因素的調控.已有研究表明,提高K+濃度有助于黃鉀鐵礬的形成而不利于施氏礦物生成[31-33].Fe2+=160mmol/L體系中,Fe/Na物質的量比在1.0~2.0范圍內所獲得次生鐵礦物均為純凈施氏礦物;當 Fe/Na物質的量比降至 0.5時,次生鐵礦物合成途徑開始向黃鈉鐵礬轉移,且其特征衍射峰隨著 Na+濃度提高愈加顯著[34].但通過考察K+、NH4+、Na+共存體系下的生物成礦效果,只收集到黃鉀鐵礬和施氏礦物的混合物,并未發現黃銨鐵礬和黃鈉鐵礬[35].可見,3種一價陽離子促進Fe向次生鐵礦物轉變的能力迥異.然而,在礦物生物合成及礦相轉變報道中,關于黃銨鐵礬的資料相對較少.那么,NH4+促進Fe成礦能力、次生鐵礦物相與礦物量關系、施氏礦物和黃銨鐵礬之間的轉變和調控等科學問題尚需進一步證實.
基于上述疑問,本研究通過A.ferrooxidans介導的生物礦化法,研究不同 AMD酸性環境下NH4+對體系中Fe2+氧化率、總Fe沉淀率、次生鐵礦物礦相/礦量等的影響,并比較分析次生鐵礦物對Cr(VI)、As(III)的去除效果及機理.以期為促使AMD中Fe向次生鐵礦物的生物轉變和調控提供必要的理論依據.
1 材料與方法
1.1 供試材料
改良 9K液體培養基:(NH4)2SO43.5g、KCl 0.119g、K2HPO40.058g、Ca(NO3)24H2O 0.0168g、MgSO47H2O 0.583g,蒸餾水 1000mL, pH=2.50,121℃滅菌30min.
A. ferrooxidans休止細胞:將A. ferrooxidans接種在改良 9K培養基中,置于 28℃、180r/min搖床中振蕩擴培,待指數生長后期停止培養.將培養液經定性濾紙過濾以除去生成的沉淀物,濾液以 10000×g離心力(4℃、10min)收集菌體,并用pH=1.5的H2SO4清洗3次,除去各種雜離子.將這些菌體懸浮于pH=2.5的H2SO4溶液中.采用雙層平板計數法測得菌液密度為5×108cell/mL.
1.2 NH4+對A. ferrooxidans介導的次生鐵礦物合成的影響研究
在系列500mL三角瓶中加入改良9K液體培養基,按20,80,160mmol/L的Fe2+濃度梯度準確加入 FeSO4·7H2O.采用(NH4)2SO4作為 NH4+來源進行調節,設置 Fe/NH4+物質的量比梯度分別為0.1,0.5,1.0,2.0.用 1:1的 H2SO4調上述所有體系pH值至2.6,2.3,2.0,依此共設置36個處理.隨后接種A. ferrooxidans休止細胞,并補充去離子水,使體系有效容積為 250mL,A. ferrooxidans密度約為 5×107cells/mL.將上述三角瓶置于 28℃、180r/min搖床中進行生物氧化和水解成礦反應.定期取樣過0.22μm濾膜(三角瓶預先靜置5min,然后取上清液),測定和計算Fe2+濃度、總Fe沉淀率.培養終點時,用中速定性濾紙收集合成的次生鐵礦物,并用去離子水潤洗 2次以去除礦物表面吸附的離子.60℃烘干后進行稱重和礦物相鑒定.不同處理均設3個重復.
1.3 生物成因次生鐵礦物對 Cr(VI)、As(III)的去除效果比較研究
在250mL三角瓶中加入Fe2+=160mmol/L、Fe/NH4+=2.0時,各pH值下獲得次生鐵礦物0.05g和一定濃度的 Cr(VI)溶液(由 K2Cr2O7配制)或As(III)溶液(由As2O3配制).采用去離子水稀釋至95mL,然后用1mol/L的HNO3調節pH值分別至1.0,2.0,3.0,4.0,5.0,以模擬不同酸度水平的礦山廢水,最后用去離子水補充至總有效體積為100mL,使溶液中Cr(VI)或As(III)濃度分別為10,1mg/L.將三角瓶置于28℃、180r/min搖床中振蕩6h,過濾測定液相中 Cr(VI)或 As(III)含量.同時設置pH=7.0作為對照,每個處理重復3次.
1.4 測定方法
Fe2+和總Fe濃度采用鄰啡羅啉比色法測定;礦物相采用X射線衍射儀測定(Bruker D8A25);SEM采用SU8010型掃描電鏡觀察;XPS采用VG Multilab 2000光電子能譜儀測定;用二苯碳酰二肼比色法測定Cr(VI);As(III)采用AFS-9730型原子熒光光譜儀測定;用BET吸附法測定次生鐵礦物的比表面積(Micromeritic ASAP 2020).
1.5 數據處理與統計分析
以Origin 8.0軟件作圖,采用SPSS軟件統計分析,方差分析后通過SNK方法進行多重比較.
2 結果與討論
2.1 酸性體系Fe2+、總Fe濃度變化情況
以初始 pH=2.0為例,考察了 Fe2+濃度和Fe/NH4物質的量比對Fe2+氧化和總Fe沉淀的綜合影響.當NH4+濃度在A. ferrooxidans耐受范圍內時,160,80,20mmol/LFe2+分別在 72,48,24h內被完全氧化(圖 1).Fe/NH4+=0.1、Fe2+=80~160mmol/L和Fe/NH4+=0.5、Fe2+=160mmol/L系列處理中,A. ferrooxidans氧化活性均受到抑制,表現在 Fe2+平均氧化率不到 5%.分析認為,(NH4)2SO4作為中性鹽,過高 NH4+濃度可能導致體系滲透壓變化以致菌體水分流失而失活.根據Fe/NH4+=0.5、Fe2+= 80mmol/L 和 Fe/NH4+=1.0、Fe2+=160mmol/L處理可知(NH4+=160mmol/L),雖然Fe2+分別能夠在48h和72h內被氧化完全,但其生物氧化過程相對延緩.通過比較可初步判斷,A. ferrooxidans對NH4+的耐受濃度臨界值在80~160mmol/L范圍內,被完全抑制濃度臨界值在160~320mmol/L之間.
根據次生鐵礦物的生化反應式(如下所示),在 NH4+存在條件下,Fe2+氧化過程往往會伴隨著產物 Fe3+的水解形成施氏礦物或黃銨鐵礬,從而促使溶液中可溶性Fe有效沉淀.
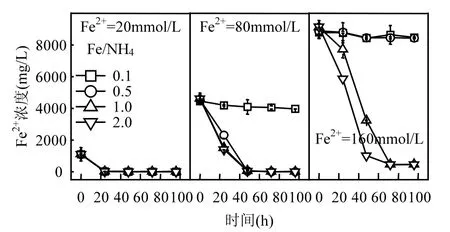
圖1 初始pH=2.0時Fe2+濃度變化Fig.1 Change of Fe2+ concentration in each treatment system when initial pH value was 2.0

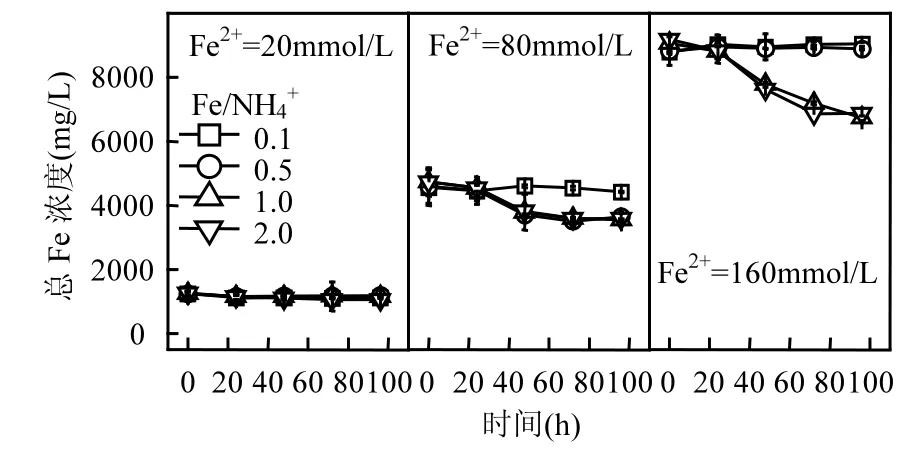
圖2 初始pH=2.0時總Fe濃度變化Fig.2 Change of total Fe concentration in each treatment system when initial pH value was 2.0
結合圖1、圖2可知,當酸性體系初始pH值和Fe2+濃度一定時,若A. ferrooxidans生物氧化活性未受抑制,則Fe/NH4+物質的量比對總Fe濃度影響較小,這與同為一價陽離子的K+存在一定差異.柏雙友等發現,當 Fe2+=80mmol/L、Fe/K=25~200時均能夠促使約31%的總Fe沉淀,當提高K+濃度至 Fe/K=10時,總 Fe累積沉淀率則超過40%[36].從培養時間角度觀察,160,80,20mmol/L的Fe2+體系總Fe濃度分別在72,48,24h基本趨于穩定,至培養終點時平均總 Fe沉淀率分別為24.03%,19.46%,8.13%.可見,初始 Fe2+濃度越高,Fe3+供應速率越快,越有利于體系總 Fe沉淀.在Fe2+完全生物氧化期間,160,80,20mmol/L體系所對應的 Fe3+供應速率分別為 2.22,1.67,0.83mmol/(L·h),這也為上述推斷提供合理的解釋.進一步分析表明,總 Fe沉淀率變化趨勢與Fe2+氧化過程基本一致,說明 Fe3+水解可能伴隨Fe2+生物氧化才能進行,若 Fe2+氧化完全,則次生鐵礦物合成也隨即終止.
2.2 生物成因次生鐵礦物質量比較
總Fe濃度變化只能表征酸性體系中可溶性Fe的沉淀情況,而次生鐵礦物質量則可更直觀地反映A. ferrooxidans對Fe2+的生物礦化效果.如圖3所示,次生鐵礦物質量隨初始pH值降低而出現減少的現象,這可能與次生鐵礦物特性有一定的關系.由于 NH4+成礬能力較弱,反應過程可能更傾向于易擴散和溶解的施氏礦物合成[37-39].劉奮武等研究表明,當酸性體系 pH值從 3.0下調至2.0后,施氏礦物 72h內的溶解率從 3.34%增至61.46%[40].依此可知,要促使總Fe沉淀率提高,對反應體系pH值的適當調控至關重要.
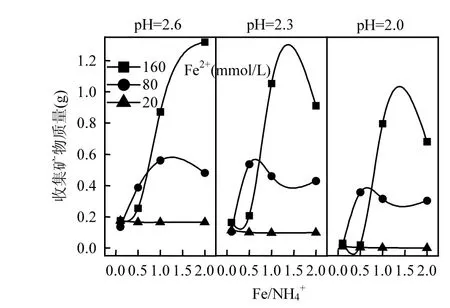
圖3 培養終點收集礦物質量比較Fig.3 The comparison of mineral mass at the culture end of each treatment system
從 Fe2+濃度來看,提高體系初始 Fe2+濃度有助于礦物的大量合成,這與圖2結果相吻合.但從Fe/NH4+物質的量比變量分析,發現圖2與圖3之間存在“矛盾”.前已述及,NH4+在A. ferrooxidans耐受范圍內時,Fe/NH4+物質的量比對體系總 Fe濃度影響較小,總Fe沉淀率曲線基本重合.而由圖3可知,在Fe/NH4+=0.5或1.0時能夠獲取更多的次生鐵礦物(pH=2.0~2.3),隨著 Fe/NH4+繼續提高(NH4+濃度降低)而呈下降趨勢.分析認為,這與次生鐵礦物的形成途徑具有一定關系,當體系中 NH4+適量時,更有利于成礦過程傾向黃銨鐵礬的合成.由反應式(2)、(3)來看,若次生鐵礦物按單一路徑發生,則單位Fe3+所生成純黃銨鐵礬質量應為純施氏礦物的1.5倍以上,這也為次生鐵礦物產量的增加提供可能.綜上,雖然NH4+成礬能力較弱,其濃度變化對總 Fe沉淀去除的“貢獻”較小,適量NH4+仍有助于次生鐵礦物的生物合成.
2.3 生物成因次生鐵礦物XRD圖譜
圖4為Fe2+=160mmol/L體系培養終點收集次生鐵礦物XRD圖譜.參考JCPDS黃銨鐵礬和施氏礦物標準圖譜可知[41],當 NH4+濃度滿足要求時,較低初始 pH值有利于黃銨鐵礬形成,表現為黃銨鐵礬部分衍射峰隨著pH值的下降而出現并逐漸增強(如 2θ=17.31°,28.72°,38.82°,45.59°等).根據反應式(2)、(3)可知,1mol Fe3+水解生成施氏礦物可釋放出2.75mol的H+,而水解生成黃銨鐵礬卻只能釋放出2mol的H+.相比之下,過低初始pH值可能對施氏礦物合成行為的抑制作用更大,從而導致黃銨鐵礬更易形成.王長秋等在用化學方法合成黃鉀鐵礬時也報道過相似現象[42].根據衍射峰位及強度(2θ=35.16°)判斷[43],Fe/NH4+=2.0、pH=2.6處理所獲得次生鐵礦物中為純凈施氏礦物.當 NH4+濃度上升至 160mmol/L(Fe/NH4+=1.0)或酸性體系初始 pH值下調至 2.3時,次生鐵礦物合成途徑開始向黃銨鐵礬轉變,收集產物為施氏礦物和黃銨鐵礬混合物.Fe/NH4=0.1~0.5時,施氏礦物特征峰基本消失,黃銨鐵礬關鍵峰位與標準圖譜基本重合,其相對強度隨著NH4+濃度提高愈加顯著,說明該條件有利于純黃銨鐵礬的形成.Bai等[44]研究表明,初始 Fe2+=160mmol/L溶液中,Fe/K≤100時就開始出現黃鉀鐵礬衍射峰.本研究中,Fe/NH4物質的量比則需下調至 1.0~2.0才能出現黃銨鐵礬,說明 NH4+成礬能力遠小于K+.
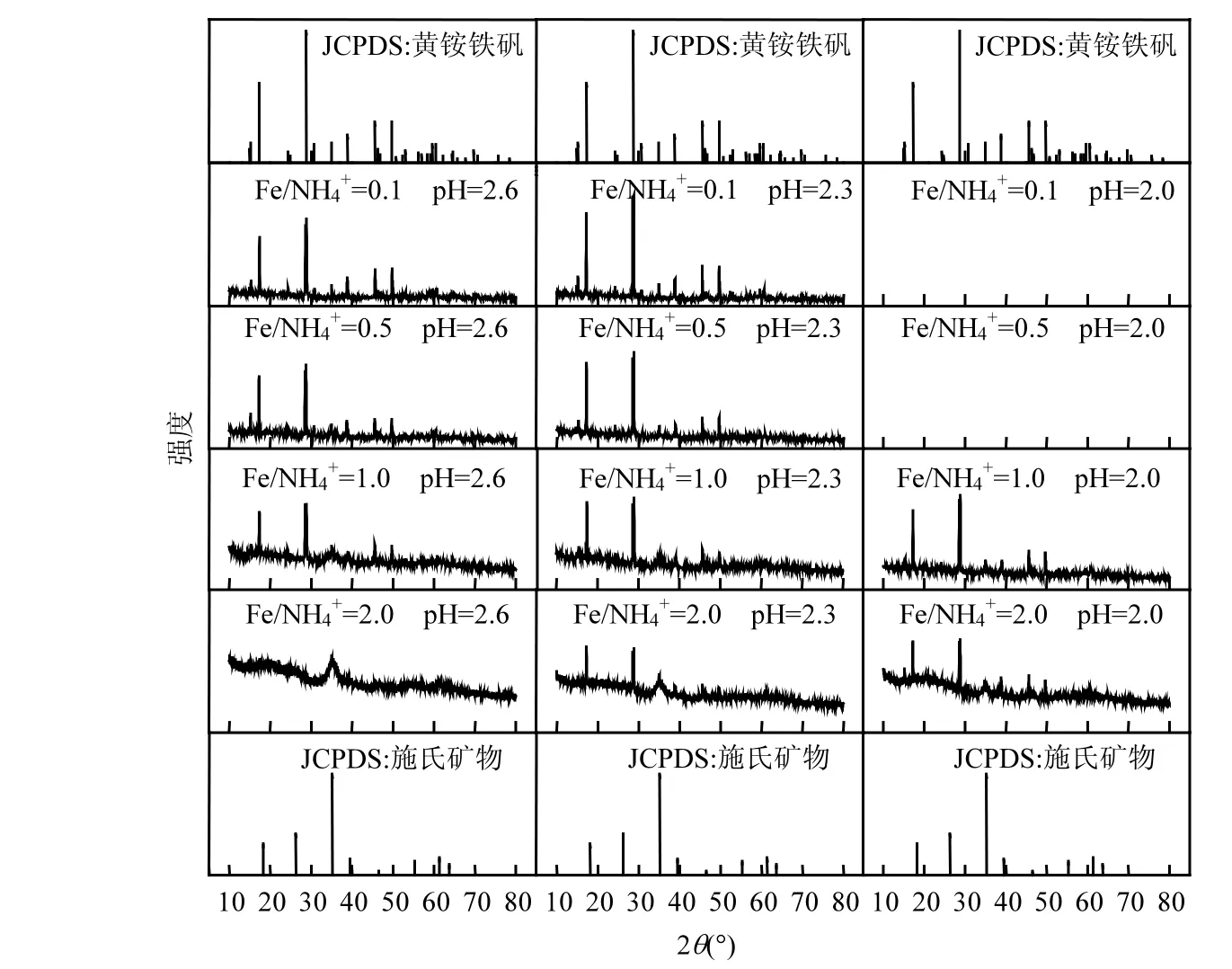
圖4 Fe2+濃度為160mmol/L時收集礦物XRD圖譜Fig.4 The XRD of minerals when Fe2+ initial concentration was 160mmol/L
2.4 生物成因次生鐵礦物對 Cr(VI)、As(III)的去除效果比較及分析
為比較 NH4+存在下次生鐵礦物對酸性礦山廢水中Cr(VI)、As(III)的去除效果,根據XRD圖譜(圖 4)的差異分析,選擇 Fe/NH4+=2.0時,初始pH=2.6,2.3,2.0對應3個成礦體系獲得的次生鐵礦物作為對象進行考察.結果如圖5所示,不同酸性體系獲得次生鐵礦物對Cr(VI)、As(III)去除效果存在明顯差別,表現為有毒元素去除率依次為pH=2.6>pH=2.3>pH=2.0.例如,pH=2.6,2.3,2.0 體系收集次生鐵礦物對pH=4.0模擬酸性礦山廢水Cr(VI)和As(III)去除率為74.23%,51.57%,33.56%和 71.56%,49.65%,41.14%;對照處理 Cr(VI)和As(III)去除率分別達到 95.34%,85.24%,75.23%和94.23%,87.27%,71.09%.
受溶液 pH值的影響,不同酸性礦山廢水中Cr(VI)、As(III)也表現為多種形態共存,其理化性質也隨之發生變化.因此,同一礦物對不同形態金屬離子的吸附去除也存在較大差異[45].已知Cr(VI)和 As(III)受溶液酸堿度影響而引起各形態之間的轉化過程如下所示:
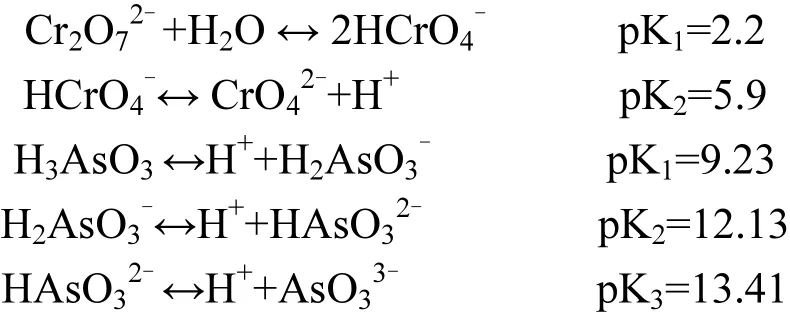
在此,選擇Fe/NH4+=2.0、pH=2.6處理獲得純施氏礦物,結合不同酸度條件下 Cr(VI)和 As(III)離子形態來比較和分析各自吸附過程.施氏礦物作為一種結晶度較差的羥基硫酸高鐵礦物,其晶格構造的管道直徑與AsO33-、CrO42-相當,且結構內的 SO42-與 Fe配位絡合,同時礦物表面還結合了大量起到穩定結構的SO42-和高活性-OH基團,這些都為重(類)金屬離子的去除提供了有利條件[46].以 Cr(VI)為例,當 pH<3.0 時,隨著酸度的增大,Cr(VI)趨于中性的 H2Cr2O7,不利于施氏礦物的吸附;當 3.0<pH <6.0,其主要存在形式為HCrO4-,易與 Fe(III)發生絡合而去除[47];當pH>6.0 時,Cr(VI)以 CrO42-的形式存在,可與施氏礦物表面結構中的 SO42-發生交換,亦可與 SO42-通過配位體交換被固定到礦物內部結構中,因此能夠獲得較好的去除效果[11,47].另外,由As(III)離子形態轉換可知,當溶液酸度較高時,主要以呈電中性的 H3AsO3分子形態存在,其很難取代施氏礦物結構中的 HSO4-和 SO42-基團,從而影響As(III)的去除效率[48].
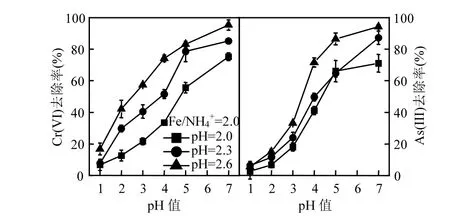
圖5 pH值對次生鐵礦物吸附去除Cr(VI)和As(III)的影響Fig.5 Effecet of pH value on removal of Cr(VI) and As(III) by secondary iron minerals
為考察該施氏礦物對 Cr(VI)或 As(III)的吸附特點,選擇模擬酸性礦山廢水pH=3.0時經吸附處理后的施氏礦物進行XPS能譜分析.雖然本研究中監測到施氏礦物對 Cr(VI)的去除率接近60%,但并未發現明顯的 Cr(VI)強度峰.分析認為HCrO4-可能與施氏礦物內部的 Fe(III)發生了絡合而被固定到內部結構中,但XPS只能做表面分析,對內部的化學組分、結構及價態等信息難以檢測.另外,分析表明施氏礦物表面吸附As(III)的存在形態為 As2O3.根據 As(III)在不同酸度溶液中的形態來看,應以 H3AsO3為主.筆者認為,在檢測XPS前,施氏礦物預先經過烘干處理, 可能導致吸附的H3AsO3失水而形成As2O3.結合前人研究結果,推斷該酸性環境下 As(III)的少量去除可能通過與礦物表面的-OH發生取代反應來實現(M-OH+H3AsO3? M-H2AsO3+H2O)[49].


圖6 不同處理下生物成因施氏礦物SEM照片Fig.6 SEM images of schwertmannite under different treatments
為進一步分析圖5中3種礦物表現出的有毒元素吸附去除能力顯著差異的原因,通過掃描電鏡、比表面積等方法對其進行了測試比較.由圖6掃描電鏡照片可以發現,3種礦物均為球體或橢圓體結構并凝聚成團,但三者表觀結構存在明顯差異.pH=2.0處理所得礦物表面相對光滑,顆粒大小不一,比表面積8.22m2/g;pH=2.3培養體系獲得礦物呈“毛線團”、“蠶繭”形狀,表面粗糙并含有大量微孔結構,測定顆粒比表面積14.28m2/g.XRD圖譜分析表明,pH=2.0,2.3體系合成礦物為施氏礦物和黃銨鐵礬的混合物,雖然通過掃描電鏡照片也可以觀察到少量不規則顆粒存在,但混合產物仍以施氏礦物為主.與前兩個處理相比,pH=2.6條件下合成純施氏礦物的表觀結構差異更加顯著,顆粒構成“海膽”、“板栗殼”形狀,表面布滿針狀毛刺,孔隙較大、孔洞較深,測定顆粒比表面積達 24.47m2/g.Loan等觀察也表明,酸性礦山廢水中形成的施氏礦物多數呈球型“海膽”結構,但直徑只有 300~500nm,表面布滿長約60~90nm 的針狀毛刺[38,41,50-51].眾所周知,礦物顆粒比表面積越大,其吸附性能越強.因此,從表觀結構和比表面積兩個方面都能夠合理解釋 3種次生鐵礦物對Cr(VI)、As(III)吸附去除能力存在較大差異性的原因.
3 結論
3.1 NH4+濃度在A. ferrooxidans耐受范圍內時,不影響 Fe2+氧化及總 Fe沉淀去除效果.初始160,80,20mmol/L的Fe2+分別能夠在72,48,24h內被完全生物氧化,培養終點時(96h)平均總 Fe沉淀率分別為24.03%,19.46%,8.13%.
3.2 初始 Fe2+=160mmol/L體系中,Fe/NH4+=2.0、pH=2.6處理獲得次生鐵礦物為純凈施氏礦物;當 Fe/NH4+≤1.0、pH≤2.3 時,礦物的生物合成途徑開始向黃銨鐵礬轉移,且其特征衍射峰隨著NH4+濃度提高表現地愈加明顯.
3.3 初始 Fe2+=160mmol/L、Fe/NH4+=2.0時,pH=2.6,2.3,2.0體系下獲得的次生鐵礦物對Cr(VI)或 As(III)的吸附去除效果存在顯著差異,表現在去除率依次為 pH=2.6>pH=2.3>pH=2.0.分析表明,礦物的表觀結構和比表面積是引起有毒元素去除能力存在較大差異性的主要原因.
[1]Wei X, Wolfe F A. Minerals and mine drainage [J]. Water Environment Research, 2013,85(10):1515-1547.
[2]Vhahangwele M. A novel technology for neutralizing acidity and attenuating toxic chemical species from acid mine drainage using cryptocrystalline magnesite tailings [J]. Journal of Water Process Engineering, 2016,10(6):67-77.
[3]Wu Z L, Zou L C, Chen J H, et al. Column bioleaching characteristic of copper and iron from Zijinshan sulfide ores by acid mine drainage [J]. International Journal of Mineral Processing, 2016,149:18-24.
[4]Liu G W, Bai R C. Development of the acidic mining wastewater treatment technology [J]. Applied Mechanics and Materials,2013,295-298:1372-1375.
[5]Song Y W, Wang M, Liang J R, et al. High-rate precipitation of iron as jarosite by using a combination process of electrolytic reduction and biological oxidation [J]. Hydrometallurgy, 2014,143(3):23-27.
[6]Meschke K, Herdegen V, Aubel T, et al. Treatment of opencast lignite mining induced acid mine drainage (AMD) using a rotating microfiltration system [J]. Journal of Environmental Chemical Engineering, 2015,4(4):2848-2856.
[7]Lee W C, Lee S W, Yun S T, et al. A novel method of utilizing permeable reactive kiddle (PRK) for the remediation of acid mine drainage [J]. Journal of Hazardous Materials, 2016,301:332-341.
[8]宋永偉,趙博文,霍敏波,等.溫度對嗜酸性硫桿菌活性和生物成因次生鐵礦物形成的影響 [J]. 環境科學, 2013,34(8):3264-3271.
[9]Zhu J Y, Gan M, Zhang D, et al. The nature of Schwertmannite and Jarosite mediated by two strains of Acidithiobacillus ferrooxidans with different ferrous oxidation ability [J]. Materials Science and Engineering C, 2013,33(5):2679-2685.
[10]Schwertmann U, Bigham J M, Murad E. The first occurrence of schwertmannite in a natural stream environment [J]. European Journal of Mineralogy, 1995,7:547-552.
[11]Bigham J M, Schwertmann U, Carlson L. A poorly crystallized xyhydoxysulfate of iron formed by bacterial oxidation of Fe(II) in acid mine waters [J]. Geochimica et Cosmochimica Acta, 1990,54:2743-2758.
[12]Regenspurg S, G?bner A, Peiffer S, et al. Potential remobilization of toxic anions during reduction of arsenate and chromated schwertmannite by the dissimilatory Fe(III)-reducing bacterium Acidiphilium Cryptum JF-5 [J]. Water, Air, and Soil Pollution,2002,2(3):57-67.
[13]Gagliano W B, Brill M R, Bigham J M, et al. Chemistry and mineralogy of ochreous sediments in a constructed mine drainage wetland [J]. Geochimica et Cosmochimica Acta, 2004,68:2119-2128.
[14]Regenspurg S, Brand A, Peiffer S. Formation and stability of schwertmannite in acid mining lakes [J]. Geochimica et Cosmochimica Acta, 2004,68:1185-1197.
[15]Bigham J M, Nordstrom D K. Iron and aluminum hydroxysulfates from acid sulfate waters [J]. Reviews in Mineralogy and Geochemistry, 2000,40,351-403.
[16]周順桂,周立祥,黃煥忠.黃鉀鐵礬的生物合成與鑒定 [J]. 光譜學與光譜分析, 2004,24(9):1140-1143.
[17]Karamanev D G. Model of the biofilm structure of Thiobacillus ferrooxidans [J]. Journal of Biotechnology, 1991,20(1):51-64.
[18]Elgersma F, Witkamp G J, Van Rosmalen G M. Simultaneous dissolution of zinc ferrite and precipitation of ammonium jarosite[J]. Hydrometallurgy, 1993,34:23-47.
[19]Dutrizac J E. The effect of seeding on the rate of precipitation of ammonium jarosite and sodium jarosite [J]. Hydrometallurgy,1996,42:293-312.
[20]Gómez J M, Cantero D, Webb C. Immobilisation of Thiobacillus ferrooxidans cells on nickel alloy fibre for ferrous sulphate oxidation [J]. Applied Microbiology and Biotechnology, 2000,54:335-340.
[21]陳福星,周立祥.生物催化合成的施氏礦物對廢水中Cr(VI)的吸附 [J]. 中國環境科學, 2006,26(1):11-15.
[22]Gan M, Sun S G, Zheng Z H, et al. Adsorption of Cr(VI) and Cu(II) by AlPO4modified biosynthetic schwertmannite [J].Applied Surface Science, 2015,356(30):986-997.
[23]Mihone K M, Hana F, Sanda R, et al. Assessment of metal risks from different depths of jarosite tailing waste of Trep?a Zinc Industry, Kosovo based on BCR procedure [J]. Journal of Geochemical Exploration, 2015,148:161-168.
[24]Zhang S L, Jia S Y, Yu B, et al. Sulfidization of As(V)-containing schwertmannite and its impact on arsenic mobilization [J].Chemical Geology, 2016,420(20):270-279.
[25]劉奮武,高詩穎,王 敏,等.鎂離子對氧化亞鐵硫桿菌生物合成次生鐵礦物的影響 [J]. 中國環境科學, 2014,34(3):713-719.
[26]劉奮武,高詩穎,崔春紅,等.Ca2+對酸性硫酸鹽環境中次生鐵礦物合成的影響 [J]. 中國環境科學, 2015,35(4):1142-1148.
[27]Dutrizac J E, Kaiman S. Synthesis and properties of jarosite-type compounds [J]. Canadian Mineralogist, 1976,14:151-158.
[28]Dutrizac J E. The effectiveness of jarosite species for precipitating sodium jarosite [J]. Journal of the Minerals, Metals and Materials Society, 1999,51(12):30-32.
[29]鄧志明,周正華.濕法煉鋅浸出沉鐵探討 [J]. 湖南有色金屬,2002,18(1):23-25,45.
[30]宋永偉,陳 婷,王鶴茹,等.陰離子對 Acidithiobacillus ferrooxidans氧化活性及次生鐵礦物形成影響 [J]. 中國環境科學, 2018,38(2):574-580.
[31]Bigham J M, Schwertmann U, Traina S J, et al. Schwertmannite and the chemical modeling of iron in acid sulfate waters [J].Geochimica et Cosmochimica Acta, 1996,60(12):2111-2121.
[32]Gramp J P, Sandy Jones F, Bigham J M, et al. Monovalent cation concentrations determine the types of Fe(III) hydroxysulfate precipitates formed in bioleach solutions [J]. Hydrometallurgy,2008,94(1-4):29-33.
[33]Liao Y, Zhou L, Liang J, et al. Biosynthesis of schwertmannite by Acidithiobacillus ferrooxidans cell suspensions under different pH condition [J]. Materials Science and Engineering C, 2009,29(1):211-215.
[34]宋永偉,王鶴茹,梁劍茹,等.嗜酸性氧化亞鐵硫桿菌介導的次生鐵礦物形成的影響因素分析:pH、Fe2+、Fe/Na [J]. 環境科學學報, 2017,DOI:10.13671/j.hjkxxb.2017.0360.
[35]柏雙友,梁劍茹,周立祥.一價陽離子和水溶性有機質對生物瀝浸中次生鐵礦物形成的影響 [J]. 礦物學報, 2011,31(1):118-125.
[36]柏雙友,梁劍茹,周立祥.FeSO4-K2SO4-H2O體系中Fe/K摩爾比對生物成因羥基硫酸鐵礦物質量的影響及環境意義 [J]. 環境科學學報, 2010,30(8):1601-1607.
[37]Dold B. Dissolution kinetics of schwertmannite and ferrihydrite in oxidized mine samples and their detection by differential X-ray diffraction (DXRD) [J]. Applied Geochemistry, 2003,18(10):1531-1540.
[38]Loan M, Richmond W R, Parkinson G M. On the crystal growth of nanoscale schwertmannite [J]. Journal of Crystal Growth,2005,275(1/2):1875-1881.
[39]李浙英,梁劍茹,柏雙友,等.生物成因與化學成因施氏礦物的合成、表征及其對As(Ⅲ)的吸附 [J]. 環境科學學報, 2011,31(3):460-467.
[40]劉奮武,卜玉山,田國舉.溫度與pH對生物合成施氏礦物在酸性環境中溶解行為及對 Cu2+吸附效果的影響 [J]. 環境科學學報,2013,33(9):2445-2451.
[41]J?nsson J, Persson P, Sj?berg S, et al. Schwertmannite precipitated from acid mine drainage: phase transformation,sulfate release and surface properties [J]. Applied Geochemistry,2005,20:179-191.
[42]王長秋,馬生鳳,魯安懷.黃鉀鐵礬類礦物沉淀去除 Cr(VI)的初步研究 [J]. 礦物巖石地球化學通報, 2006,25(4):335-338.
[43]Bigham J M, Carlson L, Murad E, et al. Schwertmannite, a new iron oxyhydroxysulfate from Pyhasalmi, Finland, and other localities [J]. Acta Archaeologica, 1994,80(393):190-192.
[44]Bai S Y, Xu Z H, Wang M, et al. Both initial concentrations of Fe(II) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments [J]. Materials Sciences and Engineering C, 2012,32(8):2323-2329.
[45]Kedar N G, Katsutoshi I. Adsorptive separation of arsenate and arsenite anions from aqueous medium byusing orange waste [J].Water Research, 2003,37:4945-4953.
[46]廖岳華.施氏礦物的生物合成及去除水中砷的效果與機理研究[D]. 南京:南京農業大學, 2008.
[47]Regenspurg S, Peiffer S. Arsenate and chromate incorporation in schwertmannite [J]. Applied Geochemistry, 2005,20:1226-1239.
[48]Duquesne K, Lebrun S. Immobilization of arsensite and ferric iron by Acidithiobacillus ferrooxidans and its relevance to acid mine drainage [J]. Applied and Environmental Microbiology,2003,69(10):6165-6173.
[49]Jain A, Raven K P, Loeppert R H. Arsenite and Arsenate adsorption on ferrihydrite: surface charge reduction and net OH-release stoichiometry [J]. Environmental Science &Technology, 1999,33:1179-1184.
[50]?ubrt J, Bohá?ek J, ?tengl V, et al. Uniform particles with a large surface area formed by hydrolysis of Fe2(SO4)3with urea [J].Materials Research Bulletin, 1999,34(6):905-914.
[51]孫紅福,趙峰華,叢志遠,等.在我國發現的 Schwertmannite礦物及其特征 [J]. 礦物學報, 2006,26(1):38-42.

