傀儡湖沉積物-水界面硝酸鹽異養還原過程研究
薛驚雅 ,姜星宇 ,姚曉龍 ,李 敏 ,張 路 (1.中國科學院大學,北京 100049;2.中國科學院南京地理與湖泊研究所湖泊與環境國家重點實驗室,江蘇 南京 210008)
氮是湖泊、河流等水生生態系統的重要營養組分,其含量的變化勢必會影響到水生生態系統結構和功能的穩定[1-2].過高的氮負荷致使水質不斷惡化,引起水體富營養化,擴大水體缺氧面積,最終導致藍藻水華的頻繁暴發[3-4].此外,大量研究表明,在總氮含量保持不變的情況下,氮的不同形態組成及形態變化對水域生態系統健康具有重要影響[5].氨氮和硝酸鹽是水域生態系統中主要的無機氮形態,氨氮在有氧條件下可通過微生物作用被氧化為硝酸鹽(硝化過程);硝酸鹽在無氧狀態下經反硝化細菌可被還原為氮氣,釋放出水體,達到脫氮的目的[6].然而,越來越多的研究發現[7-8],硝酸鹽在還原為氮氣的過程中,還存在與反硝化作用相反的硝酸鹽還原過程——硝酸鹽異養還原為氨(DNRA).
反硝化及DNRA過程是水體中硝酸鹽還原的兩個主要過程[6].雖然這兩個過程都屬于硝酸鹽的還原過程,但兩個過程最終對硝酸鹽的轉化結果卻大相徑庭.反硝化過程是以有機質作為電子供體將硝酸鹽還原為氮氣的過程[8],而 DNRA過程是將硝酸鹽還原為銨根離子,繼續以生物可利用的形式存在于水體中[6].兩個過程都是以硝酸根作為反應底物,所以DNRA過程和反硝化過程之間存在競爭關系.有大量的文獻報道硝酸鹽異氧還原過程與其影響因子的關系.Deng等[9]研究了長江口沉積物中硝酸鹽異氧還原過程,認為有機質濃度、硫化物是主要影響因子.Song等[10]對東海沉積物的研究發現溶解氧和有機質是主要的影響因子.此外,也有研究認為沉積物含水率、溫度是影響反硝化和DNRA過程的主要因子[11-12].然而,目前已有的研究對淡水湖泊生態系統硝酸鹽異養還原過程的研究還相對較少,對水體中硝酸鹽的歸趨轉化途徑認識不足.因此,研究不同環境條件下反硝化過程與DNRA過程的相對強弱、不同環境因子的作用及硝酸鹽最終的轉化歸趨,對評估水體未來的氮素含量、制定合理的控制思路具有重要意義.
太湖流域是長江三角洲的核心區域,也是中國人口密度最大的區域之一.經濟快速發展的同時,也促使大量的無機氮進入太湖流域的眾多湖泊及河流,引起嚴重的水體污染問題[13].氮污染是該區域最為嚴重的環境問題之一.本研究以太湖流域的傀儡湖為研究對象,采用近年來新興的OX/MIMS方法快速測定15N標記的硝酸鹽在泥漿中的異化還原過程,快速測定15NH4+-N濃度,計算得DNRA速率;反硝化速率需結合同位素示蹤技術獲得.本研究旨在比較傀儡湖硝酸鹽異養還原過程中DNF和DNRA的相對貢獻率及可能的環境因素對其產生的影響,對傀儡湖中的硝酸鹽的轉化與歸趨過程有全面的了解.此外,本研究彌補了國內淡水生態系統中硝酸鹽異養還原過程研究的空缺,為太湖流域其他河流、湖泊的硝酸鹽異養還原過程的研究提供了參考.
1 材料與方法
1.1 研究區域
傀儡湖(31°21′~31°30′N,120°39′~120°51′E)位于太湖流域下游,是昆山市的封閉型湖泊水源地.湖面呈橢圓形,南北最長端 4.80km,東西最寬處為2.48km,湖面面積為6.73km2,多年平均水位2.93m,蓄水量 10×106m3.傀儡湖容積較小,湖體中部水淺底平,屬吞吐形的小型湖泊,西北側與陽澄湖相鄰,并通過野尤涇和箱涵(暗渠)承接陽澄湖來水,由廟涇河作為出湖河道.上游來水、農業面源污染、養殖污染曾是傀儡湖水體污染的主要原因,其中大量使用農藥、氮肥導致的面源污染是湖泊水源地的主要污染源[14].自上世紀九十年代開始,昆山市從傀儡湖的功能定位出發,提出“點面源控制、上下游結合”的一體化水污染控制策略,湖泊管理模式由資源利用管理過渡到資源保護管理.在這些控制對策的作用下,在這些控制對策的作用下,傀儡湖總氮、總磷濃度得到有效控制,但富營養化響應指標葉綠素a的濃度不降反升,這說明傀儡湖的生態環境安全仍存在很大風險[15].
1.2 樣品采集和處理
本研究根據傀儡湖出入湖、不同水深、植被覆蓋及取水口等關鍵點,選取10個具有代表性的采樣點來覆蓋整個湖區面積(圖1).樣品采集分別于2011年7月和2016年7月完成.2011年采集樣品通過流動培養用于傀儡湖沉積物基本參數的調查及沉積物-水界面營養鹽通量的計算,具有培養方法詳見徐徽等[16],在預培養完成后,采集培養系統的進出水樣經孔徑 0.2μm 醋酸纖維濾膜過濾后測定溶解性無機氮含量,用于沉積物-水界面無機氮通量的計算;2016年數據用于潛在反硝化和DNRA過程的研究.所取表層沉積物樣品(0~10cm) 密封在無菌自封袋中,并在 4℃下保存,用10L聚乙烯桶來采集現場水樣,用于室內培養實驗.
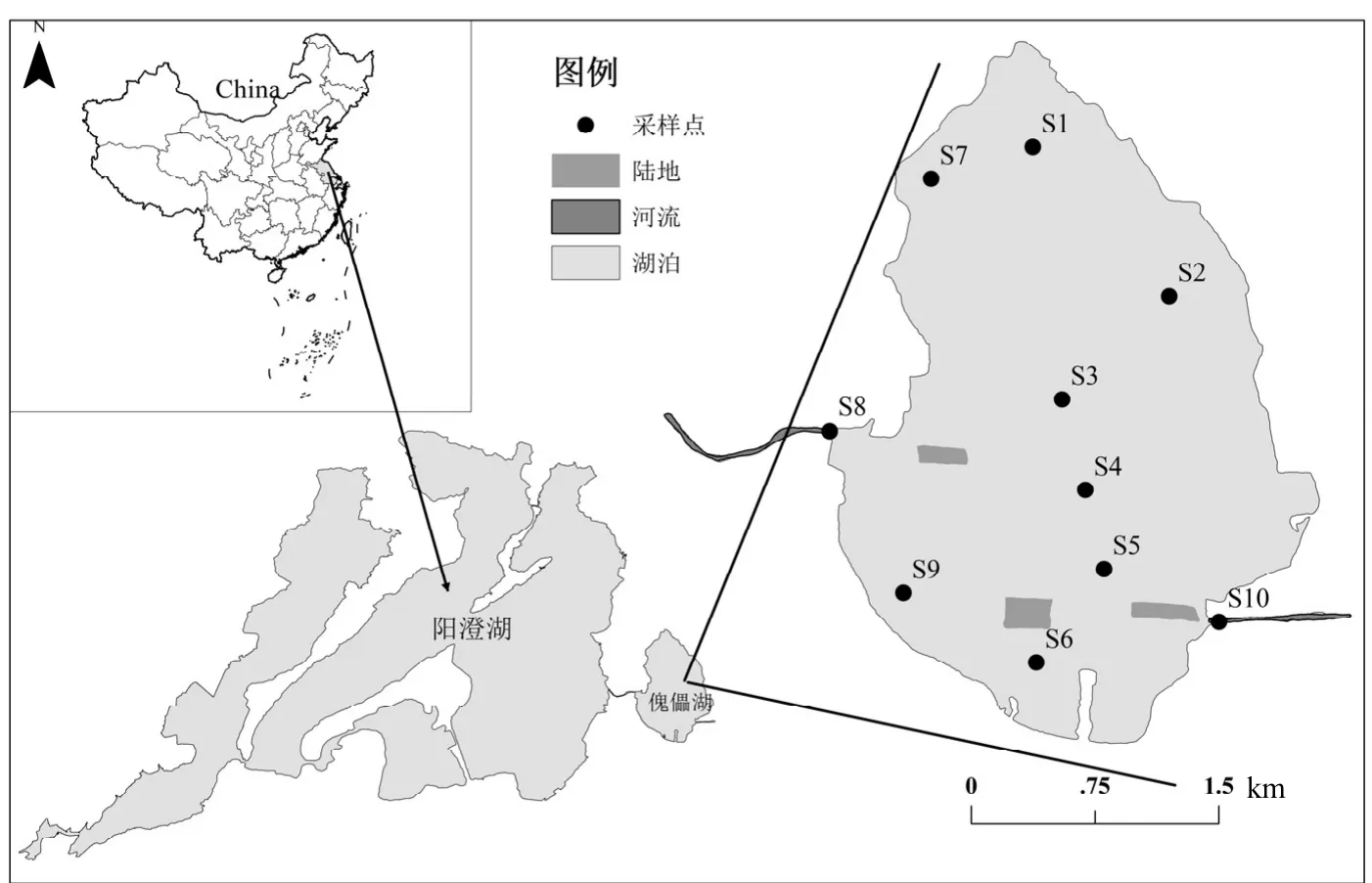
圖1 傀儡湖采樣點分布Fig.1 Location of the sampling sites in Lake Kuilei
1.3 室內培養實驗
將采集好的樣品帶回實驗室,用氬氣吹掃自封袋中采集到的沉積物,并攪拌均勻,同時將采集回來的現場水樣用氬氣吹掃30min以達到去除水樣中溶解的同位素氣體(29N2、30N2)的目的.將每個點位已均質化的沉積物30g與300mL現場采集來的經過凈化的水樣充分混合形成泥漿,并在氬氣吹掃下將泥漿凈化20min.混合后的泥漿被分裝到8個12mL的labco氣密瓶中,確保瓶中無氣體殘留后用帶橡膠墊的瓶蓋封緊,以防止大氣中的氣體對其產生污染.首先進行 24h的預培養以消耗泥漿中殘留的硝酸鹽、亞硝酸鹽以及氧氣[9].預培養完成后,在每個labco瓶中注入15NO3-(最終濃度約為100μmol/L).每個點位取其中的2個labco瓶注入0.1mL的飽和ZnCl2溶液作為初始樣品,剩下的泥漿在200r/min的搖床上培養10h分別用于反硝化過程和DNRA過程的測定分析.培養完成后,在剩下的泥漿樣品中也分別加入 0.1mL的飽和ZnCl2溶液以結束反應過程.其中的3個樣品待泥漿沉降后用于反硝化過程的測定,剩下的 3個樣品再次經過氬氣吹掃30min以去除培養過程中由于反硝化過程或/和厭氧氨氧化過程產生的29N2和30N2,曝氣后立即密封瓶蓋并加入 0.2mL的氧化劑(次溴酸鹽碘溶液),于 4℃保存用于后續DNRA過程的測定分析[17].
潛在反硝化速率由膜接口質譜儀(MIMS)通過測定始末樣品之間反硝化過程產生的溶解性氣體含量差值經同位素配對法計算得到.DNRA速率采用的是氨氧化技術與膜接口質譜儀結合的方法(OX/MIMS)通過測定15NH4+-N濃度計算得到,即在培養實驗完成后在泥漿樣品中注入的氧化劑(次溴酸鹽碘溶液)將 NH4+-N氧化為 N2,再用膜接口質譜儀(MIMS)測定水樣中溶解的氣體(28N2,29N2,30N2)含量,根據29N2、30N2含量計算出DNRA過程產生的15NH4+-N濃度,進而得到DNRA的反應速率[18].
1.4 沉積物特征分析
表層沉積物樣烘干碾磨過篩,用過硫酸鉀法測定TN、TP,用燒失法測定有機物含量(LOI).沉積物含水率的測定方法是將預先稱量好的濕泥在80℃的烘箱烘烤至恒重,再計算沉積物中的含水率.SOD是通過MIMS測定培養前和培養完成時泥漿中的氧氣含量得到的[19].
1.5 營養鹽通量計算方法
2011年的流動培養實驗中,NH4+-N、NO3--N、NO2--N在沉積物-水界面的通量計算公式為[20]:
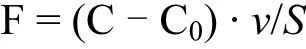
總溶解態無機氮(DIN)通量為:
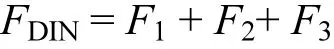
式中:F1、F2、F3分別為通 量,μmol/(m2·h);FDIN是 總 溶 解 態 無 機 氮 通量,μmol/(m2·h);C、C0是流動培養進出水中營養鹽濃度,μmol/L;v為蠕動泵流速,mL/min;S為柱樣中沉積物-水界面面積,m2.
1.6 反硝化、DNRA速率計算方法
本研究假設培養過程中的反硝化是完全的脫氮反應,最終產物中不存在29N2O和30N2O[21];參與反硝化反應的14NO3-和15NO3-在生成 N2時,14N和15N的結合是隨機的,即同位素分子量的差異不會對反應的隨機性產生影響[22].
N2的釋放速率(r29,r30)[20]:
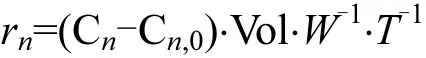
式中:rn為氮 氣(r29,r30)釋 放 速 率,μmol/(kg·h);Cn,0、Cn分別為培養開始前及培養后labco瓶中的氮氣含量,μmol/L;Vol是培養瓶的體積,L;W是沉積物干泥的質量, kg;T是培養時間, h.
由29N2(r29),30N2(r30)的產生速率可計算出
15NO3--N的反硝化速率(DDNF)[23]:
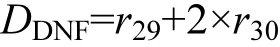
DNRA速率公式為[17]:
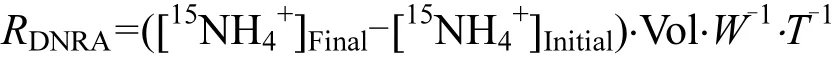
式中:RDNRA是總的潛在反硝化速率(μmol15N/(kg·h)),[15NH4+]Initial和[15NH4+]Final分別是泥漿樣品中15NH4+的初始和最終濃度(μmol/L),其他各項參數與上式相同.
1.7 統計分析
單因素方差分析(ANOVA)用于差異性分析,變量之間的關系用Pearson相關性檢驗進行分析,所有的數據統計采用SPSS22.0,數據顯著性分析的置信區間均為 95%.采樣點的繪制使用 Arcgis 10.3.1,營養鹽通量、反硝化、DNRA 及 DNRA在硝酸鹽異養還原中的比例圖用origin 9繪制.
2 結果與討論
2.1 沉積物理化參數
各采樣點沉積物理化參數如表1所示.沉積物 TN、TP的濃度變化范圍分別為 0.67~2.57mg/g,0.26~0.70mg/g,均值分別為 1.54mg/g,0.51mg/g.TN,TP最大值均出現在傀儡湖出湖河道口附近的 S10.沉積物含水率的變化范圍為35.02%~67.57%,位于 S7處(67.57%)的最大值約是S6處(35.02%)的2倍.燒失量最低值出現在S6,其值為 2.00%,最高值出現在陽澄湖引水河道口處的 S8,其值為 12.80%.燒失量可間接表明底泥的有機質含量,S8處(12.80%)的燒失量遠高于其他點位的平均值(3.84%),說明陽澄湖來水中含有豐富的有機質.沉積物需氧量(sediment oxygen demand, SOD)變化范圍為 12.80~41.72gO2/(m2·d),均值為23.40gO2/(m2·d),最大值位于 S8,與有機質含量最大處出現在相同位置說明此處微生物代謝活性高,生物活動豐富.
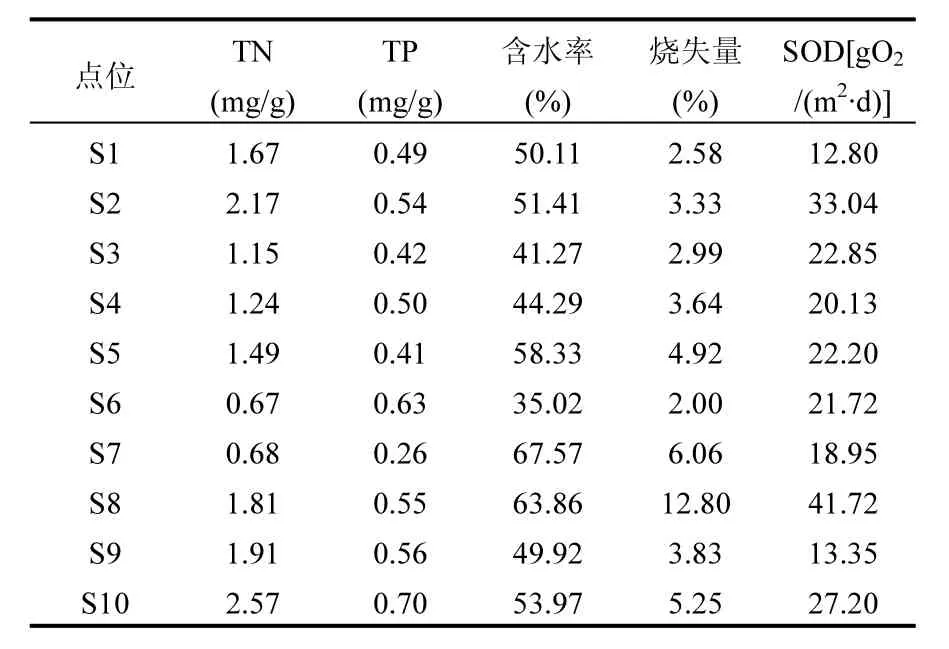
表1 傀儡湖沉積物理化參數Table 1 Physiochemical characteristics of the sediments in Lake Kuilei
2.2 沉積物-水界面營養鹽通量
沉積物-水界面 NH4+-N 凈通量在 40.60~277.98μmol/(m2·h)范圍內(圖 2),均值為 158.06±85.52μmol/(m2·h),不同點位之間存在較大差異性.10個采樣點處的沉積物均表現為NH4+-N的源,即表示NH4+-N從沉積物中釋放到上覆水體,其中 NH4+-N凈通量的最大值出現在湖泊西北部的S2點,最小值在湖中心的S4點.NO3--N凈通量具有與 NH4+-N凈通量相反的傳遞方向,10個點位的沉積物均為 NO3--N 的匯,變化范圍為 :-53.55~-11.09μmol/(m2·h),均 值 為 -31.30±13.26μmol/(m2·h),僅為 NH4+-N 通量的 19.8%.NO2--N凈通量與NO3--N通量具有相同的傳遞方向,沉積物都為水體中的匯,但是NO2--N凈通量遠小于NO3--N凈通量,其平均通量僅為-4.49±2.53μmol/(m2·h).總溶解性無機氮通量在 0.13~233.03μmol/(m2·h)范圍內,最小值出現在 S4,最大值在 S3,具有很大的空間異質性.10個點位沉積物均為 DIN的源,這是因為NH4+-N凈通量在DIN中占據主導作用,NO2--N凈通量與 NO3--N通量都遠小于NH4+-N通量,對 DIN的貢獻率較小.沉積物中大量的 NH4+-N進入水體中,在水體中較高溶解氧的環境條件下,易促進硝化過程的發生,導致 NO3--N、NO2--N的大量生成,NO3--N、NO2--N通過擴散作用進入沉積物,成為硝酸鹽在厭氧沉積物中異養還原過程的反應底物.這與研究結果表明的沉積物-水界面處的NH4+-N通量、NO3--N通量轉移方向是一致的.
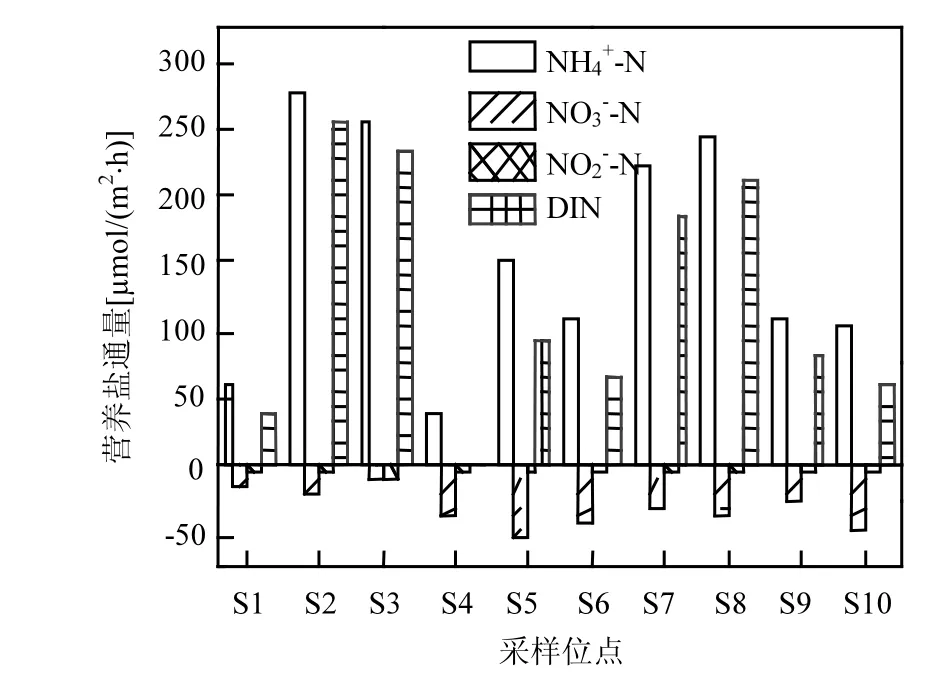
圖2 各采樣點沉積物-水界面營養鹽通量Fig.2 Nutrient fluxes across the sediment-water interface of all sampling sites
2.3 反硝化速率
傀儡湖潛在反硝化速率是利用添加的15NO3-而發生的反硝化量 DDNF,其最大值出現在S8 處(54.00±9.69μmol/(kg·h))均值±標準偏差,下同),最小值在 S6處(18.88±1.31μmol/(kg·h)) (圖3),均值為 36.39±3.86μmol/(kg·h).采樣點之間的反硝化速率存在顯著的空間差異性(one-way ANOVA,n=30,P=0.000).研究區域的反硝化速率與含水率和燒失量存在極顯著相關性(P<0.01),但是與TN,TP之間的相關性不顯著(表2).一般來說,反硝化速率和有機質之間存在顯著的正相關關系,這表明研究區域的反硝化過程主要是由微生物分解有機質驅動的,有機質作為電子供體參與反硝化過程,因此導致有機質含量不同的區域反硝化速率也明顯不同[9-10].反硝化與沉積物含水率之間的顯著相關關系(r=0.885,P<0.01)是由于沉積物中的含水量可能會阻止氧氣在其中的擴散,給微生物提供一個有利于脫氮的厭氧環境,因此隨著沉積物含水率的增加,反硝化速率也相應的增加[11,24].

圖3 傀儡湖沉積物反硝化速率Fig.3 DNF rates in the sediments of Lake Kuilei

表2 硝酸鹽異養還原(反硝化和DNRA)與沉積物理化參數的相關關系Table 2 Correlation analyses between dissimilatory nitrate reduction (DNF and DNRA) tares and physiochemical characteristics of sediments
2.4 DNRA速率
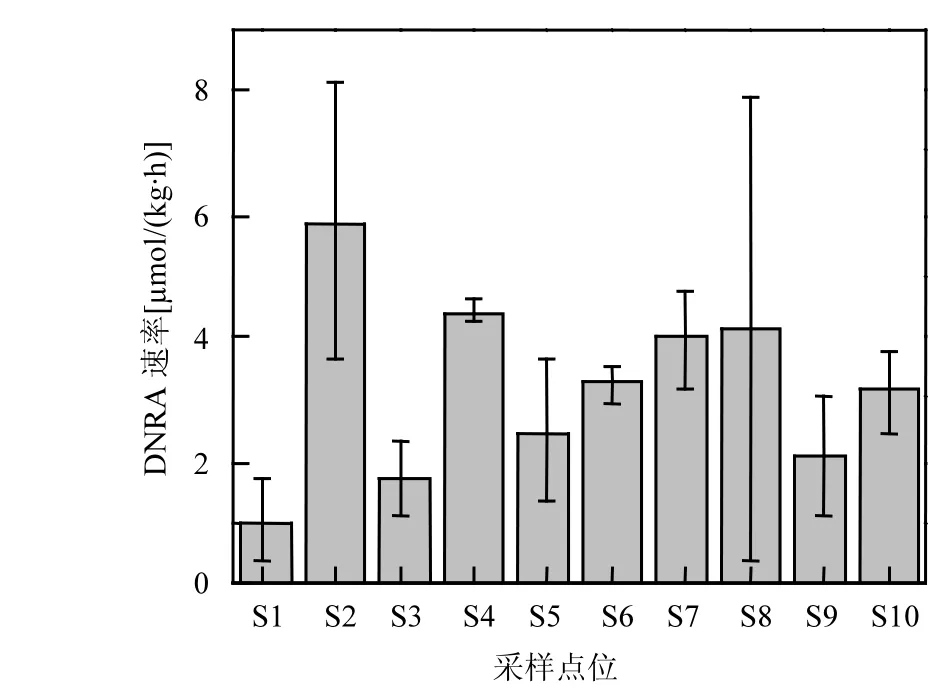
圖4 傀儡湖沉積物DNRA速率Fig.4 DNRA rates in the sediments of Lake Kuilei
潛在DNRA速率變化范圍在1.02~ 5.88μmol/(kg·h)之間(圖 4),均值為 3.21±1.15μmol/(kg·h).由單因素方差分析可知,在整個傀儡湖研究區域,各樣點之間的 DNRA速率沒有顯著的差異性(n=30,P>0.05).最高的DNRA速率位于S2,最低的在S1.DNRA過程可分別由以有機碳為電子供體的異養生物(發酵型的 DNRA)和以硝酸鹽氧化硫化氫及其他還原性的無機底物的化能自養生物催化進行[23].之前的研究報道稱由 DNRA產生NH4+的過程與沉積物中有機碳的含量存在相關關系,并且可能是高濃度的有機碳及氮限制的條件下硝酸鹽異養還原的主導過程[23].進行相關分析發現,本研究中 DNRA過程與沉積物中有機碳含量之間沒有顯著的相關關系(r=0.290,P>0.05),說明有機碳不是本研究的限制因子,夏季沉積物中硝酸鹽的限制可能是影響 DNRA過程的重要因素.沉積物耗氧量(SOD)表征的是沉積物對氧氣的消耗情況,SOD越大,說明沉積物的還原性越強[24].還原性越強的沉積物越有利于DNRA過程的發生.由表2可知,DNRA速率與SOD之間存在正相關關系(r=0.624, P=0.054).還有研究表明,DNRA過程也會促進SOD的產生和增長:當沉積物中由DNRA過程產生的NH4+釋放到上覆水中時,會促進浮游植物生產力的提高,浮游植物的死亡降解進一步導致額外的有機質進入沉積物,從而誘導SOD的增長[26].
2.5 不同類型濕地的反硝化和DNRA過程
反硝化和DNRA過程在硝酸鹽異養還原過程中發揮不同的作用:反硝化可以去除水生生態系統中的硝酸鹽,結束硝酸鹽在水生生態系統中的循環過程,是濕地生態系統脫氮過程,反應生態系統的自凈能力[22];而 DNRA過程是將硝酸鹽還原為氨氮,以無機氮的形式繼續存在于生態系統中.相比較于硝態氮,氨氮更易被浮游植物所利用,所以 DNRA過程是一種氮素內循環過程,甚至會加重濕地污染狀況[27].因此,這兩個過程之間的相互競爭強度決定水生生態系統中硝酸鹽異養還原過程的轉化方式與最終歸趨.本研究中,反硝化是傀儡湖沉積物中硝酸鹽異養還原的主導途徑,占總的硝酸鹽損失(DNF+DNRA)的 84.23%~ 96.90%.與反硝化過程相比,DNRA過程發揮較小的作用,只占總的硝酸鹽損失的3.10%~15.77% (圖5).
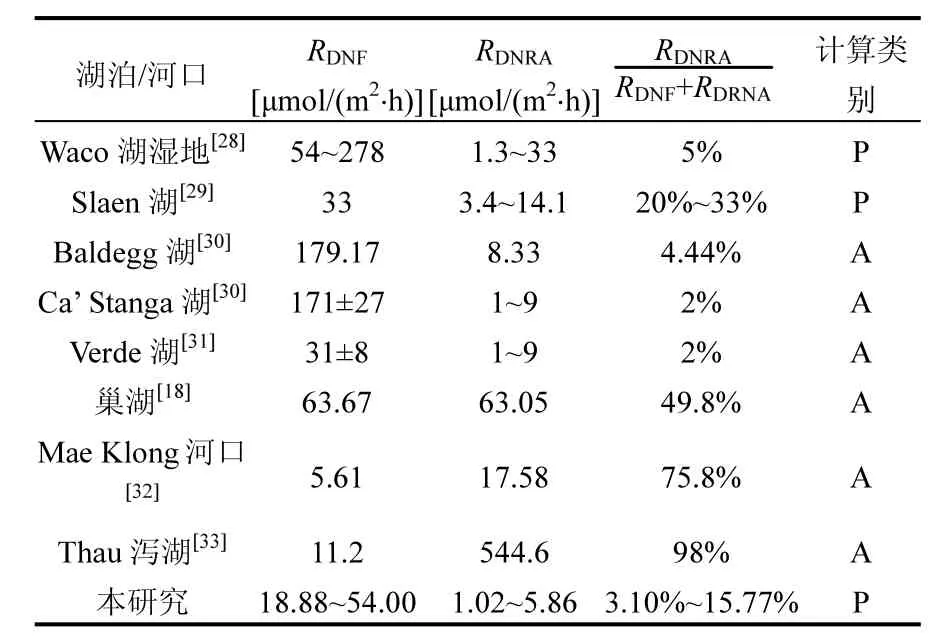
表3 傀儡湖及其他的湖泊、河口濕地反硝化、DNRA速率及DNRA在硝酸鹽異養還原過程中所占的比重Table 3 DNF and DNRA rates and the contribution of DNRA to total dissimilatory nitrate reduction in Lake Kuilei and some other lake and estuarine ecosystems
與其他地區的湖泊濕地相比,本研究中的反硝化速率、DNRA速率及DNRA在硝酸鹽異養還原過程中所占的比重在文獻報道的范圍內(表3).但是淡水湖泊中的DNRA速率在總的硝酸鹽異養還原過程中所占的比重大部分都小于 50%,說明淡水湖泊中的硝酸鹽異養還原過程還是以反硝化作用占據主導地位.文獻報道海洋河口濕地沉積物的DNRA速率可達總的硝酸鹽還原速率的 75%[32],甚至達 98%[33],遠遠高于淡水湖泊中DNRA速率所占的比重,這可能與海洋河口處硫化物濃度較高有關.Howarth報道海水中硫酸鹽濃度約為 25~28mmol/L[34],遠遠高于淡水湖泊(其中太湖水體硫酸鹽濃度為 1mmol/L)[35].此外,海洋河口處的鹽度高于湖泊等淡水生態系統,在這樣的鹽度條件下,硫酸鹽還原是主要的有機物降解過程,孔隙水中硫化物(硫酸鹽還原產物)的濃度可能在低氧條件下增加,而高的硫化物濃度可能通過對硝化細菌的毒害作用抑制硝化過程的發生,從而導致可利用硝酸鹽濃度的降低;同時,由于硫化物對反硝化細菌具有抑制作用且可充當電子供體參與DNRA過程,致使沉積物中的硝酸鹽可能會被 DNRA過程而非反硝化過程利用[35].最終使得 DNRA速率遠大于反硝化速率.這與湖泊生態系統中較低的硫化物濃度具有很大差異,所以淡水生態系統中的DNRA速率會遠小于反硝化速率.
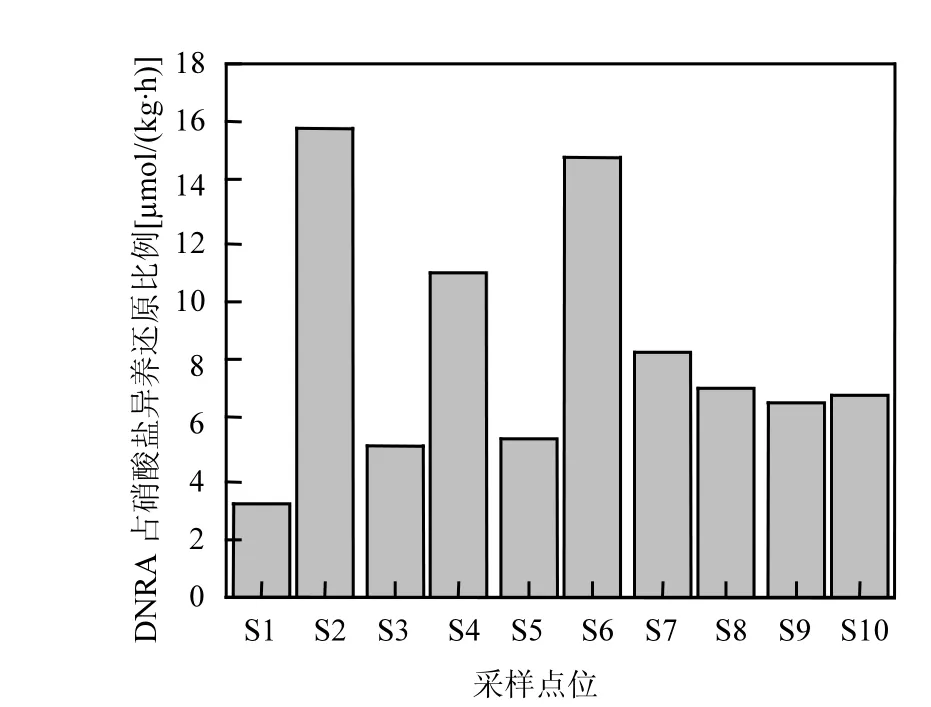
圖5 DNRA占沉積物中硝酸鹽異養還原(DNF+DNRA)的比例Fig.5 Contribution of DNRA to total dissimilatory nitrate reduction (DNF+DNRA) in the sediments of Lake Kuilei
3 結論
3.1 傀儡湖10個采樣點沉積物-水界面處的營養鹽通量具有較大的差異性.10個采樣點沉積物均為NH4+-N凈通量的源,NO3--N和NO2--N凈通量的匯.由于NH4+-N凈通量遠大于NO3--N和NO2--N凈通量,所以沉積物為總溶解性無機氮(DIN)的源.
3.2 傀儡湖硝酸鹽異養還原過程中潛在的反硝化速率為 18.89~54.00μmol/(kg·h),均值為 36.39±3.86μmol/(kg·h);潛在 DNRA 速率為 1.02~5.88μmol/(kg·h),均值為 3.21±1.15μmol/(kg·h).
3.3 研究區域的反硝化速率與沉積物中的燒失量和含水率存在的正相關關系;DNRA與沉積物耗氧量(SOD)之間存在相關性.
3.4 反硝化是傀儡湖中硝酸鹽異養還原的主導過程,占硝酸鹽異養還原過程(DNF+DNRA)的84.23%~96.90%;DNRA 所占比重為 3.10%~15.77%.與海洋河口區域相比,淡水湖泊生態系統中DNRA速率和DNRA在硝酸鹽異養還原中所占的比重均較小.
[1]Karthic I, Brugam R B, Retzlaff W, et al. The impact of nitrogen contamination and river modification on a Mississippi River floodplain lake [J]. Science of the Total Environment, 2013,463:734-742.
[2]Bu H, Meng W, Zhang Y. Nitrogen pollution and source identification in the Haicheng River basin in Northeast China [J].Science of the Total Environment, 2011,409(18):3394-3402.
[3]王秋娟,李永峰,姜 霞,等.太湖北部三個湖區各形態氮的空間分布特征 [J]. 中國環境科學, 2010,30(11):1537-1542.
[4]Di Z, Zhang H, Shan B. Using sedimentary phosphorus/nitrogen as indicators of shallow lake eutrophication: concentrations or accumulation fluxes [J]. Environmental Earth Sciences, 2015,74(5):3935-3944.
[5]Howarth R W, Marino R. Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems: Evolving views over three decades [J]. Limnology & Oceanography, 2006,51(1):364-376.
[6]Giblin A E, Tobias C R, Song B, et al. The importance of dissimilatory nitrate reduction to ammonium (DNRA) in the nitrogen cycle of coastal ecosystems [J]. Oceanography, 2013,26(3):124-131.
[7]Figueiredo Souza V, Santoro A L, van Weerelt M, et al. Sediment denitrification, DNRA and anammox rates in tropical floodplain lake (Pantanal, Brazil) [J]. Oecologia Australis, 2013,16(4):734-744.
[8]Saunders D L, Kalff J. Denitrification rates in the sediments of Lake Memphremagog, Canada—USA [J]. Water Research, 2001,35(8):1897-1904.
[9]Deng F, Hou L, Liu M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2015,120(8):1521-1531.
[10]Song G D, Liu S M, Marchant H, et al. Anaerobic ammonium oxidation, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment [J]. Biogeosciences,2013,10(11):6851-6864.
[11]Garcia-Ruiz R, Pattinson S N, Whitton B A. Denitrification in river sediments: relationship between process rate and properties of water and sediment [J]. Freshwater Biology, 1998,39(3):467-476.
[12]胡曉婷,程 呂,林賢彪,等.沉積物硝酸鹽異化還原過程的溫度敏感性與影響因素--以長江口青草沙水庫為例 [J]. 中國環境科學, 2016,36(9):2624-2632.
[13]McCarthy M J, Lavrentyev P J, Yang L, et al. Nitrogen dynamics and microbial food web structure during a summer cyanobacterial bloom in a subtropical, shallow, well-mixed, eutrophic lake (Lake Taihu, China)[J]. Hydrobiologia, 2007,581(1):195-207.
[14]張 偉.昆山傀儡湖水污染控制對策 [J]. 污染防治技術,2003,S1:150-154.
[15]陳小華,李小平,程 曦,等.太湖流域典型中小型湖泊富營養化演變分析(1991~2010年) [J]. 湖泊科學, 2013,25(6):846-53.
[16]徐 徽,張 路,商景閣,等.太湖梅梁灣水土界面反硝化和厭氧氨氧化 [J]. 湖泊科學, 2009,21(6):775-781.
[17]Yin G, Hou L, Liu M, et al. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems [J]. Environmental Science &Technology, 2014,48(16):9555-9562.
[18]姜星宇,姚曉龍,徐會顯,等.長江中下游典型濕地沉積物-水界面硝酸鹽異養還原過程 [J]. 湖泊科學, 2016,28(6):1283-92.
[19]Bernard R J, Mortazavi B, Kleinhuizen A A. Dissimilatory nitrate reduction to ammonium (DNRA) seasonally dominates NO3?reduction pathways in an anthropogenically impacted sub-tropical coastal lagoon [J]. Biogeochemistry, 2015,125(1):47-64.
[20]Kunu T M, Sullivan M B, Cornwell J C, et al. Denitrification in estuarine sediments determined by membrane inlet mass spectrometry [J]. Limnology and Oceanography, 1998,43(2):334-339.
[21]Crowe S A, Canfield D E, Mucci A, et al. Anammox,denitrification and fixed-nitrogen removal in sediments from the Lower St. Lawrence Estuary [J]. Biogeosciences, 2012,9(11):4309.
[22]Risgaard‐Petersen N, Nielsen L P, Rysgaard S, et al. Application of the isotope pairing technique in sediments where anammox and denitrification coexist [J]. Limnology and Oceanography:Methods, 2003,1(1):63-73.
[23]Steingruber S M, Friedrich J, G?chter R, et al. Measurement of denitrification in sediments with the 15N isotope pairing technique [J]. Applied and Environmental Microbiology, 2001,67(9):3771-3778.
[24]Weier K L, Doran J W, Power J F, et al. Denitrification and the dinitrogen/nitrous oxide ratio as affected by soil water, available carbon, and nitrate [J]. Soil Science Society of America Journal,1993,57(1):66-72.
[25]Laverman A M, Canavan R W, Slomp C P, et al. Potential nitrate removal in a coastal freshwater sediment (Haringvliet Lake, The Netherlands) and response to salinization [J]. Water Research,2007,41(14):3061-3068.
[26]Dunn R J K, Welsh D T, Jordan M A, et al. Benthic metabolism and nitrogen dynamics in a sub-tropical coastal lagoon:microphytobenthos stimulate nitrification and nitrate reduction through photosynthetic oxygen evolution [J]. Estuarine, Coastal and Shelf Science, 2012,113:272-282.
[27]Dong L F, Sobey M N, Smith C J, et al. Dissimilatory reduction of nitrate to ammonium, not denitrification or anammox,dominates benthic nitrate reduction in tropical estuaries [J].Limnology and Oceanography, 2011,56(1):279-291.
[28]Scott J T, McCarthy M J, Gardner W S, et al. Denitrification,dissimilatory nitrate reduction to ammonium, and nitrogen fixation along a nitrate concentration gradient in a created freshwater wetland [J]. Biogeochemistry, 2008,87(1):99-111.
[29]Gruca-Rokosz R, Tomaszek J A, Koszelnik P. Competitiveness of dissimilatory nitrate reduction processes in bottom sediment of Rzeszów reservoir [J]. Environ. Protect. Eng., 2009,35:5-13.
[30]Pelegrí S P, Blackburn T H. Nitrogen cycling in lake sediments bioturbated by Chironomus plumosus larvae, under different degrees of oxygenation [J]. Hydrobiologia, 1996,325(3):231-238.
[31]Nizzoli D, Carraro E, Nigro V, et al. Effect of organic enrichment and thermal regime on denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in hypolimnetic sediments of two lowland lakes [J]. Water Research, 2010,44(9):2715-2724.
[32]Gilbert F, Souchu P, Bianchi M, et al. Influence of shellfish farming activities on nitrification, nitrate reduction to ammonium and denitrification at the water-sediment interface of the Thau lagoon, France [J]. Marine Ecology Progress Series, 1997:143-153.
[33]Hietanen S, Kuparinen J. Seasonal and short-term variation in denitrification and anammox at a coastal station on the Gulf of Finland, Baltic Sea [J]. Hydrobiologia, 2008,596(1):67-77.
[34]Howarth R. Microbial processes in salt-marsh sediments [J].Aquatic microbiology, 1993:239-260.
[35]Tao Y, Yuan Z, Wu F, et al. Six-Decade Change in Water Chemistry of Large Freshwater Lake Taihu, China [J].Environmental Science & Technology, 2013,47(16):9093-9101.
[36]An S M, Gardner W S. Dissimilatory nitrate reduction to ammonium (DNRA) as a nitrogen link, versus denitrification as a sink in a shallow estuary (Laguna Madre/Baffin Bay, Texas) [J].Marine Ecology Progress, 2002,237(1499):41-50.

