壬基酚對羊角月牙藻的毒性效應研究
劉偉杰 ,吳孝情,鄢佳英,何 寧,陳 琪,段舜山* (.暨南大學,水生生物研究中心,廣東 廣州 506;.環境保護部華南環境科學研究所,廣東 廣州 50655;.宜春學院,生命科學與資源環境學院,江西 宜春 6000)
烷基酚聚氧乙烯醚(APEOs)是目前全球第二大類非離子表面活性劑,常用于洗滌劑、紡織、造紙、醫藥和化妝品行業中[1].APEOs產品中80%是壬基酚聚氧乙烯醚(NPEO),在廢水處理廠中NPEO被分解為壬基酚(NP),最終排放到江河、湖泊、海洋等水域生態系統中[2].而壬基酚具有極強的穩定性和抗降解能力,使其在水域生態系統中能夠長期殘留[3].最近的十幾年中,在我國不同地區不同水域壬基酚均被頻繁檢出. 如青島膠州灣水域表面水和固體懸浮物中的存在量為20.2~269ng/L 和 17.2~77.5ng/L[4];黃河蘭州河段水體中壬基酚含量為 34.2~599ng/L[5];珠江入海口處水域水體中壬基酚含量為 233.04~3352.86ng/L[6].隨著壬基酚的廣泛應用其對水域生態系統的威脅有可能日趨嚴重[7-8].
壬基酚是公認的內分泌干擾物,能夠模擬天然雌激素與雌激素受體相互作用,干擾水生動物的內分泌系統,對生殖系統具有明顯負效應[9].唐思等[10]的研究表明 NP對多刺裸腹溞(Moina Macrocopa)可產生毒性增強的代際效應,對其生長繁殖產生嚴重干擾;孫凱峰[11]研究指出壬基酚對枝角類浮游動物具有很強的毒性效應,而微藻對壬基酚具有高富集效應;此外,壬基酚對魚類的生長發育、求偶行為[12]、性腺發育[13]及相關激素調控基因的表達都有不良影響[14];何寧等[15]認為NP集生物毒性、內分泌干擾性、存在持久性和生物積累性于一體,對水域生態系統和人類健康具有嚴重威脅.NP進入水體后必將對浮游藻類產生影響,同時由于藻類對于污染物具有富集作用[16],能夠將環境中殘留的NP進行濃縮,經攝食行為進入食物網中各營養級生物體內產生不良效應.
浮游植物在水域生態系統中具有十分重要的地位和作用,作為水域生態系統的初級生產者,其種類的多樣性和初級生產力會直接影響到整個系統的結構功能及健康水平,常作為研究不同水體中污染物毒性效應的指示生物[17].然而,關于壬基酚(NP)對于浮游藻類的毒性效應方面的報道并不充足.Correa-Reyes等[18]報道了 NP對海洋微藻,球等鞭金藻 (Isochrysis galbana)的毒性效應,發現NP濃度在1mg/L時能夠完全抑制其光合效應;而 Gao等[19]研究發現,普通小球藻(Chlorella vulgaris)對 NP具有較高的耐受性,在經受1mg/L處理時,整個抗氧化酶系均處于激活狀態,含量及活性大幅升高,而四尾柵藻(Scenedesmus quadricauda)則表現為抑制效應.羊角月牙藻(Selenastrum capricornutum)是淡水水體中常見綠藻,對污染脅迫十分敏感,因此成為水生生態毒理研究的模式生物(ISO 8692-1989)[20].目前關于 NP暴露于羊角月牙藻的相關報道,只有 Gao等[21]曾在研究中指出羊角月牙藻在 NP暴露下過氧化氫酶(CAT)和還原型谷胱甘肽(GSH)的活性先升高后降低,最大光能轉化效率(Fv/Fm)逐漸下降,熱耗散(DI0/RC)小幅度上升.然而 NP暴露下,羊角月牙藻光系統各參數的響應方面的了解仍不夠全面.因此本研究選取羊角月牙藻作為受試對象,了解其在 NP暴露處理下的生長情況、光合色素含量、抗氧化系統的響應情況,并通過熒光誘導動力學參數指標,進一步探討壬基酚(NP)暴露對浮游植物的毒害效應及影響.以期為進一步了解 NP對浮游藻類的作用特點提供實驗依據和研究基礎,并為 NP在水域生態系統中的風險評估提供補充.
1 材料與方法
1.1 實驗材料
壬基酚(Nonyphonel,NP)為分析純,純度>99%,購自 Sigma公司,配置高濃度母液所用的助溶劑為丙酮(廣州化學試劑廠).
受試藻種羊角月牙藻(Selenastrum capricornutum)為暨南大學水生生物研究中心藻種室提供.藻種于玻璃三角瓶中置于人工氣候光照培養箱中靜置培養,培養溫度(23±1)℃,光照強度 80μmol/(m2·s),光暗周期 12h:12h,每日定期搖晃三角瓶 3次,并隨機改變三角瓶位置.實驗周期開始前,經過兩周時間對藻種活化及擴大培養,選取處于對數生長期的羊角月牙藻用于實驗.
1.2 生長實驗設計
BG11培養基經高壓蒸汽滅菌冷卻后,分裝于 150mL玻璃三角瓶中,每瓶 100mL.選取對數生長期羊角月牙藻(S.capricornutum)進行接種,初始接種濃度為1.5×105cells/mL.NP的工作液由儲備液由培養基稀釋得到,根據預實驗設置濃度梯度分別為:0.1,0.3,0.6,0.9,1.2mg/L.每個處理(含對照組)設置3個平行重復,助溶劑丙酮添加量不高于0.1%.加入稀釋液混勻后置于原培養條件下96h,每 24h取樣,通過細胞計數繪制生長曲線并計算比生長速率(μ)[22].
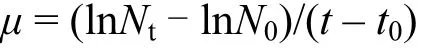
比生長速率(μ)以羊角月牙藻細胞數均值為基礎數據,按照下面公式進行計算:式中:Nt和N0分別為t(24h、48h、72h、96h)時刻和 t0(初始接種)時的藻細胞數.在比生長率速率基礎上,采用概率單位-濃度對數法繪制曲線,根據線性回歸方程計算 96h的半數抑制濃度(EC50).
1.3 葉綠素測定
測定不同濃度處理下NP暴露對羊角月牙藻葉綠體色素含量的影響[23].取 10mL暴露處理96h后的羊角月牙藻藻液,經高速冷凍離心機4℃,5000g離心15min,棄上清液,加入5mL抽提液(丙酮:乙醇=1:1),震蕩搖勻之后,4℃黑暗靜置24h后,同條件離心 15min,取上清液,用紫外-可見光分光光度計測定440nm,645nm,663nm波長下上清液的吸光值,以抽提液作為空白對照,參照以下公式計算葉綠素a(chl a),葉綠素b(chl b)和類胡蘿卜素(Car)含量(mg/L)[24]:
葉綠素a(chl a)=12.7OD663—2.69OD645
葉綠素b(chl b)= 22.9OD645—4.68OD663
類胡蘿卜素(Car)=4.7OD440—0.27(chl a+chl b)
1.4 葉綠素熒光誘導動力學參數的響應研究
取 2mL藻液轉移至專用測量小瓶,于暗箱中暗適應 30min后,利用植物效率儀(Handy PEA, Hansatech,英國)在室溫下進行測定葉綠素熒光誘導動力學參數,由 3000μmol/(m2·s)的連續光誘導,熒光信號記錄從 10μs開始,至 2s結束[23].葉綠素熒光動力學相關參數的意義及計算公式如表1.

表1 快速葉綠素熒光誘導動力學參數Table 1 Parameters in the analysis of the O-J-I-P fluorescence transient
1.5 抗氧化酶活性的測定
超氧化物歧化酶(SOD)活性、過氧化氫酶(CAT)活性、丙二醛(MDA)含量以及可溶性蛋白含量用南京建成公司相應的試劑盒進行測定.
1.6 統計分析
實驗數據采用 Origin 8.0整理并制圖,統計分析采用SPSS 13.0,單因素方差分析(One way -ANOVA)中的多重比較(Duncan)來檢驗各組之間差異的顯著性,P<0.05為顯著性差異.
2 結果與討論
2.1 NP暴露對羊角月牙藻生長的影響
如表2所示,壬基酚對羊角月牙藻96h EC50為 0.979mg/L,根據標準及相關文獻報道,其風險指數(RI)>1,屬于高毒性污染物[25].壬基酚暴露脅迫處理下,對羊角月牙藻的生長影響如圖1所示.初始的 24h暴露時期,壬基酚暴露對羊角月牙藻生長表現為抑制效應,處理組的藻細胞數較對照下降了27.3%~47.2%;48h暴露后,0.1mg/L處理組細胞密度略高于對照組(上升 4.1%),表現出一定程度的毒物興奮效應,其他濃度(≥0.3mg/L)壬基酚處理組的羊角月牙藻則表現為抑制效應,藻細胞數較對照下降了14.2%~44.2%;經過72h和96h暴露處理后,除最低處理組外,其他濃度(≥0.3mg/L)壬基酚處理組的羊角月牙藻則始終表現為抑制效應,藻細胞數較對照組相比,分別下降了5.8%~35.3%和 8.9%~49.1%.由以上結果可見,壬基酚可影響羊角月牙藻細胞增殖,抑制種群的增長,具有潛在風險.

表2 NP暴露處理對羊角月牙藻96h EC50Table 2 96h acute toxicity of NP on Selenastrum capricornutum
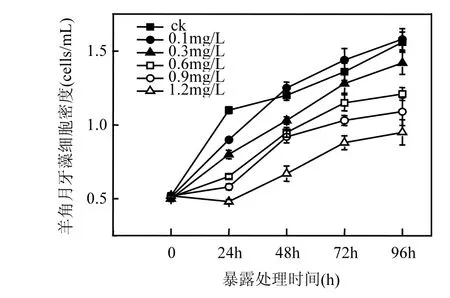
圖1 羊角月牙藻生長對NP暴露處理的響應Fig.1 Growth response of S.capricornutum to NP treatments
雖然關于NP對微藻產生不良效應相關報道并不十分完善,但可以確定微藻對毒性物質有高度的種類特異性響應[21].研究結果表明斜生柵藻(Scenedesmus obliquus)、四尾柵藻 (Scenedesmus quadricauda)、蛋白核小球藻(Chlorella pyrenoidosa)、肥壯蹄形藻(Kirchneriella obesa)和月牙藻(Pseudokirchneriella subcapitata)等淡水種類綠藻的 96h EC50在 0.82 — 3.33mg/L[11],而中肋骨條藻(Skeletonema costatum)和旋鏈角毛藻(Chaetoceros curvisetus)的 96h EC50僅為0.13mg/L和 0.22mg/L[26],微小小環藻(Cyclotella caspia)的 96h-EC50也僅有 0.18mg/L[27].雖然 NP在環境中的檢出濃度一般在“μg/L”級以下水平,而對微藻產生產生干擾效應的濃度在 100μg/L以上[18],造成急性毒性的濃度在 0.13~3.33mg/L,但是微藻對于環境中NP具有很強的富集積累能力, 能夠在短時間內將環境中殘留的“μg/L”級以下水平的進行 NP濃縮.研究表明球等鞭金藻(Isochrysis galbana)[18]、蛋白核小球藻 (Chlorella pyrenoidosa)[20]和團集剛毛藻(Cladophora glomerata)[2]對 NP的富集系數(BCF)分別為6940,7393和10000,這意味著實際作用于微藻細胞的NP濃度已經遠高出最低效應濃度(LOEC),并將通過食物鏈逐級傳遞放大,進入高營養級生物甚至人類體內,產生不良效應.
2.2 NP暴露脅迫下羊角月牙藻的光合色素變化
如圖 2所示,NP暴露處理能夠影響羊角月牙藻體內光合色素含量,與對照組相比,NP暴露處理在0.1mg/L時,可誘導葉綠素a(chl a)和葉綠素b(chl b)含量下降7.1%和25.8%,類胡蘿卜素(Car)含量上升16%,其中chl b和Car變化程度顯著;隨著NP處理濃度的上升,0.3mg/L處理組葉綠素含量進一步下降,chl a下降18.8%,chl b下降35.5%,Car含量再次顯著升高 26.5%,當處理濃度達到0.6mg/L時,羊角月牙藻葉綠素a(chl a)的含量也出現了明顯降低,降低程度為22.3%,此時Car含量又一次表現出顯著升高,較對照增加了 4倍以上;處理濃度增至 0.9mg/L時,chl a含量再次顯著下降(31.3%),Car含量高于對照組4.5倍,由此可知,NP暴露處理對于羊角月牙藻的光合色素有著不良影響,能夠造成主要光合色素(葉綠素)含量下降,輔助色素(類胡蘿卜素)含量上升,說明這種脅迫對其光合作用性能已產生脅迫效應.

圖2 不同濃度NP暴露脅迫下羊角月牙藻葉綠素a、葉綠素b和類胡蘿卜素的含量Fig.2 Contents of chl a, chl b and carotenoids of S.capricornutum after exposure in different NP concentrations treatments
2.3 NP脅迫對羊角月牙藻光系統II(PSII)的影響
圖 3顯示 NP可以使最大光能轉化效率(Fv/Fm)顯著下降,在1.2mg/L濃度下,Fv/Fm下降幅度最大,為對照組的 66.7%.這說明羊角月牙藻PSⅡ對NP暴露處理十分敏感,0.1mg/L濃度就可以造成最大光能轉化效率(Fv/Fm)的顯著下降,而 PSⅡ中光能轉化效率受損必將對羊角月牙藻的正常生長增殖產生不良影響.

圖3 不同濃度NP暴露處理下羊角月牙藻的最大光能轉化效率(Fv/Fm)Fig.3 Fv/Fm of S.capricornutum after exposure in different NP concentrations treatments
如圖4所示,0.1mg/L濃度NP處理組參數與對照組相比幾乎無差異;當處理濃度達到0.3mg/L時,ABS/RC(單位反應中心吸收光能)顯著上升,DI0/RC(單位反應中心耗散能量)、ET0/RC(單位反應中心捕獲用于電子傳遞的能量)、TR0/RC(反應中心用于還原 QA 的能量)也隨之升高,整體來看,雖然單位反應中心吸收的光能大幅增加,但是耗散能量和消耗能量也隨之增加,光合效率降低,同時光合性能指數(PI)開始出現顯著下降;隨著處理濃度的升高,羊角月牙藻PSⅡ反應中心活性在 0.6mg/L時達到峰值,反應中心吸收的光能(ABS/RC)值達到最大值,反應中心捕獲電子用于還原QA的能量ET0/RC和用于電子傳遞的能量TR0/RC也相應上升,但PI依舊顯著降低,說明其 PSⅡ反應中心已受到損傷;0.9mg/L濃度處理下,TR0/RC開始出現顯著下降,反應中心用于其他電子受體的能量大幅增加;處理濃度增至1.2mg/L后,DI0/RC出現了顯著升高,這表明以熱能等其他形式進行耗散的反應中心吸收的光能比例大幅度上升.
Correa-Reyes等[18]認為NP降低藻類的光合性能的可能途徑有兩條,一種是改變天線色素(antenna size)即chl a含量降低;另一種則是降低光能吸收效率或降低吸收光能的利用率,使其以熱能等方式耗散.在本研究中,在 NP暴露處理下chl a降低十分明顯,光合色素含量變化顯著,這與諸多報道結果相一致[11,22,29-30].光合色素(主要為chl a)含量下降,能夠減少藻細胞對光能的吸收及利用,光合作用效率降低必將影響到藻類的生長增殖.Fv/Fm(最大光能轉化效率)是衡量光合性能的主要參數,也是直接表現微藻光合作用效率的重要指標[31].本研究中,在NP作用下羊角月牙藻的 Fv/Fm 隨著處理濃度的增加而降低,說明NP能夠降低其光合性能,對其生長產生抑制.三角褐指藻 (Phaeodactylum tricornutum)在NP的脅迫下,光合性能出現顯著下降[22]. Srivastava等[33]認為脅迫誘導下Fv/Fm的下降,是一種光系統在脅迫條件下的短期響應,可能是微藻在光能吸收與利用之間重新構建的平衡關系,以使受到的損傷降到最低.通過葉綠素熒光誘導動力學相關參數,可以進一步了解化學脅迫處理下,藻細胞光系統的響應情況[34].相關研究指出,NP暴露處理小球藻(Chlorella vulgaris),可以引起光能吸收下降,ABS/RC參數降低,并認為這是小球藻(Chlorella vulgaris)在脅迫條件下捕光復合物和光系統活性反應中心之間短期內形成的新的平衡,其研究結果也表明在 96h處理后,小球藻(Chlorella vulgaris)的各項測試指標已恢復到正常水平[32].而在本研究中,羊角月牙藻在NP處理后,ABS/RC參數顯著上升,表明系統吸收的光能開始增加,但是光合性能(PI)并未出現顯著增高,反而在高濃度NP處理下顯著降低,同時DI0/RC表現出明顯增加,熱能等形式耗散的能量上升,這一點也正說明在 NP脅迫下,羊角月牙藻的捕光復合物與光系統活性反應中心的連通性受損,造成吸收的光能并不能有效的進行利用.王晶晶[29]的文獻報道中也對此現象表示相同的觀點,同時指出雖然JIP測試能夠相對全面的了解NP脅迫下微藻細胞光系統性能參數,但是由于光合作用的復雜性,污染物對微藻的毒性效應具體進程仍需要更深層次的研究.

圖4 NP處理后羊角月牙藻的各JIP-測定參數的響應變化Fig.4 Changes of each selected JIP-test parameters in S.capricornutum after exposure in different NP concentrations treatments
2.4 NP暴露脅迫下羊角月牙藻膜的脂過氧化
NP處理脅迫下,會引起藻細胞膜系統的損傷,造成細胞膜脂過氧化,甚至破壞膜系統的完整性.丙二醛(MDA)是膜脂過氧化的產物之一,其含量可以說明藻細胞膜脂過氧化的程度[13].如圖 5所示,NP暴露脅迫誘導羊角月牙藻MDA含量增高,當處理濃度為0.3mg/L,MDA含量增加到對照組的 2倍,達到顯著水平,當處理濃度增至0.9mg/L和1.2mg/L時,MDA含量再次顯著增加,分別達到對照組的3倍和5倍.這表明壬基酚濃度與藻細胞膜脂過氧化程度成正比,濃度越高膜質損傷程度越強,膜系統完整性受到破壞.

圖5 NP處理脅迫后羊角月牙藻的丙二醛含量Fig.5 Contents of MDA in S.capricornutum after exposure in different NP concentrations treatments
2.5 NP脅迫下羊角月牙藻SOD與CAT的響應
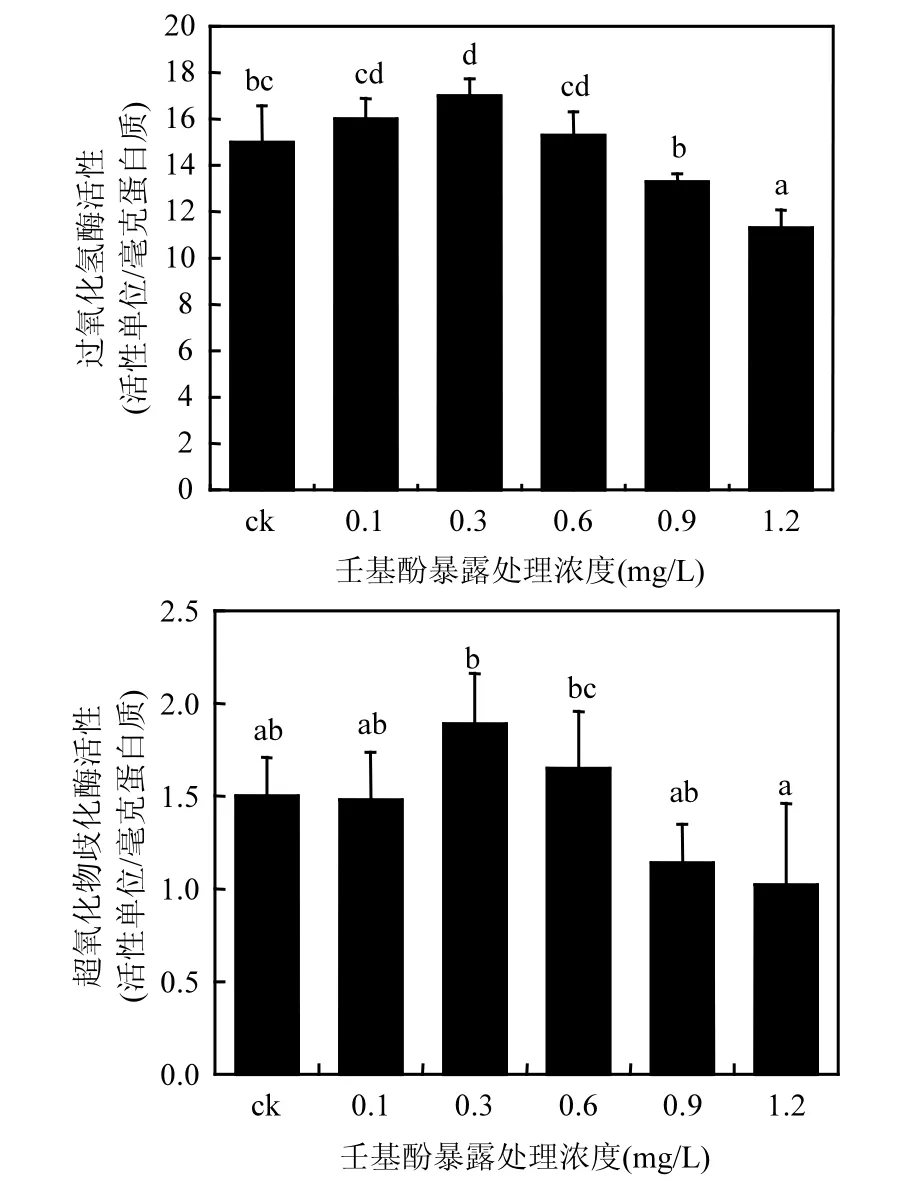
圖6 NP對羊角月牙藻CAT和SOD活性的影響Fig.6 Effects of NP on activities of CAT and SOD in S.capricornutum after exposure in different NP concentrations treatments
如圖6所示,NP對羊角月牙藻細胞超氧化物歧化酶(SOD)和過氧化氫酶(CAT)的活性效應.NP濃度在0.3mg/L和0.5mg/L時,羊角月牙藻的SOD酶活性上升了26% 和10%,誘導刺激效應十分明顯,隨著處理濃度的升高,在高濃度(≥0.9mg/L)下,SOD 酶活性開始降低;濃度增至1.2mg/L時,SOD明顯下降為對照組活性的68%.CAT變化趨勢與SOD基本相同,活性隨NP處理濃度的增加其活性先升高后降低.在0.1mg/L時,CAT活性較對照組升高了 6.7%,在0.3mg/L時,活性增加達到顯著程度,增長到對照組的 113%,而后隨著處理濃度的增加活性開始降低,在0.9mg/L時活性顯著下降,降低至對照組活性的88.7%,處理濃度增至1.12mg/L,降低程度到達對照組的75.3%,顯著性進一步增加.綜上,羊角月牙藻體內SOD和CAT對NP暴露處理表現出低濃度處理活性上升,高濃度脅迫活性降低的整體趨勢,相較而言,SOD活性波動程度較 CAT的活性變化更加劇烈.
一般來說,當藻細胞受到化學脅迫時,其葉綠體和線粒體中的電子傳遞狀態會發生改變,胞內的能量體系將形成一個暫時的新的平衡狀態,在這個過程中將會產生對細胞造成氧化脅迫的活性氧(ROS),例如超氧化物、過氧化氫和超氧自由基等[34].針對這些活性氧物質,微藻自身的抗氧化系統能夠啟動一系列抗氧化酶對其進行清除,以維持細胞正常的代謝和生長增殖[37].在活性氧物質的氧化脅迫下,藻細胞生物膜中的不飽和脂肪酸將形成脂質過氧化產物,丙二醛(MDA),其含量的高低可以大體反映膜質過氧化損傷的程度[35].本研究結果中,MDA的含量隨著 NP處理濃度的增加而升高,說明羊角月牙藻細胞膜系統在NP脅迫下受到了損傷.目前來說,關于微藻體內抗氧化系統的研究表明,污染物脅迫下,CAT和SOD等抗氧化酶的活性會受到誘導激活,并表現出酶活性先增強后減弱的趨勢[36].在本研究中,兩者的活性也表現出隨著NP處理濃度升高而先激發后抑制的顯著趨勢.Wang[37]研究NP的毒性效應時,也得到了一致的結果,并指出,當低劑量的毒性物質刺激藻細胞產生額外的活性氧物質,以此為底物的SOD瞬時受到誘導而活性迅速增加對其進行猝滅,而當毒性物質劑量上升到其催化閾值,甚至超過最大催化能力時,過量的活性氧將破壞酶結構,表現出活性下降.CAT在催化處理過氧化氫時也表現出同樣的趨勢.這同時也能夠說明 MDA含量在中高劑量表現出顯著差異的原因:中高劑量的 NP脅迫產生的活性氧接近或超過抗氧化酶系閾值后,無法減少 ROS的積累,造成膜質過氧化程度進一步加深.而不同種類的抗氧化酶系本身的閾值“因藻而異”,因此不同種類的微藻受到同種污染物脅迫時,表現出不同的抗性或敏感性.
3 結論
3.1 壬基酚對羊角月牙藻的生長具有抑制作用,96h EC50為 0.979mg/L,根據標準及相關文獻報道,其風險指數(RI)>1,屬于高毒性污染物,對于水生生物存在潛在威脅.
3.2 壬基酚對羊角月牙藻光合色素的含量及構成具有顯著影響,能夠降低葉綠素含量,增加類胡蘿卜素合成;同時對光系統Ⅱ各參數產生顯著干擾,降低光能轉化效率,能量耗散增加.
3.3 壬基酚暴露處理能夠破壞羊角月牙藻膜系統,并對抗氧化系統產生影響,超氧化物歧化酶(SOD)和過氧化氫酶(CAT)活性表現出隨著處理濃度增加而先升高后下降的趨勢.
綜上,壬基酚暴露處理對羊角月牙藻的生長、光合色素含量、光系統效率以及抗氧化酶生成均具有明顯的干擾作用.
[1]Ying G G, Williams B, Kookana R. Environmental fate of alkylphenols and alkylphenol ethoxylates--a review [J].Environment International, 2002,28(3):215-26.
[2]周自堅,虢清偉,王 麗,等.壬基酚聚氧乙烯醚在印染廢水處理工藝中的去除研究 [J]. 環境工程學報, 2014,8(8):3107-3113.
[3]連 靜,劉俊新. NPEOs及其代謝產物在城市污水處理廠中的歸趨分析 [J]. 環境科學, 2012,33(9):3295-3300.
[4]Fu M, Li Z, Gao H. Distribution characteristics of nonylphenol in Jiaozhou Bay of Qingdao and its adjacent rivers [J]. Chemosphere,2007,69(7):1009-16.
[5]Xu J, Wang P, Guo W, et al. Seasonal and spatial distribution of nonylphenol in Lanzhou Reach of Yellow River in China. [J].Chemosphere, 2006,65(9):1445-1451.
[6]Diao P, Qi C, Rui W, et al. Phenolic endocrine-disrupting compounds in the Pearl River Estuary: Occurrence,bioaccumulation and risk assessment [J]. Science of the Total Environment, 2017,s584—585:1100-1107.
[7]向昆侖.壬基酚、辛基酚、雙酚A在珠江口水生動物體內的積累特征 [D]. 廣州:暨南大學, 2015.
[8]陳慰雙.我國水環境中壬基酚的污染現狀及生態風險評估 [D].青島:中國海洋大學, 2013.
[9]吳天偉,孫 藝,崔 蓉,等.內分泌干擾物壬基酚與辛基酚的污染現狀與毒性的研究進展 [J]. 環境化學, 2017,36(5):951-959.
[10]唐 思,劉偉杰,段舜山.壬基酚對多刺裸腹溞連續世代的毒性效應 [J]. 生態毒理學報, 2016,11(2):275-282.
[11]孫凱峰.環境激素壬基酚對枝角類浮游動物的生殖干擾效應研究 [D]. 廣州:暨南大學, 2012.
[12]夏繼剛,牛翠娟,傅俊華,等.壬基酚對斑馬魚求偶行為的生態毒理效應 [J]. 水生生物學報, 2012,36(6):1142-1148.
[13]夏繼剛,牛翠娟,高 穎,等.壬基酚長期暴露對斑馬魚雄魚第二性征、精子活力的影響 [J]. 生態毒理學報, 2010,5(1):44-49.
[14]劉曉麗,汪 奇,賈林芝,等.壬基酚對斑馬魚精巢組織及性激素合成酶基因表達的影響 [J]. 環境科學學報, 2011,31(11):2523-2529.
[15]何 寧,劉偉杰,孫 東,等.典型環境激素壬基酚對水產品安全性的影響 [J]. 生態科學, 2013,32(5):654-659.
[16]孫凱峰,孫 東,綦世斌,等.壬基酚對浮游生物的毒性效應及其食物鏈傳遞研究 [J]. 中國環境科學, 2016,36(12):3816-3823.
[17]謝 菁,區又君.微藻在水域生態系統中的作用 [J]. 海洋與漁業, 2007,(7):26-28.
[18]Correa-Reyes G, Viana M T, Marquez-Rocha F J, et al.Nonylphenol algal bioaccumulation and its effect through the trophic chain. [J]. Chemosphere, 2007,68(4):662-670.
[19]Gao Q T, Wong Y S, Tam N F Y. Antioxidant responses of different microalgal species to nonylphenol-induced oxidative stress [J]. Journal of Applied Phycology, 2017,29(3):1317-1329.
[20]蘇 甜,李義剛,歐瑞康,等.鎘離子對羊角月牙藻光合作用及其抗氧化酶的毒性影響 [J]. 生態科學, 2014,33(2):301-306.
[21]Gao Q T, Tam N F. Growth, photosynthesis and antioxidant responses of two microalgal species, Chlorella vulgaris and Selenastrum capricornutum, to nonylphenol stress [J].Chemosphere, 2011,82(3):346-54.
[22]李 根,管 超,安 民,等.壬基酚對三角褐指藻的毒性效應及其機理 [J]. 生態科學, 2013,32(3):298-302.
[23]周靜韻,段舜山.全氟辛酸和全氟壬酸對兩種海洋微藻的聯合毒性效應 [J]. 生態科學, 2016,35(6):84-90.
[24]王學奎.植物生理生化實驗原理和技術. [M]. 2版.北京:高等教育出版社, 2006.
[25]劉 娜,金小偉,王業耀,等.我國地表水中藥物與個人護理品污染現狀及其繁殖毒性篩查 [J]. 生態毒理學報, 2015,10(6):1-12.
[26]劉 霞,趙 靜,但麗霞,等.壬基酚對膠州灣典型微藻的毒性效應 [J]. 海洋環境科學, 2012,(5):45-51.
[27]代曉康.壬基酚(NP)對微小小環藻的毒性及其生物降解研究[D]. 廣州:中山大學, 2005.
[28]Ahel M, Mcevoy J, Giger W. Bioaccumulation of the lipophilic metabolites of nonionic surfactants in freshwater organisms [J].Environmental Pollution, 1993,79(3):243.
[29]王晶晶.雙酚 A和壬基酚對青島大扁藻的復合干擾效應研究[D]. 廣州:暨南大學, 2013.
[30]周 峰,劉訓財,厲以強,等.壬基酚脅迫對萊茵衣藻的生理影響[J]. 生態與農村環境學報, 2013,29(1):87-90.
[31]曾曉鵬,夏建榮.光強對兩種硅藻光合作用、碳酸酐酶和RubisCO活性的影響 [J]. 水生生物學報, 2015,39(2):368-374.
[32]姜智飛,竇 勇,張文慧,等.AHLs對小球藻 PSⅡ光化學活性與光合作用關鍵酶的影響研究 [C]//微藻與水族高峰論壇, 2017.
[33]Srivastava A, Guissé B, Greppin H, et al. Regulation of antenna structure and electron transport in Photosystem II of Pisum sativum, under elevated temperature probed by the fast polyphasic chlorophyll a, fluorescence transient: OKJIP [J].Biochimica et biophysica acta. Bioenergetics, 1997,1320(1):95-106.
[34]李 藩,李仁輝,于曉章,等.小麥麩皮水浸提液對銅綠微囊藻(Microcystis aeruginosa)光合色素含量和葉綠素熒光誘導動力學的影響 [J]. 湖泊科學, 2013,25(3):373-377.
[35]陳 花,吳俊林,李曉軍.葉綠體中活性氧的產生和清除機制 [J].現代生物醫學進展, 2008,8(10):1979-1981.
[36]張容芳,唐東山,劉 飛.藻類抗氧化系統及其對逆境脅迫的響應 [J]. 環境科學與管理, 2011,36(12):21-25.
[37]Wang J, Xie P, Guo N. Effects of nonylphenol on the growth and microcystin production of Microcystis strains [J]. Environmental Research, 2007,103(1):70-78.

