腹腔鏡胃旁路術后血清瘦素、脂聯素變化與胰島素抵抗的關系
郭曉博,韓 輝,苗 山,張 冶,劉昕偉,高宏凱
腹腔鏡Roux-en-Y胃旁路術(laparoscopic Roux-en-Y,LRYGB)對肥胖癥和2型糖尿病(type 2 diabetes mellitus,T2DM)有確切的治療作用[1,2],手術的降糖機制與胰島素抵抗的改善有關,但具體機制尚未完全清楚,該研究方向也是目前代謝外科的研究重點。體內脂肪組織異常蓄積是肥胖相關疾病的病理本質,也是T2DM的獨立危險因素[3,4]。研究表明,脂肪組織是一個高度活躍的內分泌組織和重要的代謝組織,分泌瘦素、脂聯素等脂肪因子,而瘦素、脂聯素通路是調控胰島素抵抗的主要代謝途徑[5,6]。肥胖狀態下,脂肪因子代謝紊亂,造成了胰島素抵抗,導致T2DM的發生和發展[7-9]。因此,提出假設:LRYGB術后有助于減輕體內脂肪組織的蓄積,重建瘦素、脂聯素的代謝平衡,是胰島素抵抗緩解的機制。本研究選取肥胖癥伴T2DM患者,實施LRYGB,觀察術后血清瘦素、脂聯素水平變化,探討術后胰島素抵抗改善與血清瘦素、脂聯素變化的關系,為臨床診治提供依據。
1 對象與方法
1.1 對象 回顧性分析2011-03至2012-02武警總醫院普通外科行腹腔鏡胃旁路手術的肥胖癥伴T2DM患者的臨床資料。納入標準及排除標準均參照《中國肥胖和T2DM外科治療指南(2014)》[10]。納入標準:(1)BMI 28~35 kg/m2的T2DM經生活方式和藥物治療難以控制血糖且至少符合額外的2個代謝綜合征組分或存在合并癥;(2)BMI 30~34.9 kg/m2T2DM經生活方式和藥物治療難以控制血糖,尤其具有心血管風險因素時,均建議積極考慮代謝手術治療;(3)患者手術治療均得到我院倫理委員會的同意,術前行風險評估,告知術中、術后可能發生的情況,患者及家屬簽署麻醉、手術知情同意書。排除標準:(1)全身狀況差,難以耐受手術的患者;(2)胰島B細胞功能已基本喪失,C肽水平低下或糖負荷下C肽釋放曲線低平的T2DM患者;(3)妊娠糖尿病及某些特殊類型糖尿病。符合要求共入選52例,平均年齡(43.5±11.9)歲,平均 BMI 28~35 kg/m2。52例中有16例口服降糖藥物治療,15例應用胰島素治療,12例口服藥物+胰島素聯合治療,9例未經系統治療。建立患者檔案資料,做好術后隨訪工作,登記入檔,患者基本情況(表1)。

表1 52例2型糖尿病患者術前基本資料 (n)
1.2 方法 (1)術前準備:優化術前血糖,包括健康飲食方案、體育活動、藥物治療;糖化血紅蛋白降至6.5%~7.0%,血糖水平控制在8 mmol左右,尿糖(-),尿酮體(-)[10]。(2)LRYGB手術方法:建立氣腹,臍部穿刺孔置入30° 腹腔鏡,分別于兩側鎖骨中線、腋前線的相應位置放置5 mm和10 mm Trocar共4個,于劍突下左側置入肝葉拉鉤,超聲刀直視下游離胃大彎和胃小彎,腹腔鏡下直線切割閉合器離斷胃底,保留大小約為原胃10%的近端胃小囊,辨別Treitz韌帶。在距Treitz韌帶以遠100 cm處切斷空腸,將近端胃與遠段空腸斷端行結腸前端側吻合,再將近段空腸斷端與遠端小腸在距胃腸吻合口以遠100~150 cm處行側側吻合,以此重建消化道。(3)術后給予抗生素預防感染、常規營養支持、補充液體維持電解質平衡。
1.3 評價指標 術前、術后1、3、6、12個月檢測血清瘦素、脂聯素(均采用ELISA檢測法)、HbA1c、TG、CH和BMI ,并行OGTT和胰島素釋放試驗。
1.4 療效評價 糖尿病治愈標準參照文獻[11]。(1) 顯效:FPG<7 mmol/L,2 h PG<10 mmol/L,HbA1c<7%,無需使用降糖藥物;(2) 好轉:FPG、2 h PG值較術前下降50%;或HbA1c下降值≥1%;或減少50%降糖藥物使用劑量;或可停用胰島素,僅用口服降糖藥即可維持血糖達標;(3) 未愈:FPG無變化或下降值<50%,或HbA1c下降值<1%,需增加糖尿病藥物種類,需增加藥物劑量。肥胖癥治愈標準參照國際生命科學學會中國肥胖問題工作組定義肥胖癥診斷標準,選擇BMI<25 kg/m2作為肥胖癥治愈標準。
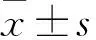
2 結 果
2.1 術后一般情況 52例均成功完成手術,無中轉開腹,術中出血量為(25.0±11.1)ml,手術時間為(78±14)min。術后無吻合口出血、梗阻,吻合口漏等手術并發癥。2例女性患者術后出現胃腸功能紊亂,經非手術治療后痊愈,住院時間為(11±2)d。術后隨訪12個月,無失訪病例。
2.2 人體測量學變化 術后隨訪12個月,肥胖者治愈率67.3%。與術前BMI(31.8±2.3)kg/m2比較,術后6個月最低,與術前比較,術后不同時間點均有統計學意義(P<0.05)。術前腰臀比(0.96±0.06),逐漸下降至術后6個月(0.89±0.05),與術前比較,術后3、6、9個月比較均差異有統計學意義(P<0.05,表2)。
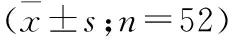
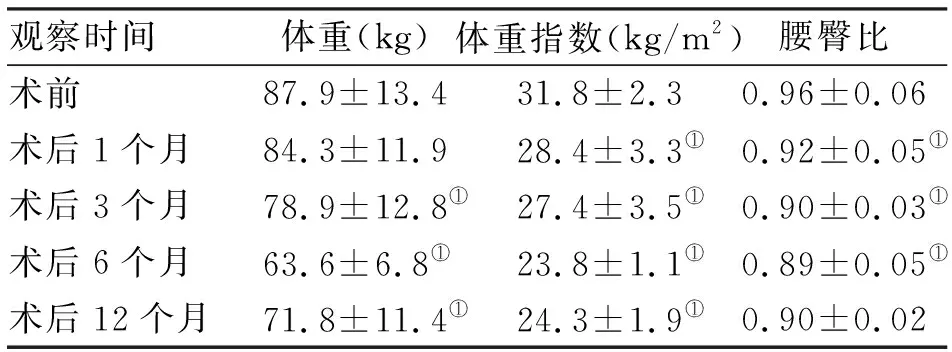
觀察時間體重(kg)體重指數(kg/m2)腰臀比術前87.9±13.431.8±2.30.96±0.06術后1個月84.3±11.928.4±3.3①0.92±0.05①術后3個月78.9±12.8①27.4±3.5①0.90±0.03①術后6個月63.6±6.8①23.8±1.1①0.89±0.05①術后12個月71.8±11.4①24.3±1.9①0.90±0.02
注:與術前相比,①P<0.05
2.3 血脂變化 與術前TG值(3.50±1.46) mmol/L相比,術后12個月TG值(1.14±0.38) mmol/L 下降明顯,差異有統計學意義(P<0.05);術后CH值呈逐漸下降趨勢,術后12個月CH值與術前CH(5.14±1.18)mmol/L相比,差異有統計學意義(P<0.05,表3)。
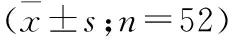

觀察時間TG(mmol/L)CH(mmol/L)術前3.50±1.465.14±1.18術后1個月2.71±1.08①4.51±0.98①術后3個月1.69±0.40①4.03±1.23①術后6個月1.72±0.71①3.70±0.88①術后12個月1.14±0.38①4.01±0.49①
注:與術前相比,①P<0.05
2.4 糖代謝及胰島素功能變化 術后12個月的血糖,達標率為86.5%。 與術前FPG值相比,術后逐漸下降,術后6個月最低,與術前相比術后各時間點均明顯下降,差異有統計學意義;與術前HbA1c相比,術后12個月差異有統計學意義(P<0.05)。與術前2 hPG相比,術后各時間點均有所降低,差異有統計學意義(P<0.05,表4)。與術前FIns值相比,術后呈逐漸下降趨勢,術后12個月達到最低,差異有統計學意義; HOMA-IR與術前相比,術后12個月HOMA-IR下降,差異有統計學意義(P<0.05,表4)。
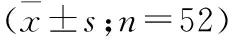
觀察時間FPG(mmol/L)2hPG(mmol/L)HbA1c(%)FIns(pmol/L)HOMA-IR(FP×FINS/22.5)術前10.00±3.518.62±4.88.0±1.524.8±9.810.25±5.01術后1個月7.82±1.9114.31±5.0①6.7±0.9①15.9±5.9①8.57±5.63術后3個月7.63±2.26①11.41±4.4①6.7±1.0①12.7±4.5①6.74±7.26術后6個月6.08±0.84①10.17±2.8①7.1±1.410.1±2.7①2.07±2.68術后12個月6.48±0.50①10.45±3.2①6.5±0.9①6.9±2.0①2.64±0.98①
注:與術前相比,①P<0.05
2.5 瘦素及血清脂聯素變化 與術前空腹瘦素[(20.60±4.30)ng/ml]相比,術后空腹瘦素值明顯下降至術后12個月[ (5.63±2.91)ng/ml,P=0.005]。與術前空腹脂聯素水平[(4.34±2.63) μg/ml]相比,術后空腹脂聯素水平下降至術后3個月[(2.94±1.18)μg/ml],而后升高至術后12個月[(7.37±2.81)μg/ml,P=0.028]。
3 討 論
脂肪細胞分泌多種具有生物活性的脂肪因子,參與調節葡萄糖代謝、胰島素及能量代謝[9]。減重術后體重減輕的核心是脂肪細胞總量的減少。本研究發現,LRYGB術后12個月隨訪期內患者BMI明顯下降,同時TG及CH明顯改善,表明在體重下降的同時脂肪細胞功能也發生了明顯改變。BMI、腰臀比、FPG及2 hPG 等統計數據在術后6個月最低,術后12個月稍有上升,考慮與術后進食,殘余胃囊的擴大有關,需進一步加強糖尿病飲食教育,引導健康正確的生活方式[12]。
瘦素是來源于脂肪組織的蛋白質激素, 具有抑制食欲、減少能量攝入、提高機體代謝率、減少脂肪堆積的生物學作用。肥胖癥患者脂肪堆積,脂肪細胞分泌增多,外周血液瘦素水平升高 ,但由于中樞傳導信號受阻,導致生理劑量的瘦素產生低于正常的生理效應,即瘦素抵抗[13]。一方面高水平瘦素通過促進脂肪細胞的分解,使游離脂肪酸濃度升高而干擾肌肉對胰島素的敏感性。另一方面,瘦素能削弱胰島素的生物效應,即胰島素抵抗的發生。脂聯素是一種脂源性的血漿蛋白,對胰島素具有正向調節作用,高脂聯素水平有助于增強胰島素敏感性、拮抗胰島素抵抗[14]。肥胖狀態下,患者脂肪容量增大而脂聯素血漿濃度反而下降,拮抗胰島素抵抗作用減弱,胰島素敏感性降低。本研究發現,LRYGB術后瘦素的表達與IR變化呈同向趨勢,而脂聯素的表達變化與IR呈反向趨勢。
病理狀態下,脂肪因子代謝紊亂主要表現是瘦素抵抗和脂聯素表達的下調。這也是胰島素抵抗的病理機制。手術重建了脂肪因子的穩態:瘦素抵抗減輕,脂聯素表達上調。其改善IR的可能機制是,瘦素抵抗減輕,中樞瘦素受體對瘦素的敏感性增強,食欲減退、促進脂肪分解、增加能量代謝,促進肝臟、骨骼肌對葡萄糖的攝取,同時對胰腺的控制減弱,對胰島β細胞作用減少[15],直接促進胰腺合成和分泌胰島素,而胰島素作用是促進血脂的降低,導致胰島素抵抗的減輕。脂聯素水平升高,抑制肝糖原的輸出作用增強,同時增加機體攝取與氧化脂質,加強骨骼肌細胞內脂肪酸轉運和氧化,導致脂肪燃燒及能量的釋放增加,同時促進脂質向脂肪細胞聚集,使肝臟骨骼肌免受脂質浸潤,從而降低血脂水平,增強肝臟和骨骼肌的胰島素敏感性,抑制胰島素抵抗。
綜上所述,肥胖癥、T2DM患者均普遍存在脂聯素水平降低和瘦素抵抗。LRYGB術后血清脂聯素水平的升高及瘦素抵抗的降低,重建瘦素和脂聯素的代謝平衡,改善了胰島素抵抗,從而達到改善血糖水平的目的。因此,LRYGB對肥胖癥伴T2DM患者有確切的治療作用,脂聯素升高及瘦素抵抗的改善是手術治療糖尿病的機制之一。
【參考文獻】
[1] Fried M, Ribaric G, Buchwald J N,etal. Metabolic surgery for the treatment of type 2 diabetes in patients with BMI<35 kg/m2:an integrative review of early studies[J]. Obes Surg, 2010,20(6):776-790.
[2] Proczko M M, Stefaniak T, Kaska L,etal. Early resuilt of roux-en-Y gastric by-pass on regulation of diabetes type 2 in patients with BMI above and below 35kg/m2[J]. Pol praegl Chir, 2011, 83(2): 81-86.
[3] Enriori P J , Evans A E , Sinnayah P,etal. Diet-induced obesiyt causes severe but reversible leptin resistance in arcuate melanocortin neurons [J]. Cell Metab, 2007, 5(6):181-194.
[4] Knobler H, Benderly M, Boyko V,etal. Adiponectin and the development of diabetes in patients with coronary artery disease and impaired fasting lucose[J].Eur J Endocrinol, 2006, 154(1): 87-92.
[5] Bettina M, Jeffrey F H, Alex M D,etal. Recombinant human leptin treatment does not improve insulin action in obese subjects with type 2 diabetes[J]. Diabete, 2011, (60): 1474-1477.
[6] 高宏凱,賈元利,吳致委,等.中國超重肥胖與非肥胖2型糖尿病患者胃轉流術后療效與治療作用的隨訪觀察[J].中國糖尿病雜志,2012,20(3):248-253.
[7] Rubino F.Is type 2 diabetes an operable intestinal disease? A provocative yet reasonable hypothesis[J]. Diabetes Care,2008,(31):290-296.
[8] Scherer P E.Adiposetissue:from lipid storage compartment to endocrine organ s[J]. Diabete 2006,55(6):1537-1545.
[9] Mingrone G, Panunzi S, Gaetano A,etal. Bariatric surgery versus conventional medical therapy for type 2 diabetes[J]. NEJM,2012,366(17):1577-1585.
[10] 中國醫師協會外科醫師分會肥胖和糖尿病外科醫師委員會.中國肥胖和2型糖尿病外科治療指南(2014)[J].中國實用外科雜志,2014,34(11):1005-1006.
[11] 中華醫學會糖尿病學分會. 中國2型糖尿病防治指南[M]. 北京:北京大學醫學出版社,2010:26-29.
[12] 郝婉婷,高宏凱. 2型糖尿病伴肥胖患者血糖管理過程中情感體驗的質性研究[J]. 醫學與哲學,2015,36(8B):87-88
[13] German P J, E wisse B, Thaler P J,etal. Leptin deficiency causes insulin resistance induced by uncontrolled diabetes[J]. American Diabetes Association,2010, 59(7): 1626.
[14] Schauer P R, Kashyap SR, Wolski K,etal.Bariatric surgery versus intensive medical therapy in obese patients with diabetes[J].NEJM,2012,366(17):1567-1576.
[15] Qin J,Cui Y,Zhao X,etal.Identification of the shiga toxin-producing escherichia coli 0104:H4 strain responsible for a food poisoning outbreak in Germany by PCR [J]. Clin Microbiol, 2011,49 (9): 3439-3440.

