丹皮酚在肝癌前病變大鼠體內的藥動學研究*
宋藝君 楊史軍 王 湘 張東星 李京濤 蔡大勇 王玥琦Δ
1.陜西中醫藥大學 (陜西 咸陽, 712046) 2.北京中醫藥大學 3.中國醫學科學院藥用植物研究所
丹皮酚(Pae),是從中藥徐長卿(蘿藦科植物徐長卿的干燥根及根莖)和牡丹皮(毛茛科植物牡丹的干燥根皮)中分離得到的生物活性物質。其藥理活性廣泛,具有抗心肌缺血、抗心律失常、抗動脈粥樣硬化、抗高血壓、抗血栓、抗腫瘤、增強免疫力、抗炎等作用[1]。從中藥牡丹皮得到的丹皮酚已經被作為一種重要成分來預防肝癌[2]。丹皮酚對肝癌的防護作用,有關專家分別從體外和體內進行了大量研究,關于其作用機制,也分別從殺傷腫瘤細胞、誘導凋亡,影響腫瘤血管生成等方面進行了探索[3~5]。
肝癌前病變是指在慢性肝病中出現的肝細胞不典型增生、腺瘤樣增生、肝細胞小管狀化生等, 其發展為肝癌的幾率高, 尤其是肝硬化病灶中出現的異型增生病灶和異型增生的細胞[6]。近年來,雖然肝癌的治療取得了一定進展,但臨床療效仍未得到明顯提高[7,8]。肝癌前病變是肝細胞癌變進展中啟動、促進和演變過程的中間階段,它是阻斷癌變的理想靶點。因而阻止或延緩肝癌前病變的發生發展,對于預防肝臟癌癥的發生,具有重要的現實意義。
雌激素硫酸轉移酶(EST)是一種胞質酶,近年來,有學者研究發現EST在肝癌細胞存在陽性表達,比如其在HepG2肝癌細胞的表達[9]等。
本文在前期實驗研究的基礎上[10],建立肝癌前病變大鼠模型,研究丹皮酚在肝癌前病變大鼠病程發展不同階段的藥動學結果的差異,并通過SULTIEI在大鼠肝、腎的表達研究,從藥動學方面論證丹皮酚的藥效優勢,為其臨床用藥提供指導。
1 材料與方法
1.1 儀器 Acquity超高效液相色譜儀、PDA 檢測器(美國Waters公司);AL104-IC電子分析天平(上海梅特勒-托利多儀器有限公司);Olympus Bx53顯微鏡(日本奧林巴斯公司)。
1.2 藥品與試劑 丹皮酚原料藥(批號101021,廣西億康藥業股份有限公司);丹皮酚對照品(批號0708-9704,中國藥品生物制品檢定所);甲醇、乙腈(色譜級,美國Fisher Scientific公司);二乙基亞硝胺(DEN)(批號1000928405,Sigma公司);兔抗大鼠EST多克隆抗體(編碼107232,上海田源生物技術有限公司);即用型SABC免疫組化染色試劑盒(編號SA1022-兔IgG,含生物素化二抗、封閉液及SABC)。
1.3 動物 清潔級Wistar大鼠,雄性,體重(220±20) g,購于北京維通利華實驗動物技術有限公司, 許可證號SCXK(京)2008-0013。
1.4 分組與造模 將72只清潔級大鼠隨機分為高、中、低劑量組,每組又分為d000、d028、d056、d1124小組,每組6只;適應性飼養1周后,模型組大鼠以DEN(0.5 mL/100g)腹腔注射,每周50 mg/kg,連續16周,對照組大鼠給予等體積生理鹽水(d000:給 DEN 0天;d028:給DEN 4周;d056:給DEN 8周;d112:給DEN 16周)。
1.5 給藥與取樣 大鼠于造模16周時,禁食不禁水12 h后,分別灌胃給予高、中、低劑量(259.2、194.4、129.6 mg/kg)丹皮酚。在大鼠清醒狀態下,分別于給藥后0.5、3、5、7、10、20、30、45、60、90、120、180、240、360 min球后靜脈叢取血0.2 mL于含有肝素的EP管中,離心,取血漿;解剖取出肝臟和腎臟,處理后和血漿同置-80 ℃冰箱保存待測。
1.6 藥動學研究 ①色譜條件:Waters高效液相色譜儀,色譜柱為Waters Acquity C18 (100 mm×2.1 mm,1.7μm);流動相:甲醇-水(70∶30);流速:0.3 ml/min;檢測波長:274 nm;柱溫:25 ℃。 ②對照品溶液制備:取丹皮酚對照品2.07 mg,精密稱定,用流動相溶解制成0.207 mg/mL的丹皮酚儲備液,4 ℃冰箱保存備用。③血漿樣品處理:精密吸取25 μl血漿,置EP管內,先加入稀鹽酸2 μl,渦旋10 s,再加入3倍量體積乙酸乙酯萃取,渦旋30 s,12000 r/min離心8 min,取上清液置于另一個EP管,同法再萃取1次,合并2次上清液自然揮發干燥,殘渣用流動相70 μl溶解,渦旋30 s,離心8 min,取上清液55 μl置EP管,-4 ℃冰箱放置30 min,離心8 min,再取上清液40 μl置進樣瓶中,UPLC自動進樣。④藥代動力學分析:樣品直接注入色譜儀中,按照①色譜條件進行檢測,采用標準曲線法計算血藥濃度。對血藥濃度數據用WinNonlin軟件進行房室模型判別,計算最大血藥濃度(Cmax)、達峰時間(Tmax)、總體清除率(CL)、藥時曲線下面積(AUC)、表觀分布容積(V)、平均滯留時間(MRT)等藥動學參數。
1.7 測定大鼠肝、腎組織EST含量 采用免疫組化法(SABC)測定肝、腎中EST含量,嚴格按照試劑盒說明書操作。結果判定:每張切片各隨機選取5張40倍視野的圖片,采用Image Pro Plus 7.0.1軟件,計算陽性面積AP,總面積AT, 總光密度IOD,用[IOD×(AP/AT)3/2/N]公式計算EST水平,取5張照片的均值代表該切片染色情況。
2 結果
2.1 方法學驗證 ①標準曲線制備:在空白血漿中加入適量對照品溶液,分別制成濃度為41.4、20.7、10.35、5.18、2.59、1.29、0.65、0.323 mg/L的含丹皮酚血漿樣品,血漿樣品處理方法處理,進樣分析。以丹皮酚峰面積Y對丹皮酚質量濃度X(mg/L)進行線性回歸,回歸方程Y=17955X+16.721,R2=0.9997。丹皮酚在0.323~41.4 mg/L范圍內線性關系良好。②精密度試驗:按照標準曲線項下操作,分別制備濃度為20.7、5.18、1.29 mg/L的含丹皮酚血漿樣品,按血漿樣品處理方法進行操作,進樣分析。于日內平行處理5份樣品,考察日內精密度;每天各測定5份樣品,連續5天,考察日間精密度。丹皮酚低、中、高濃度日內精密度RSD分別為1.56%、2.38%、2.25%;日間精密度RSD分別為6.45%、1.95%、2.57%。精密度RSD均小于6.45%,符合試驗要求。③穩定性試驗:按照標準曲線項下操作,分別制備丹皮酚濃度為20.7、5.18、1.29 mg/L的標準空白血漿樣本各5份,按血漿樣品處理方法處理,室溫保存,于0、2、4、8、10 h分別進樣分析,記錄丹皮酚峰面積,計算丹皮酚濃度。丹皮酚低、中、高濃度的RSD分別為4.80%、2.18%、3.19%。表明丹皮酚的含藥血漿經過處理后室溫放置10 h,仍可被準確測定。④絕對回收率試驗:取25 μl的空白血漿3份,分別加入3個濃度的丹皮酚對照品溶液10 μl,配置成含丹皮酚20.7、5.18、1.29 mg/L的含藥血漿樣品。按血漿樣品處理方法處理,進樣分析記錄色譜峰面積。每個濃度平行操作5份。以血漿中丹皮酚測得量與加入量之比計算絕對回收率。丹皮酚低、中、高濃度的絕對回收率分別為(89.9±2.3)%、(90.7±6.1)%、(92.1±1.8)%,丹皮酚在血漿中回收率穩定,平均回收率均達89%以上,符合試驗要求。⑤相對回收率試驗:取25 μl的空白血漿3份,分別加入3個濃度的丹皮酚對照品溶液10 μl,配置成含丹皮酚20.7、5.18、1.29 mg/L的含藥血漿樣品,按血漿樣品處理方法處理,得到丹皮酚色譜峰面積A1;用水代替空白血漿,按照上述方法操作,進樣測定,得到丹皮酚色譜峰面積A2。每個濃度平行操作5份,以A1/A2×100%計算相對回收率。低、中、高濃度的相對回收率分別為(90.4±8.1)%、(93.3±2.8)%、(94.2±5.6)%,丹皮酚在血漿中相對回收率穩定,平均回收率均達89%以上,符合試驗要求。
2.2 藥動學結果 丹皮酚高、中、低劑量(259.2、194.4、129.6 mg/kg)大鼠灌胃給藥后各個時間點的平均血藥濃度-時間曲線(AUC)見圖1。丹皮酚在大鼠體內的血藥濃度-時間過程符合非房室模型,藥動學參數見圖1及表1。



圖1 大鼠灌胃不同劑量丹皮酚的平均血藥濃度-時間曲線圖
低劑量組:由d000-d028-d056-d112,AUC、Cmax依次增加,CL、V、MRT依次降低。
中劑量組:由d000-d028-d056-d112,AUC、Cmax依次增加,V、MRT依次降低;由d000-d028-d056,CL降低;由d056-d112,CL增加。
高劑量組:由d000-d028-d056-d112,AUC、Cmax依次增加,CL、V、MRT依次降低。
2.3 各組大鼠肝組織EST蛋白表達 EST蛋白陽性反應定位在肝細胞和內皮細胞胞漿內,呈黃色或棕黃色,見插頁圖2。各組大鼠肝組織均可見EST陽性表達,EST在肝細胞中的表達由d000-d028-d056-d112依次降低,在內皮細胞中的表達由d000-d028-d056-d112依次升高。肝臟EST蛋白相對表達量見表2。
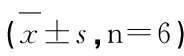
表2 各組大鼠肝組織EST蛋白相對表達量比較
與d000組比較,△P<0.05,▲P<0.01;與d028比較,□P<0.05,■P<0.01;與d056比較,○P<0.05,●P<0.01
2.4 各組大鼠腎組織EST蛋白表達 EST蛋白陽性反應定位在腎組織集合管和遠曲小管的上皮細胞胞漿內,近端小管上皮細胞也有少許,呈黃色或棕黃色,見插頁圖3。各組腎組織均可見EST陽性表達,EST在腎臟集合管和遠曲小管中的表達由d000-d028-d056-d112依次升高。腎臟EST蛋白相對表達量見表3。
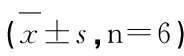
表3 各組大鼠腎組織EST蛋白相對表達量比較
與d000比較,△P<0.05,▲P<0.01;與d028比較,□P<0.05,■P<0.01;與d056比較,●P<0.01

表1 丹皮酚灌胃給藥后的藥代動力學參數
3 討論
藥動學參數是反映藥物在體內動態變化規律的參數,可為臨床制定給藥劑量和給藥間隔提供參考,為毒性試驗設計和毒理效應分析提供依據,而機體在病理狀態下的藥動學參數研究較正常狀態下更有意義。丹皮酚的藥動學結果分析表明,高、中、低劑量之間,劑量與CL、AUC、Cmax、V、MRT有一定的線性關系,說明CL、AUC、Cmax,V、MRT呈劑量依賴性。丹皮酚各劑量組,由d000-d028-d056-d112過程中,Cmax逐漸增大,顯示對丹皮酚的吸收速度依次增加;CL逐漸減小,顯示對丹皮酚的消除速度依次減小;AUC逐漸增大,顯示對丹皮酚的吸收量依次增加;MRT逐漸減小,顯示丹皮酚在體內停留時間依次縮短;V逐漸減小,顯示丹皮酚按照血漿濃度分布時,所需要體液的理論容積逐漸減小。
肝癌是一種無有效預防措施的致命的惡性腫瘤疾病[11,12]。按照肝癌的炎癥發病機理[13~15],在用來預防肝癌的中藥中[16~20],丹皮酚被認為是非常有效的[17]。肝癌前病變是肝癌發生的前期階段,筆者故以大鼠肝癌前病變模型去評價治療肝癌的候選藥物是合理的。由表1可以看出,造模到4周,其藥動學參數和對照組比較變化不大,可能因為此時肝臟還只是發生了肝損傷,沒有器質性病變,對丹皮酚在體內的藥動學影響不大,這和病理結果一致,即第4周大鼠只是變質性炎癥,出現肝水腫,脂肪變性,點狀壞死等;造模到8周,肝臟發生了不可逆病變,部分假小葉開始形成,匯管區淋巴細胞浸潤突出等,屬于纖維化和硬化階段,對丹皮酚藥動學參數有大的影響;造模到16周,丹皮酚藥動學參數的變化趨勢更大,此時屬于肝癌前病變階段(有關病理結果另文發表)。通過實驗,總結出了丹皮酚預防肝癌的兩條新穎的途徑。一是丹皮酚藥動學:在不斷惡化的肝癌前病變大鼠的血漿和組織中,因為排泄減慢和吸收加快,丹皮酚濃度是升高的,尤其是肝腎組織,這樣是為了保持丹皮酚在病變部位更長的治療時間(組織分布研究另文發表);二是雌激素硫酸轉移酶(EST):從肝癌前病變大鼠的免疫組化結果可知,肝臟內皮細胞和腎上皮細胞的EST增加,肝細胞的EST減少。由肝癌前病變大鼠EST細胞定位的變化,我們可以看出丹皮酚預防肝癌的優勢。
(致謝: 感謝中國醫學科學院藥用植物研究所為本實驗開展提供相關儀器設備,感謝趙欣、祖承哲兩位同學在實驗中給予的幫助)
[1] 郭齊,李貽奎,王志國,等.丹皮酚藥理研究進展[J].中醫藥信息, 2009,26(1),20-22.
[2] 孫國平. 抗腫瘤新藥丹皮酚[P].2012.
[3] 陳岳濤,曹蔚,王四旺,等.丹皮酚抗腫瘤作用及其機制研究[J].現代生物醫學進展,2016,12(21):4163-4165.
[4] 孫愛華,陳勁,關恒明,等.丹皮酚對肝癌HepG2 /ADM 細胞株多藥耐藥性的逆轉作用及其機制[J].山東醫藥,2016,56(1):1-4.
[5] 宋藝君,楊史軍,王湘,等.丹皮酚對二乙基亞硝胺誘發大鼠肝癌前病變的預防作用[J].陜西中醫,2015,36(9):1270.
[6] 謝晶日,任公平,李明,等.中醫藥防治肝癌前病變機制研究概況[J].中國醫藥導報,2008,5(8),25-26.
[7] Mohamed El-Shahat, Sabah El-Abd, Mohamed Alkafafy,etal.Potential chemoprevention of diethylnitrosamine-induced hepatocarcinogenesis in rats: Myrrh (Commiphora molmol) vs. turmeric (Curcuma longa)[J]. Acta Histochemica,2012,114:421-428.
[8] Dimitrios Stagos, Gregorios D. Amoutzias, Antonios Matakos,etal. Chemoprevention of liver cancer by plant polyphenols[J]. Food and Chemical Toxicology, 2012, 50:2155-2170.
[9] Dongning He,Teresa W.Wilborn, Josie L.Falany,etal. Repression of CFTR activity in human MMNK-1 cholangiocytes induces sulfotransferase 1E1 expression in co-cultured HepG2 hepatocytes[J]. Biochimica et Biophysica Acta,2008,(1783) : 2391-97.
[10] 宋藝君,劉曉婷,馮麗莉,等.二乙基亞硝胺誘發肝癌前病變大鼠模型的建立[J].世界華人消化雜志,2012,20(27):2562-2569.
[11] Song TJ, Fong Y, Cho SJ,etal. Comparison of hepatocellular carcinoma in American and Asian patients by tissue array analysis[J]. J Surg Oncol, 2012,106: 84-88.
[12] Shimizu M, Sakai H, Moriwaki H. Chemoprevention of hepatocellular carcinoma by acyclic retinoid[J]. Front Biosci,2011,1:759-769.
[13] Tarao K, Ohkawa S, Miyagi Y,etal. Inflammation in background cirrhosis evokes malignant progression in HCC development from HCV-associated liver cirrhosis[J]. Scand J Gastroenterol, 2013, 48: 729-735.
[14] Potikha T, Stoyanov E, Pappo O,etal. Interstrain differences in chronic hepatitis and tumor.development in a murine model of inflammation-mediated hepatocarcinogenesis[J]. Hepatology, 2013, 58:192-204.
[15] Nikolaou K, Sarris M, Talianidis I. Molecular pathways: the complex roles of inflammation pathways in the development and treatment of liver cancer[J]. Clin Cancer Res, 2013,19: 2810-2816.
[16] Xing G, Zhang Z, Liu J,etal. Antitumor effect of extracts from moutan cortex on DLD-1 human colon cancer cells in vitro[J]. Mol Med Rep, 2010,3: 57-61.
[17] Xiao Y, Zhang YH, Sheng YX,etal. LC-MS determination and pharmacokinetic studies of paeonol in rat plasma after administration of different compatibility of Su-Xiao-Xin-Tong prescriptions[J]. Biomed Chromatogr, 2008, 22: 527-756.
[18] Ying Xie , Hua Zhou, Yuen-Fan Wong,etal. Study on the pharmacokinetics and metabolism of paeonol in rats treated with pure paeonol and an herbal preparation containing paeonol by using HPLC-DAD-MS method[J]. J Pharm Biomed Anal,2008, 46: 748-534.
[19] Lu Chen, Dawei Wang, Jie Wu,etal. Identification of multiple constituents in the traditional Chinese medicine formula GuiZhiFuLing-Wan by HPLC-DAD-MS/MS[J]. J Pharm Biomed Anal, 2009, 49: 267-275.
[20] Ji Ye, Xi Zhang, Weixing Dai,etal. Chemical fingerprinting of Liuwei Dihuang Pill and simultaneous determination of its major bioactive constituents by HPLC coupled with multiple detections of DAD, ELSD and ESI-MS[J]. J Pharm Biomed Anal, 2009, 49: 638-645.

