超聲超微細彩色血管成像技術評價經肝動脈化療栓塞治療的原發性肝癌患者腫瘤血供效能初步應用研究
楊志軍,趙麗娟
隨著血管介入放射學的發展,經導管肝動脈化療栓塞術(transcatheter arterial chemoembolization,TACE)已成為公認的原發性肝癌(PLC)非手術治療的首選方法[1]。TACE聯合其他治療有可能成為外科手術治療的替代手段,為不適合切除腫瘤的患者帶來希望。然而,術后復發和殘癌成為困擾其臨床應用的難題。因此,尋找快速、高效和準確的評價TACE術后療效的方法,成為臨床工作的重點[2,3]。目前,臨床上主要的評估方法有超聲造影、MRI、CT和數字減影技術等,而這些方法雖然各有優勢,但仍存在不足,如價格昂貴、有放射性、碘油沉積影響等[4,5]。超微細彩色血流成像(superb micro-vascular imaging,SMI)是基于彩色多普勒發展而來的、靈敏度較高的高分辨率血流顯示技術,其優點包括空間分辨率高、可顯示低血流圖像、偽像降低、高幀頻成像等[6]。我們采用SMI技術評價了45例接受TACE治療的PLC患者的療效,現將結果報道如下。
1 資料與方法
1.1 臨床資料 2014年1月~2015年12月在我院接受TACE治療的PLC患者45例。PLC的診斷符合美國肝臟病學會(AASLD)發布的診斷標準[7]。納入標準:1)經影像學檢查診斷;2)有TACE治療適應證。排除術后復發、腫瘤結節破裂出血[8]、門靜脈主干被癌栓阻塞,側支血管少、存在嚴重的心血管系統和內分泌系統疾病者。本研究已經本院醫學倫理委員會批準,患者簽署知情同意書。
1.2 TACE治療方法 常規進行。
1.3 腹部超聲和CT檢查 患者在接受TACE治療后1個月,接受增強CT和彩色多普勒血流成像(color doppler flowimaging,CDFI)等檢查。使用美國GE公司生產的Vivid 7全數字彩色多普勒超聲診斷儀,375BT凸陣探頭,頻率為2~5 MHz,配備有CDFI、SMI成像軟件和微血管成像軟件(Commune軟件)。患者空腹、取仰臥位。將橫突下的橫、縱切面、右肋間切面和右肋下斜面作為常規切面,調節儀器,使肝臟病灶內部的血流顯示清楚,且無偽彩影,CDFI量程和幀頻設置為9.4~15.7 cm/s和6~10幀/s,設置SMI為 1.2~4.7 cm/s和 40~50幀/s。灰階增益、彩色增益、動態范圍和濾波分別設置為80~100 dB、40~50 dB、55 dB 和 6。囑患者屏氣,先后使用CDFI模式、SMI模式觀察肝臟病灶內部和周圍血供,將圖片資料存于移動硬盤,供后續分析。有血供定義為:CDFI和SMI提示肝臟病灶內部有點狀或條狀血流信號。使用日本東芝公司生產的Aquilion 64排螺旋CT檢查。增強CT片掃描參數為:管電壓120 kv、電流580 mA、螺距1.375、層厚5 mm,造影劑選用優維顯(拜耳醫藥保健有限公司),CT片由2名醫師閱讀。
1.4 統計學方法 應用SPSS 19.0軟件進行統計學分析,計數資料的比較采用卡方檢驗,繪制受試者工作特征曲線(ROC曲線),并計算曲線下面積(AUC)分析診斷效能。P<0.05被認為差異存在統計學意義。
2 結果
2.1 一般資料 本研究共納入接受TACE治療的PLC患者45例(56個病灶),男性31例,女性14例;年齡47~63歲,平均年齡為(56.0±4.2)歲。單發病灶35例,多發病灶10例(21個病灶);病灶位于肝左葉15個,位于肝右葉36個,位于左右葉交界處5個;病灶大小為0.8~5.0 cm,平均(2.8±1.9)cm。SMI檢查結果提示腫瘤內部有血流信號,病灶周圍表現為滋養血管自肝動脈或門靜脈發出后,走行彎曲、粗細不一,沿著病灶周圍行走或者伸入病灶內部(圖1)。

圖1 腹部影像學檢查表現 提示肝左葉腫瘤(箭頭)
2.2 不同檢查方法評估病灶血供情況的比較 增強CT評估病灶血供的能力優于CDFI(x2=38.205,P<0.001)和 SMI(x2=12.010,P=0.001);SMI評估病灶血供的能力優于 CDFI(x2=9.583,P=0.002,表 1);CDFI和SMI判斷病灶血供的診斷效能分析顯示,SMI診斷的 ROC 曲線下面積大于 CDFI(P=0.031,圖 2),SMI判斷病灶血供的靈敏度、準確度和陰性預測值均優于CDFI (x2=20.612,P <0.001;x2=10.251,P=0.001;x2=2.956,P=0.041,表 2)。
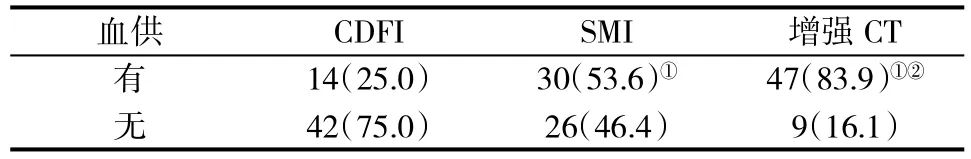
表1 不同檢查方法評估病灶血供情況[個(%)]的比較

表2 SMI和CDFI判斷病灶血供的診斷效能(%)比較
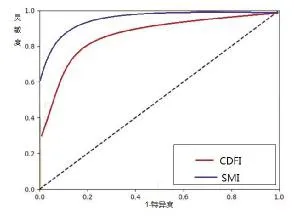
圖2 兩種方法診斷效能比較
2.3 三種檢查方法對不同大小病灶血供的顯示情況比較 以病灶直徑2.0 cm進行分界,SMI可以清晰顯示直徑<2.0 cm病灶內部血流,但是CDFI未顯示血供信號,SMI評估病灶血供的能力優于CDFI(x2=5.758,P=0.016);對于直徑≥2 cm 的病灶,SMI和CDFI均可顯示病灶血流,但是SMI評估病灶血供的能力優于 CDFI(x2=6.560,P=0.010,表 3),SMI評估直徑<2 cm或≥2 cm病灶血供的能力均明顯優于CDFI(P<0.05,表4)。

表3 三種方法顯示不同大小腫瘤內部血供情況[個(%)]比較
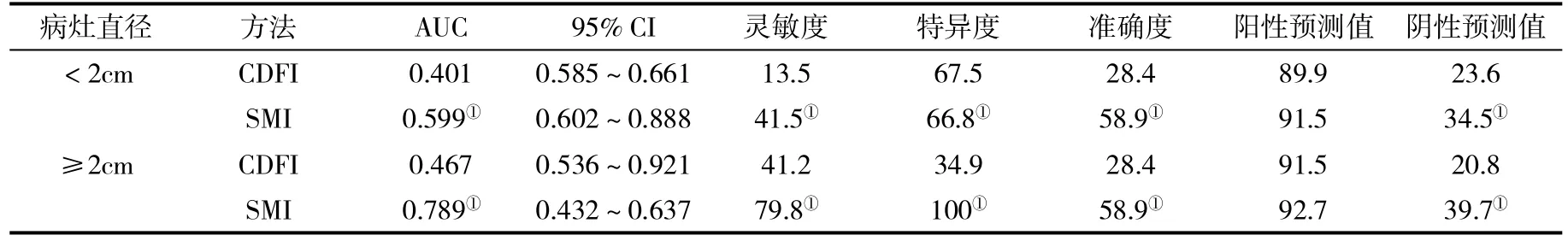
表4 CDFI和SMI判斷病灶血供的診斷效能(%)比較
3 討論
TACE是臨床上不可切除PLC的首選治療方法,但術后殘癌和復發是需要解決的難題。因此,尋找快速和高效的評估TACE術后療效的方法,是臨床工作重點[9]。本研究發現SMI可以檢測到PLC病灶內部和周邊細微血流信號,且效果明顯優于CDFI。
腫瘤病灶的新生血管是腫瘤生長和遠處轉移的基礎,新生血管以芽生和非芽生的方式向病灶內部和周圍生長[10]。有研究證實,腫瘤周邊新生血管與炎性反應有關,提示幫助腫瘤細胞惡性生長的血管常位于病灶內部[11]。目前,臨床上評價TACE術后療效主要采用增強CT或MRI,各有優勢,但仍存在有許多不足[12]。比如數字減影技術可以清楚地顯示病灶內部的新生血管特點,可作為診斷PLC的依據,但是這種技術是一項有創檢查,并且對于分化較好的小PLC病灶無法清楚地顯影[12]。近年來興起的超聲造影是判斷肝臟腫瘤病灶微循環灌注的最敏感和客觀的手段,可以很好地辨別病灶滋養血管的數目、形態和構架[13]。研究發現超聲造影對TACE術后療效的評價在某些方面與增強CT相當[14]。CDFI是臨床常用、簡便、性價比較高的評估病灶供血情況的檢查方法,被廣泛用于檢測器官組織或病灶的血流特征。但是,對微小和低速血流顯影欠敏感[15]。有研究發現,CDFI只能顯示管徑>0.2 mm且血流速度比較快的血管。此外,在消除偽影的同時,CDFI可能將有臨床價值的細微血流信號也進行了消除。因此,CDFI在顯示細微血管方面的靈敏度不是很高[16,17]。SMI作為一種新型血流成像技術,可以顯示血管直徑<0.2 mm的低速血流信號,可以將低速血流的多普勒信號與組織運動產生的多普勒信號區分開來,具有幀頻高、運動偽像較少、靈敏度高和分辨率強等特點,不需要使用造影劑也能將低速細小血流清晰地顯示,具有很大的臨床意義。
本研究發現,SMI在顯示接受TACE術后殘留病灶血供的能力優于CDFI,與以往的研究結論一致[18,19]。SMI診斷曲線下面積為0.721,明顯較CDFI的0.634高,SMI診斷的靈敏度達到62.4%,準確度也達到了58.9%,說明SMI可以明顯提高介入治療后對療效的評價。SMI的一大優勢是可以判斷較小的病灶活性。病灶越大,血流越豐富,干擾血流信號的因素也會越少。本研究發現SMI對于直徑<2.0 cm或≥2.0 cm的病灶評估能力均明顯優于CDFI。值得一提的是,對于直徑<2.0 cm的病灶,影響血流信號的因素很多,如呼吸、病灶位置等。這些都會造成診斷的假陰性或假陽性結果,而SMI就可以通過提取微血管與正常低速血流組織的差異,減少組織運動雜波的影響,提高診斷的靈敏度和準確率[20]。與本研究結果相類似的是,劉水清等發現,SMI在顯示PLC病灶介入治療后殘留血供的能力優于CDFI,SMI的靈敏度達61.8%,漏診率為39.2%。
本研究還有一些局限性有待今后解決:1)本研究為單中心研究,且樣本量比較少;2)未使用盲法解讀影像表現;3)SMI所顯示的血流信號為動靜脈血流信號同時顯示。因此,CDFI和SMI評估血流信號可能有一定的誤差。
綜上所述,SMI技術是一種新型血流成像技術,能較好地檢測病灶的血供,為臨床評價TACE術后療效提供了一種新的方法。

