綜合實驗與工藝流程中有關溫度控制問題的分析
侯志宏
湖南
化工工藝流程題和實驗題是全國卷理綜化學每年必考的兩大題型,綜合了元素化學、化學反應原理、實驗基礎、工業生產、環境保護、資源開發利用等幾乎所有高中化學的內容,對學生提煉題目信息、挖掘潛在條件、綜合分析處理問題等方面提出了較高的要求。工藝和實驗設計的成功必須考慮反應條件的控制,其中溫度的控制尤為關鍵,這在各地的高考試題中均有體現;溫度控制相關試題常常同時考查文字表達,使得該類試題成為高考化學的難點和易失分點。本文主要介紹如何控制溫度及為什么控制溫度,并結合高考試題進行分析。
1.控制溫度的意義
【例題1】實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置見下圖,相關物質的沸點見附表)。


物質沸點/℃物質沸點/℃溴58.81,2-二氯乙烷83.5苯甲醛179間溴苯甲醛229
其實驗步驟為
步驟1~步驟3略
步驟4:減壓蒸餾有機相,收集相應餾分,得到間溴苯甲醛。
問題:步驟4中采用減壓蒸餾技術,是為了防止________。
解題分析:從題干中獲取關鍵信息,間溴苯甲醛含有醛基且沸點為229℃;醛基在溫度較高時容易被氧化,減壓蒸餾可以降低操作中所需溫度,防止副反應的發生。
參考答案:間溴苯甲醛被氧化

問題:碳化溫度保持在50~60℃。溫度偏高不利于碳化反應,原因是__________________ ;溫度偏低也不利于碳化反應,原因是__________________。
參考答案:CO2的溶解度減小、Mg(HCO3)2受熱分解、平衡逆向移動等 降低了反應速率
智能變電站通過電流、電壓控制技術,采用GIS控制設備和先進的傳感器,充分結合計算機技術的網絡監控系統。利用傳統的光纖端口保護裝置以及回路裝置,實現信息傳輸,智能變電站主要系統組成是站控層、設備層以及間隔層,這些主要部分都是采用不同技術設備來承擔著變電過程中需要的信息收集和設備連接以及電能輸配。
溫度控制的意義主要是從物質性質和反應原理兩個角度體現;物質的性質包括熔點、沸點、液化、氣化、吸水、揮發、溶解、膠體的聚沉等物理性質,也包括熱穩定性、氧化性、還原性、水解等化學性質。如:工藝或實驗題中用到雙氧水、氨水、銨鹽、硝酸鹽等易分解的物質,控溫的目的是防止物質分解;產物或者反應物中含有醛類、酚類等物質,控溫的目的是防止其被氧化;實驗室保存或者制備液溴、一溴乙烷等沸點較低物質,需要加冰水或冷凍,目的是防止物質的揮發;海水提Br2過程中,出溴口的溫度控制在80~90℃,目的是要使Br2揮發出來而又減少水蒸氣混入Br2中。
化學反應原理主要是從反應速率、各種平衡、副反應、催化劑的使用等方向去考慮;如:制取乙酸乙酯的實驗中,緩慢加熱的原因是防止乙醇、乙酸的揮發,保持一定的反應速率,及時分離乙酸乙酯,有利于乙酸乙酯產率的提高;實驗室制取乙烯、制硝基苯,控制溫度,都是防止發生副反應;工業合成氨選擇的溫度是500℃左右,原因之一就是使催化劑的活性達到最高,生產效率最高。
2.如何控制溫度
常見的加熱方法有:酒精燈加熱,酒精噴燈加熱,水浴、油浴、沙浴加熱,水蒸氣加熱,加熱水加熱,吹熱風加熱等。如碳酸鈣的受熱分解、石蠟油的催化裂化等需采用酒精噴燈加熱。常見的降溫方法有:冷凍法,冰水浴,減壓蒸餾,減壓烘干,減壓蒸發等。如從青蒿素的四氯化碳溶液中得到青蒿素需要減壓蒸餾,干燥氫氧化銅需要減壓烘干。
3.控溫類試題的思維建模
我們將溫度變化對流程和實驗的影響分成溫度變化對結果有利、溫度變化對結果不利兩類,針對答題建立一個思維模式,如下表所示,在我校學生的實踐教學活動中,學生反饋良好,能解決大多數涉及溫控問題的文字表達類試題。
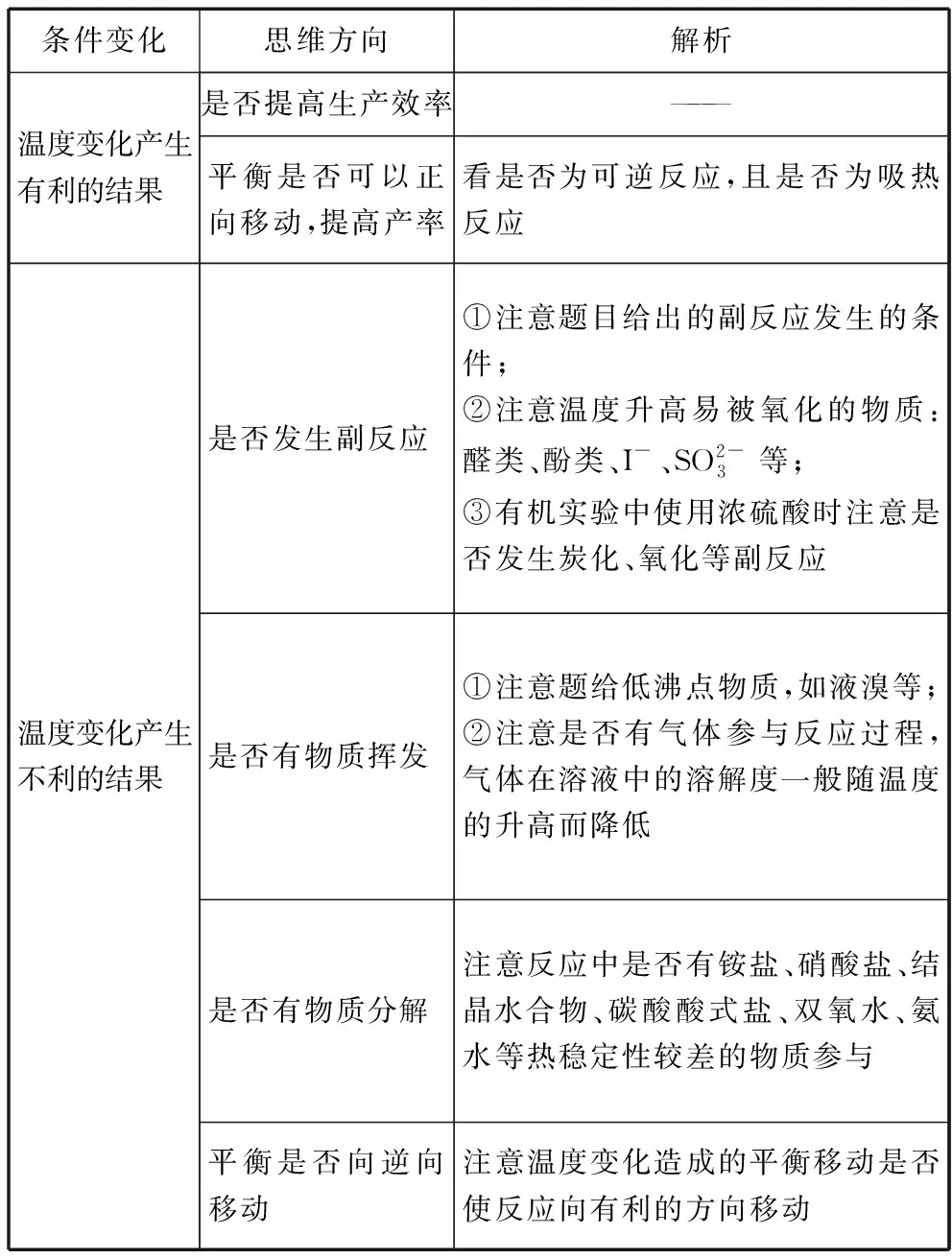
條件變化思維方向解析溫度變化產生有利的結果是否提高生產效率———平衡是否可以正向移動,提高產率看是否為可逆反應,且是否為吸熱反應溫度變化產生不利的結果是否發生副反應①注意題目給出的副反應發生的條件;②注意溫度升高易被氧化的物質:醛類、酚類、I-、SO2-3等;③有機實驗中使用濃硫酸時注意是否發生炭化、氧化等副反應是否有物質揮發①注意題給低沸點物質,如液溴等;②注意是否有氣體參與反應過程,氣體在溶液中的溶解度一般隨溫度的升高而降低是否有物質分解注意反應中是否有銨鹽、硝酸鹽、結晶水合物、碳酸酸式鹽、雙氧水、氨水等熱穩定性較差的物質參與平衡是否向逆向移動注意溫度變化造成的平衡移動是否使反應向有利的方向移動
4.強化練習
【練習1】正丁醛是一種化工原料。某實驗小組利用如下裝置合成正丁醛。

發生的反應如下:

沸點/℃密度/g·cm-3水中溶解性正丁醇117.20.810 9微溶正丁醛75.70.801 7微溶
實驗步驟如下:將6.0 g Na2Cr2O7放入100 mL燒杯中,加30 mL水溶解,再緩慢加入5 mL濃硫酸,將所得溶液小心轉移至B中。在A中加入4.0 g正丁醇和幾粒沸石,加熱。當有蒸汽出現時,開始滴加B中溶液。滴加過程中保持反應溫度為90~95℃,在E中收集90℃以下的餾分。將餾出物倒入分液漏斗中,分去水層,有機層干燥后蒸餾,收集75~77℃餾分,質量為2.0 g。反應溫度應保持在90~95℃其原因是__________________。
【練習2】亞氯酸鈉(NaClO2)主要用于棉紡、造紙業的漂白劑,也用于食品消毒、水處理等,亞氯酸鈉受熱易分解。以氯酸鈉等為原料制備亞氯酸鈉的工藝流程如下:

采取“減壓蒸發”而不用“常壓蒸發”原因是__________________。
【練習3】以磷石膏(主要成分CaSO4,雜質SiO2、Al2O3等)為原料可制備CaCO3,在敞口容器中,用NH4Cl溶液浸取高溫煅燒的固體,隨著浸取液溫度上升,溶液中c(Ca2+)增大的原因是__________________。

【練習4】鍶(Sr)為第五周期第ⅡA族元素。高純六水氯化鍶晶體(SrCl2·6H2O)具有很高的經濟價值,61℃時晶體開始失去結晶水,100℃時失去全部結晶水。用工業碳酸鍶粉末(含少量Ba、Fe的化合物)制備高純六水氯化鍶的過程如下:

工業上用50~60℃熱風吹干六水氯化鍶,選擇該溫度的原因是__________________。
【練習5】實驗室制備1 - 乙氧基萘的反應方程式和裝置如下:
1 - 萘酚 1 - 乙氧基萘

已知:1 - 萘酚的性質與苯酚相似,有難聞的苯酚氣味。相關物質的物理常數

物質相對分子質量狀態熔點/℃沸點/℃溶解性水乙醇1-萘酚144無色或黃色菱形結晶或粉末96278微溶于水易溶于乙醇1-乙氧基萘172無色液體5.5267不溶于水易溶于乙醇乙醇46無色液體-114.178.5任意比互溶
實驗測得1 - 乙氧基萘的產量與反應時間、溫度的變化如圖所示,時間延長、溫度升高,1 - 乙氧基萘的產量下降可能的兩個原因是__________________。

【練習6】以海綿銅(主要成分是Cu和少量CuO)為原料,采用硝酸銨氧化分解技術生產CuCl的工藝過程如下,溶解溫度應控制在60~70℃原因是__________________。

【練習7】甲醇是一種可再生燃料,其沸點為64.7℃。有科學家提出:把含有過量CO2的空氣吹入碳酸鉀溶液中,然后再把CO2從溶液中提取出來,經化學反應后得到甲醇,流程如下:

在合成塔中發生的是放熱反應,高溫不利于甲醇的生成,合成塔中維持300℃的較高溫度的原因可能是___________________________________。
練習題參考答案
練習1 既可保證正丁醛及時蒸出,又可盡量避免其被進一步氧化
練習2 常壓蒸發溫度過高,亞氯酸鈉容易分解,導致產率偏低
練習3 浸取液溫度上升,溶液中c(H+)增大,促進固體中Ca2+浸出
練習4 溫度高有利于除去晶體表面的水,超過60℃時,六水氯化鍶會失去結晶水
練習5 溫度升高,1 - 萘酚被氧化;溫度升高,乙醇揮發
練習6 溫度低溶解速度慢,溫度過高銨鹽會分解

