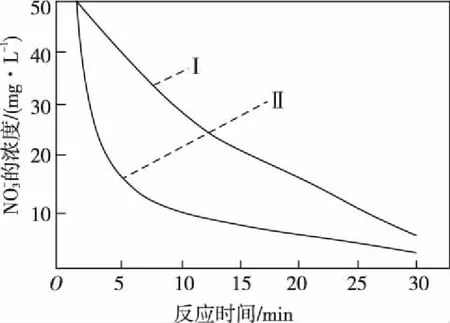
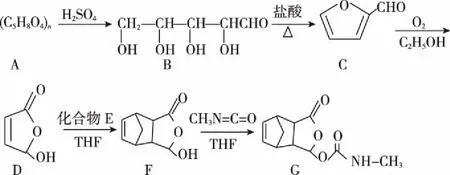
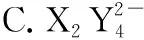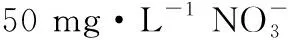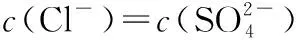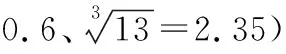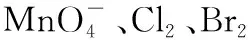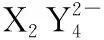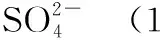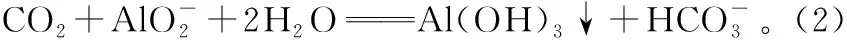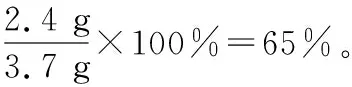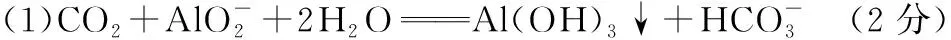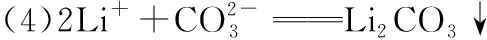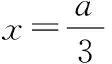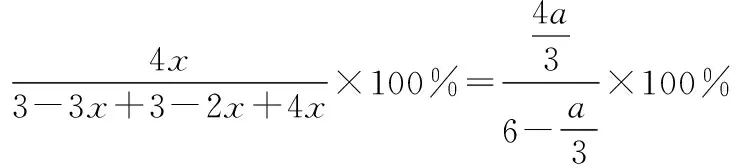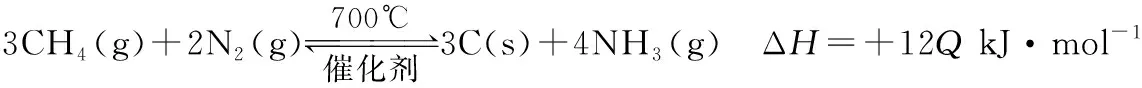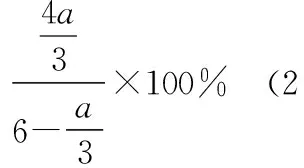“超級全能生”2018高考全國卷26省12月聯考乙卷
可能用到的相對原子質量:H—1 Li—7 C—12 N—14
O—16 Na—23 Co—59
一、選擇題:本題共7小題,每小題6分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
7.化學與生活息息相關。下列說法正確的是
( )
A.加酶洗衣粉不適合洗滌毛織品上的污漬
B.有機玻璃是一種高溫下能夠熔化的硅酸鹽材料
C.高分子化合物蛋白質和油脂均可發生水解
D.煤的氣化可以從根本上減少二氧化碳等溫室氣體的排放
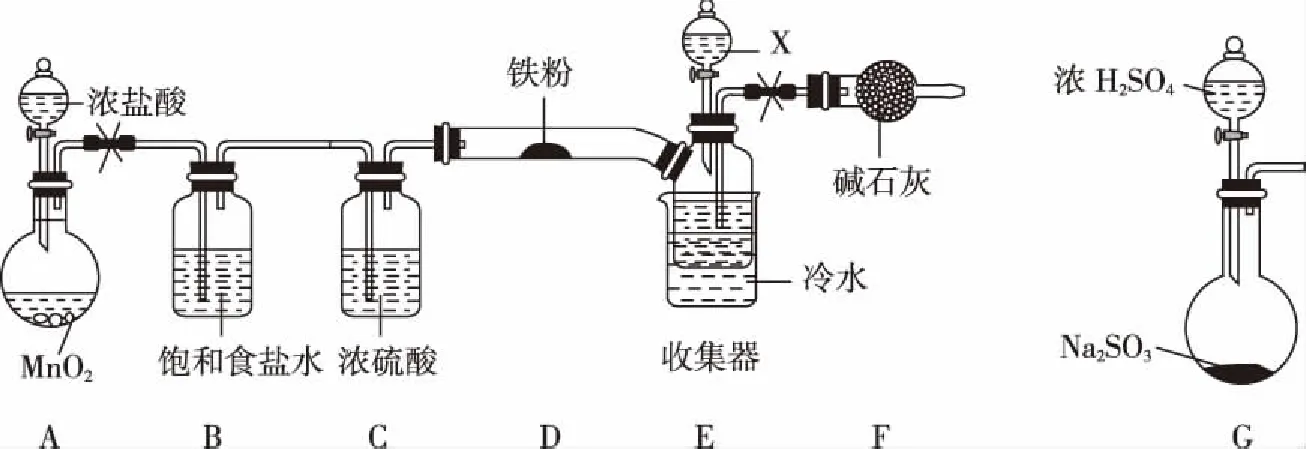
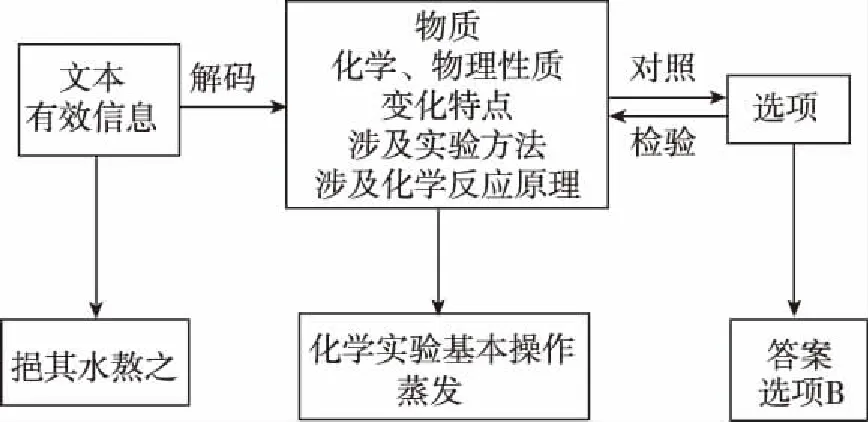
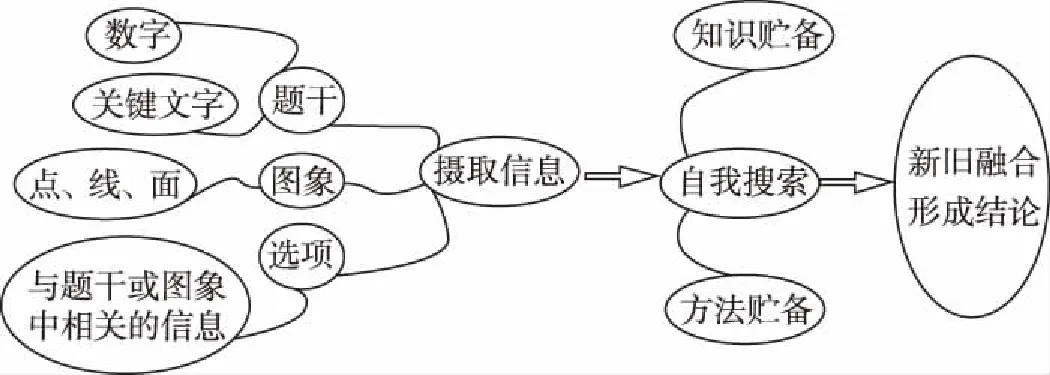
8.《夢溪筆談》對硫酸銅晶體的制備有如下敘述:“信州鉛山縣有苦泉,流以為澗,挹其水熬之,則成膽礬,烹膽礬則成銅,熬膽礬鐵釜,久之亦化為銅。”文中涉及的實驗操作方法是
( )
A.蒸餾 B.蒸發
C.干餾 D.萃取
( )
A.X的同分異構體只有Y和Z兩種
B.X、Y、Z的二氯代物均只有三種
C.X、Y、Z的所有原子可能處于同一平面
D.X、Y、Z中有兩種易使酸性高錳酸鉀溶液褪色
10.通過如圖所示裝置,不能實現實驗目的的是
( )
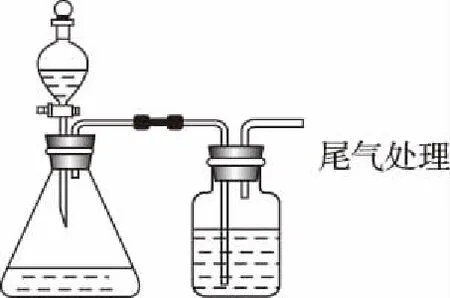
選項實驗目的分液漏斗中試劑錐形瓶中試劑廣口瓶中試劑A比較S、C、Si非金屬強弱稀硫酸純堿水玻璃B比較MnO-4、Cl2、Br2的氧化性強弱濃鹽酸高錳酸鉀溴化鈉溶液CCl2是否具有漂白性濃鹽酸氯酸鉀品紅溶液D證明草酸有還原性酸性高錳酸鉀草酸澄清石灰水
11.乙醇鈉是有機合成中常用的強堿,如圖是通過電解乙醇和氫氧化鈉溶液制備乙醇鈉的工作示意圖。下列說法錯誤的是
( )
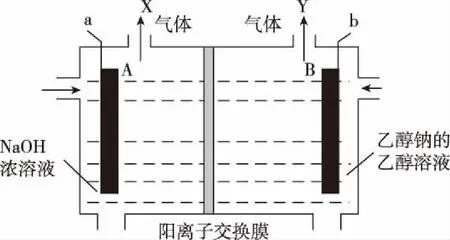
A.電極A為陽極,導線a與電源的正極相連接
B.電解過程中產生的X氣體與Y氣體的質量之比為1∶8

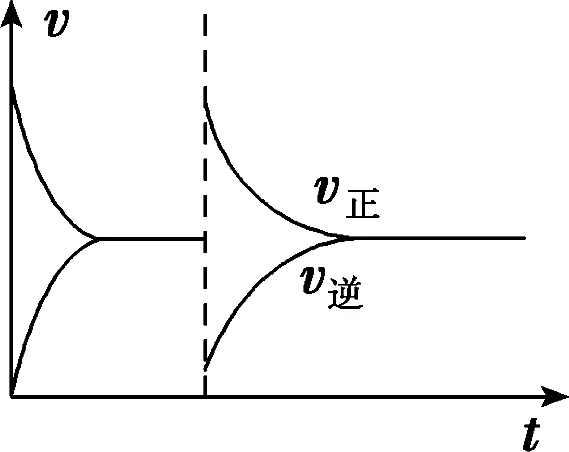
D.若電解過程中轉移2 mol電子,則右極室質量增加44 g
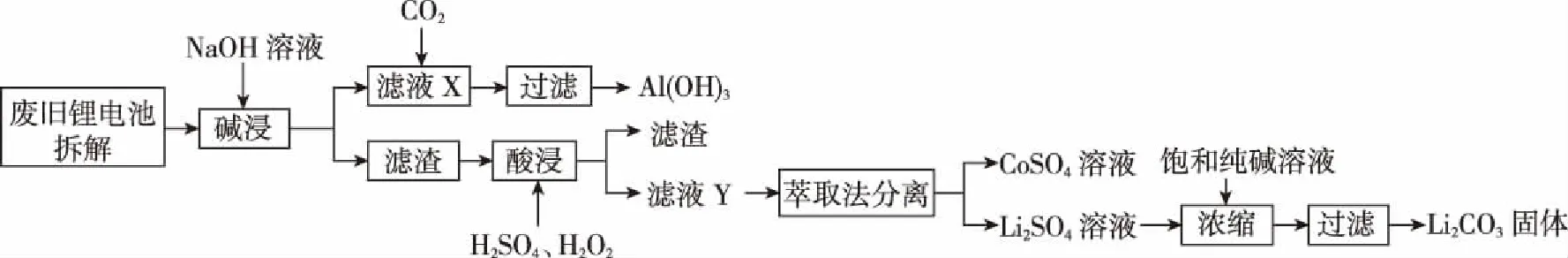
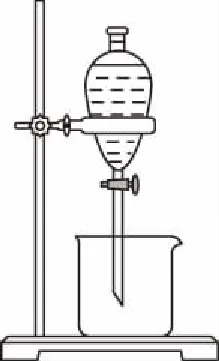
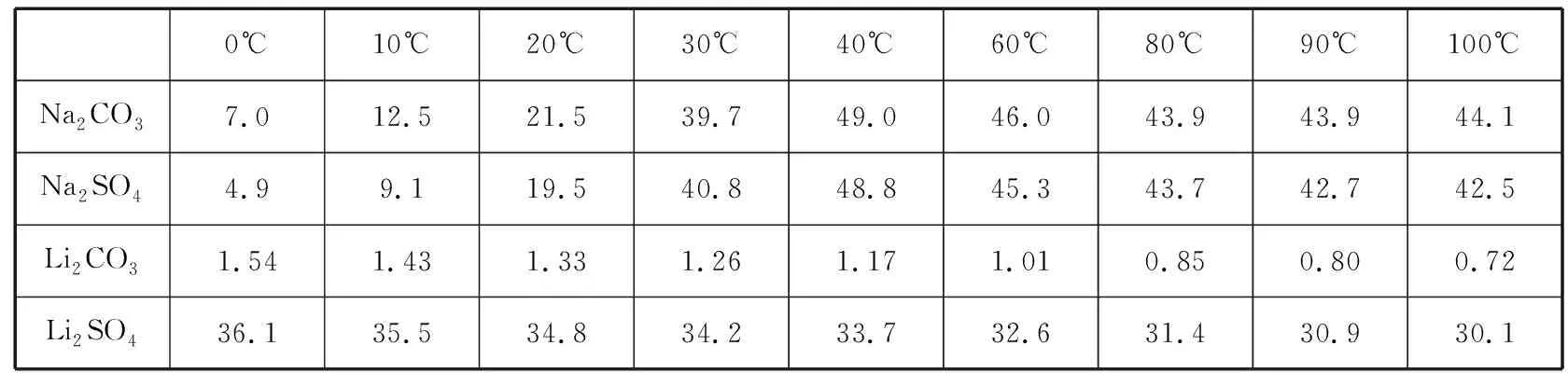
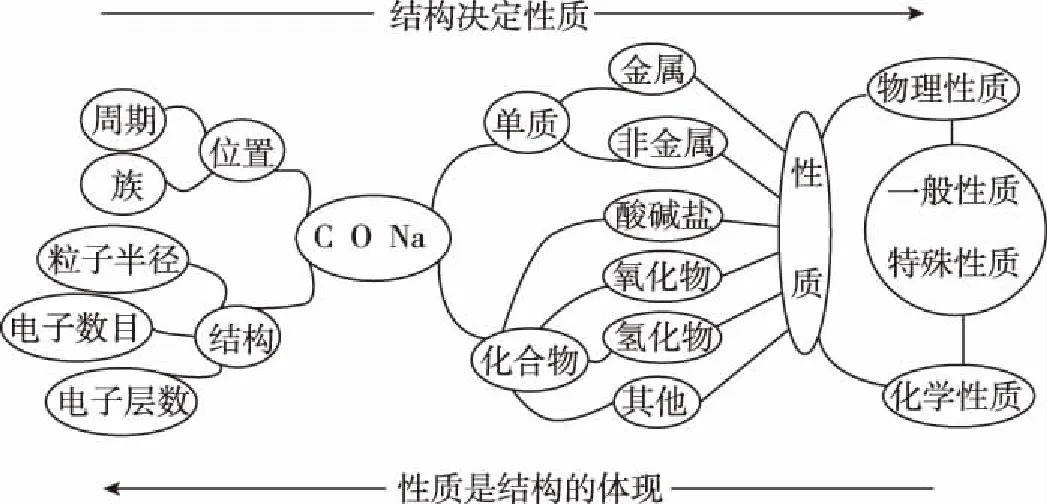
12.X、Y、Z是三種短周期主族元素,原子序數X ( ) A.原子半徑:Z>Y>X B.Z2X2Y4的水溶液顯堿性 D.Y與Z形成的兩種常見化合物中陰陽離子個數比不同 13.一定條件下向FeSO4溶液中加入堿性的NaBH4溶液即可制得納米鐵粉。納米鐵粉有很多用途,可用于污水的處理,以下是兩種條件下利用納米鐵粉對污水處理時的曲線。 下列選項正確的是 ( ) C.②條件下對應的曲線是Ⅰ 二、非選擇題:共58分。第26~28題為必考題,每個試題考生都必須作答。第35~36題為選考題,選擇一題作答。 26.(15分)已知三氯化鐵的熔點為306℃,沸點為315℃,易溶于水并且有強烈的吸水性,能吸收空氣里的水分而潮解。某學習小組用如下裝置制備三氯化鐵,并探究SO2與三氯化鐵反應的產物。 (2)堿石灰的作用是 。 (3)反應一段時間后熄滅酒精燈,關閉裝置中的兩個止水夾,冷卻至室溫。若將收集器中的三氯化鐵配制成溶液,分液漏斗中的X物質是________,操作過程為__________________。 (4)將G中產生的二氧化硫氣體通入到收集器中的三氯化鐵溶液中,取反應后的溶液進行如下實驗: 實驗Ⅰ:取少量液體于試管中,用一束光照射液體,有一條光亮的通路,試用離子方程式解釋以上現象: __________________。 實驗Ⅱ:向溶液中加入BaCl2溶液,出現白色沉淀,說明溶液中含有的離子是________,產生這種離子的離子方程式為__________________。 (5)取少量D中反應后剩余固體置于小燒杯中,再加入稀鹽酸將固體溶解,向所得溶液中滴入幾滴KSCN溶液,溶液未變紅色,________(填“能”或“不能”)說明D中無FeCl3,用離子方程式解釋:_______________________。 27.(14分)金屬是不可再生的資源,通過回收廢舊的鋰電池提取鋰、鋁、鈷等重要的金屬具有重大的意義。已知鋰電池的正極材料為LiCoO2、炭黑、鋁箔及有機黏合劑,回收的工藝流程如圖所示: 拈花灣對禪文化的深入挖掘不僅表現在外在景觀設計中,包括道路、商鋪、景點建筑、客棧等,它們的名字也都來自禪意文化典故或者經典作品,在無形中加深了旅游者對禪文化的理解。 (1)濾液X中通入過量CO2時發生的主要離子方程式為__________________。 (2)寫出酸浸時加入H2SO4、H2O2的反應方程式: _____________________;理論上鹽酸可以直接代替H2SO4、H2O2,而實際化工生產中常常不使用鹽酸,理由是________________________________________。 (3)實驗室中萃取分離CoSO4、Li2SO4溶液時需要加入有機物W,若實驗過程中使用如圖裝置,則該裝置中存在的錯誤有__________________。 (4)已知部分物質的溶解度(g/100 g H2O)情況如表所示: 0℃10℃20℃30℃40℃60℃80℃90℃100℃Na2CO37.012.521.539.749.046.043.943.944.1Na2SO44.99.119.540.848.845.343.742.742.5Li2CO31.541.431.331.261.171.010.850.800.72Li2SO436.135.534.834.233.732.631.430.930.1 寫出濃縮后的溶液中加入飽和碳酸鈉溶液的離子反應方程式:__________________ ; 為提高Li2CO3的產率,最后過濾操作中需要注意的問題是____________________。 (6)已知100 g廢舊的鋰電池中鈷酸鋰(LiCoO2)的含量為9.8%,若按照上述生產流程,可以生成2.4 g Li2CO3,則其產率為____________。 28.(14分)氨的合成與應用一直是眾多科學家研究的熱門話題,目前該研究領域已經催生了三位諾貝爾化學獎得主,N2不僅可以與H2合成氨氣,N2還可以與其他物質反應生成氨氣。回答下列相關問題: ①從平衡常數角度分析,反應限度已經較大,為何化工生產中還需要使用催化劑?__________________。 ②升高溫度,反應物的轉化率會降低,而實際化工生產中常常采用700 K左右的溫度,其原因是____________________________。 (2)1931年,科學家卡爾·博施因改進合成氨方法而榮獲該年度諾貝爾化學獎。研究發現,催化劑(Fe3O4·Al2O3)顆粒大小不同、溫度不同,平衡混合氣體中氨氣的含量不同。由圖甲可以得出合成氨的適宜條件是 ___________________。 ①下列各項能夠作為判斷該反應一定達到平衡的依據是________(填標號)。 A.容器中N2(g)、NH3(g)、O2(g)的濃度之比為2∶4∶3 B.N2與NH3濃度之比恒定不變 C.v正(N2)=2v逆(NH3) D.混合氣體中氨氣的質量分數不變 E.壓強保持不變 ②在其他條件不變時,通入2 mol N2,請在圖乙中畫出正(v正)、逆(v逆)反應速率隨時間t變化的示意圖。 ③平衡后若分別改變下列一個條件,可以使N2轉化率增大的是________(填標號)。 A.轉移掉部分O2 B.轉移掉部分NH3 C.適當增加H2O(l)的量 D.增加N2的量 (4)科學研究發現,天然氣CH4(g)與N2(g)在催化劑作用下可以直接用于合成氨氣,同時生成副產物焦炭,已知每轉移1 mol電子,該反應吸收的熱量為QkJ。 ①寫出該反應的熱化學反應方程式:__________________。 ②700℃時,將3 mol CH4與3 mol N2在2 L的恒定密閉容器中發生上述反應,達平衡時生成amol C,求此時混合氣體中氨氣的體積分數________(用含a的數學表達式即可,下同);該溫度下的平衡常數Kc=________。 35.[物質結構與性質](15分) 二硫化鉬是一種典型的過渡金屬硫化物,因其特有的S—Mo—S二維層狀結構和較高的活性硫含量,作為鋰離子電池負極材料具有良好的應用前景。 (1)寫出S原子的最外層電子的排布式:____________,S原子的最高能級的電子云形狀為________。 (2)Mo與Cr相臨周期,同一族,Cr的原子序數為24,Mo的原子序數為________;硬度比較:Cr________(填“大于”“小于”或“等于”)Mo。 (3)CS2是一種良好的非極性溶劑,CS2分子的空間構型為________;C原子的雜化方式為________。 (4)二硫化鉬為層狀結構,六方晶胞,由二層硫原子和一層鉬原子構成。MoS2的一種晶體結構圖如圖所示。 與S緊臨的Mo個數為________。 36.[有機化學基礎](15分) 某種藥物在臨床上有許多的應用,具有去熱、鎮痛等療效,以下是該藥物的合成路線。已知: (1)化合物C的分子式為____________,B中含氧官能團的名稱為____________。 (4)F的同分異構體有多種,符合以下條件的同分異構體有________種,寫出其中一種同分異構體的結構簡式:____________。 ①屬于芳香族化合物,苯環上只有兩個支鏈,苯環上的一氯代物只有兩種 ②能與FeCl3溶液發生顯色反應 ③能與碳酸氫鈉反應產生氣體 答案詳解 7.【解析】毛織品的主要成分為蛋白質,某些酶可促進蛋白質的水解,所以加酶洗衣粉不適合洗滌毛織品上的污漬,選項A正確;有機玻璃屬于有機材料,不屬于硅酸鹽材料,選項B錯誤;蛋白質和油脂均可發生水解,但是油脂不屬于高分子化合物,選項C錯誤;煤氣化后沒有減少碳原子的個數,所以并沒有從根本上減少二氧化碳的排放,選項D錯誤。 【答案】A 8.【解析】中華優秀傳統文化的考查是近年來考查學生素養的熱點題型之一,也是近年來高考的熱點,解答該類試題,其思維模式如下: 【答案】B 【答案】D 【答案】C 【答案】B 【答案】B 【個性分析】位構性解題思路 【答案】B 【個性分析】圖象題解題思維過程 26.(15分) 【答案】 (1)AD (2分) (2)防止空氣中的水蒸氣進入,吸收過量的氯氣 (2分) (3)濃鹽酸 (1分) 將收集器右側止水夾打開,取下分液漏斗口部的塞子,打開分液漏斗的活塞,使鹽酸慢慢流下,再加入一定量蒸餾水稀釋 (2分) 27.(14分) (6)2LiCoO2~ Li2CO3 196 74 100 g×9.8%m(Li2CO3)=3.7 g 【答案】 (1分) (3)分液漏斗尖端未緊靠燒杯內壁;液體過多 (2分) (5)3.4 (2分) (6)65% (2分) 28.(14分) 【解析】(1)根據化工生產實際情況,平衡常數可以間接反映出反應物的轉化率,但不能夠反映出生產效率,所以化工生產中還需要使用催化劑或適當升高溫度,提高反應速率,從而提高生產效率。(2)根據實驗研究結果圖,可以得出在470℃左右、0.6 mm粒度大小的催化劑(Fe3O4·Al2O3)時,氨的含量最高,選取此時條件最好。(3)①當容器中N2(g)、NH3(g)、O2(g)的濃度之比為2∶4∶3時,并不能夠說明正、逆反應速率相等或任一反應物或生成物的濃度恒定不變,所以不能說明是否達到平衡狀態,A錯誤;N2與NH3濃度之比恒定不變,可以說明一定達到平衡狀態,B正確;v正(N2)=2v逆(NH3)不能說明正、逆反應速率相等,但當2v正(N2)=v逆(NH3)時,則可以說明正逆反應速率相等,C錯誤;混合氣體中氨氣的質量分數不變,一定可以說明反應達到平衡狀態,D正確;該反應為恒壓條件下的可逆反應,無論平衡與否,壓強始終不變,E錯誤。②恒壓時,充入N2,由于H2O為液體,平衡正向移動,但平衡后與原平衡速率一樣。③根據平衡移動原理,減少生成物的濃度,可以使平衡正向移動,反應物的轉化率增大,A、B正確;增加液態水的量,不會影響濃度商與平衡常數的大小,平衡不移動,C錯誤;增加氮氣的量,反應物氮氣的轉化率會減小,D錯誤。 開始/mol 3 3 0 0 轉化/mol 3x2x3x4x 平衡/mol 3-3x3-2x3x4x 【答案】 (1)①使用催化劑,主要目的是加快反應速率,提高單位時間內的產量 (1分) ②該溫度下,催化劑的活性大,催化效率高,反應速率快,雖然反應限度有所降低,但綜合考慮,單位時間內的產量仍較高 (1分) (2)470℃左右、0.6 mm粒度大小的催化劑(Fe3O4·Al2O3) (2分) (3)①BD (1分) ③AB (1分) 35.(15分) 【解析】(1)S原子是16號元素,有三個電子層,最外層有6個電子,電子排布式為3s23p4;S原子的最高能級是3p,而p軌道的電子云的形狀是啞鈴形(或紡錘形)。(2)Cr是24號元素,而Mo位于它的同一族的下一周期,原子序數比Cr大18,所以Mo的原子序數為42;在同一族中,原子序數越小半徑越小,硬度就越大。(3)CS2是一種非極性溶劑,結構和二氧化碳類似,是直線形,所以中心原子的雜化方式是 sp。(4)根據MoS2的化學式可以得出Mo和S的個數比為1∶2,1個Mo原子周圍有6個S原子,所以每個S原子周圍只能有3個Mo原子。 【答案】 (1)3s23p4(2分) 啞鈴形(或紡錘形) (2分) (2)42 (2分) 大于 (2分) (3)直線形 (2分) sp (2分) (4)3 (3分) 36.(15分) 【答案】 (1)C5H4O2(1分) 羥基、醛基 (1分) (2) 3 (2分) 加成反應 (2分) (5) (3分) 【個性解析】肢解法剖析有機推斷題