A2aR在彌漫大B細胞淋巴瘤組織和CD8+T細胞上的表達和預后價值的研究*
張婷婷 王先火 孟斌 任秀寶 張會來
彌漫大B細胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是非霍奇金淋巴瘤中最常見的類型,在臨床表現、免疫表型和分子遺傳學等方面具有高度異質性[1]。腺苷信號通路是近年來被證實的一種新型免疫逃逸機制。腫瘤細胞在乏氧條件下釋放核苷酸,核苷酸進一步由CD39/CD73水解為腺苷,游離腺苷與4個不同的G蛋白偶聯受體(A1、A2A、A2B和A3)結合發揮廣泛的免疫抑制作用,其中A2aR因其高親和力和廣泛表達而受到關注[2]。研究表明,阻斷A2aR可增強腫瘤浸潤淋巴細胞的活性,提高抗腫瘤免疫反應[3-4]。腫瘤源性的腺苷和抗腫瘤T細胞上A2aR表達參與多種腫瘤化療及免疫治療的耐藥[5-6]。目前,僅有少數研究報道A2aR在實體瘤中的表達及意義[3,7],尚未見血液腫瘤中A2aR表達和臨床意義的研究。本研究旨在探索DLBCL中A2aR總表達和腫瘤浸潤淋巴細胞中CD8+T細胞上A2aR表達與患者臨床病理特征、預后之間的關系,為進一步研究DLBCL多重免疫逃逸機制和免疫治療提供理論依據。
1 材料與方法
1.1 病例資料
收集2010年1月1日至2015年12月31日就診于天津醫科大學腫瘤醫院初治的72例DLBCL患者石蠟組織和臨床病理資料。所有患者均接受2個周期及2個周期以上類RCHOP方案治療。患者年齡為17~84歲,平均年齡為(52.5±14.2)歲;其中男性39例(54.2%),女性33例(45.8%);生發中心B細胞(germinal center B cell,GCB)亞型31例(43.1%),非生發中心B細胞(nongerminal center B cell,non-GCB)亞型35例(48.6%),未分類6例(8.3%)。
1.2 方法
1.2.1 實驗試劑 石蠟組織4 μm切片,采用多重免疫組織化學法檢測DLBCL組織中A2aR、CD8的表達。兔抗人A2aR、CD8多克隆抗體購自英國Abcam公司;Opal多染試劑、HRP兔二抗、blocking buffer均購自美國Perkin Elmer公司。
1.2.2 實驗原理 多重免疫組織化學技術是在原免疫組織化學基礎上,采用二抗上帶有的HRP催化加入體系的非活性熒光素,熒光素在HRP和過氧化氫的作用下被活化,跟臨近目的蛋白上的酪氨酸殘基共價偶聯,使得蛋白樣品與熒光素穩定結合。然后微波處理,非共價結合的抗體被洗掉,共價結合的熒光素還留存在樣品上(熒光素不受微波處理影響,并能在抗體去除后保留信號),微波處理之后可進行下一個蛋白的染色。
1.2.3 實驗步驟 取新鮮標本,10%甲醛固定,石蠟包埋,4 μm厚度切片;將組織切片放置在70℃恒溫箱中烘烤2 h,二甲苯、梯度乙醇浸片;將玻片浸泡于250 mL抗原修復液中,置于微波爐中(高火至液體沸騰,調至低火,維持15 min),室溫自然冷卻;滴加blocking buffer,保濕孵育10 min;滴加CD8抗體(稀釋濃度1∶1 000),4℃冰箱過夜;滴加HRP兔二抗,保濕孵育10 min;滴加opal 520,保濕孵育10 min,TBST沖洗玻片;將玻片浸泡于250 mL抗原修復液中,置于微波爐中,重復上述步驟,滴加A2aR抗體(稀釋濃度1∶3 500)、HRP兔二抗、opal 620;滴加DAPI、封片。
1.2.4 結果判讀 采用Mantra成像系統進行圖像采集,每張切片采集20個200倍視野。應用Inform軟件進行蛋白定量、定位分析。A2aR陽性定義為≥1%的細胞出現細胞膜著色。
1.3 隨訪
通過查閱門診、住院病歷及電話進行隨訪,隨訪日期截至2017年4月。所有患者均獲得隨訪,中位隨訪時間為35(4~83)個月。預后評價指標為OS,定義為確診至患者死亡(完全數據)或末次隨訪的時間(截止數據)。
1.4 統計學分析
采用SPSS 20.0和GraphPad Prism 6.0軟件進行統計學分析。A2aR表達與DLBCL患者臨床病理特征之間的關系采用χ2檢驗,預后分析采用Kaplan-Meier法及Log-rank檢驗。以P<0.05為差異具有統計學意義。
2 結果
2.1 DLBCL組織及CD8+T細胞上A2aR表達
72例DLBCL患者中,A2aR總表達陽性率為41.7%(30/72),陰性率為58.3%(42/72),A2aR陽性和陰性表達的比較見圖1。CD8+患者有58例,其中CD8+T細胞上A2aR表達陽性率為27.6%(16/58),CD8+T細胞上A2aR表達陰性率為72.4%(42/58),CD8+T細胞上A2aR的表達見圖2。
2.2 A2aR總表達與患者臨床病理特征之間的關系
χ2檢驗結果顯示,A2aR總表達與患者分期、IPI評分、Ki-67、β2-MG、B癥狀相關(P<0.05,表1)。
2.3 CD8+T細胞上A2aR表達與患者臨床病理特征之間的關系
χ2檢驗結果顯示,CD8+T細胞上A2aR表達與患者分期、結外受累數目、IPI評分、Ki-67、β2-MG、B癥狀、乳酸脫氫酶(lactate dehydrogenase,LDH)相關(P<0.05,表2)。
2.4 A2aR總表達與患者預后的關系
Kaplan-Meier生存曲線分析顯示,A2aR陽性組患者OS較陰性組較差(P<0.05,圖3)。A2aR陽性組患者中位OS(median OS,mOS)為53.5(95%CI:41.4~65.5)個月,而A2aR陰性組患者mOS為69.0(95%CI:60.9~77.1)個月。隨訪期間,A2aR陰性組8例(19.0%)死亡,A2aR陽性組13例(43.3%)死亡。
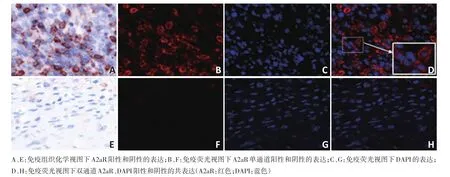
圖1 A2aR染色結果(×200)
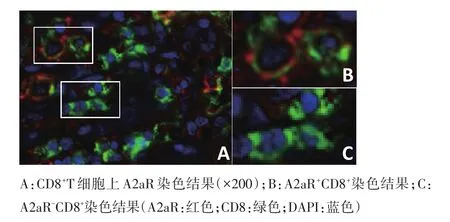
圖2 CD8+T細胞上A2aR的表達
2.5 CD8+T細胞上A2aR表達與患者預后的關系
Kaplan-Meier生存曲線分析顯示,CD8+T細胞上A2aR陽性組患者OS較陰性組顯著更差(P<0.001),且生存曲線比定位A2aR總表達患者生存曲線分離更加明顯(圖4)。A2aR陽性組患者mOS為34.8(95%CI:22.2~47.5)個月,而A2aR陰性組患者mOS為76.2(95%CI:69.8~82.5)個月。隨訪期間,A2aR陰性組中4例(9.5%)死亡,A2aR陽性組中11例(68.8%)死亡。
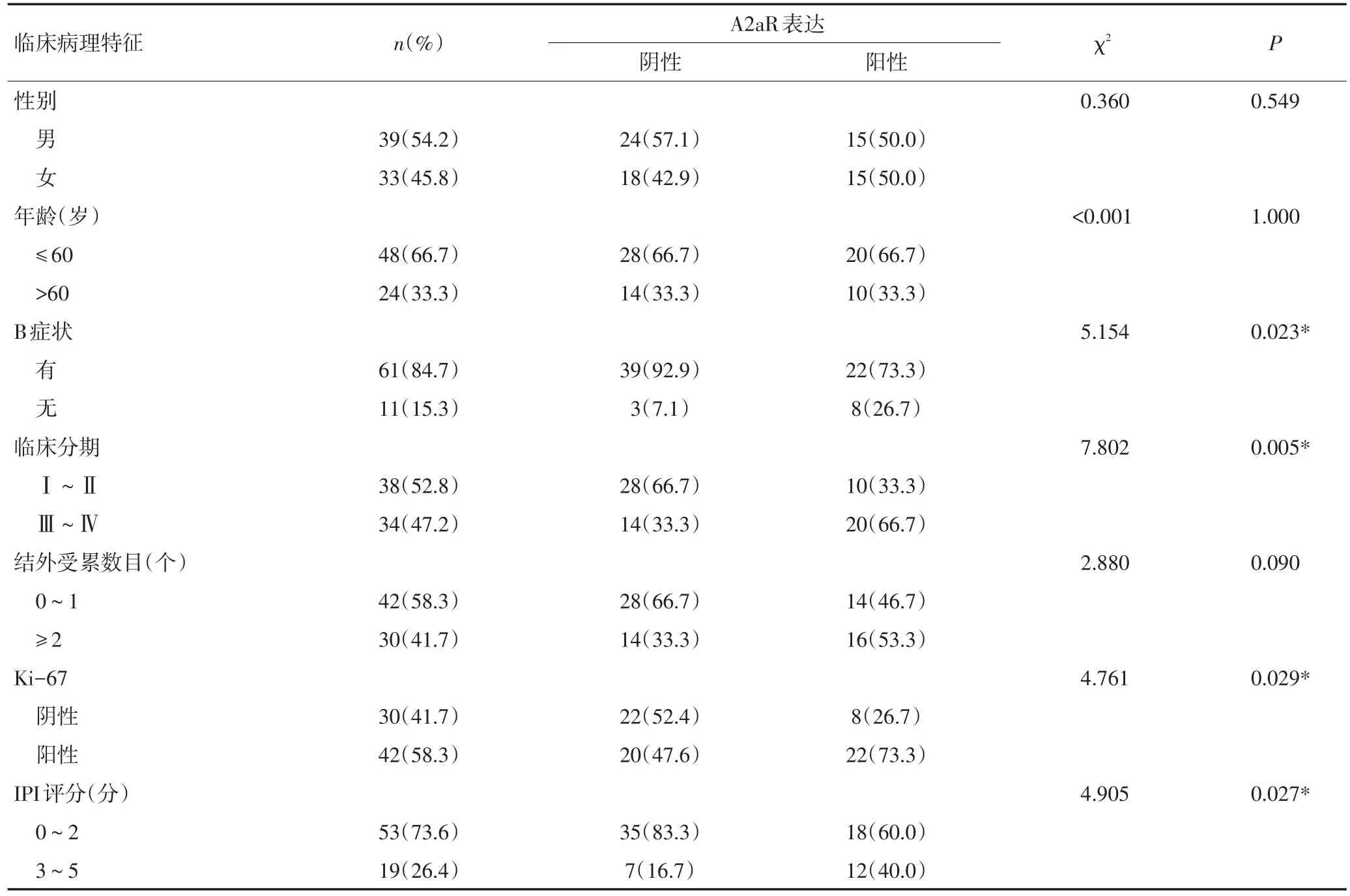
表1 A2aR總表達與患者臨床病理特征之間的關系
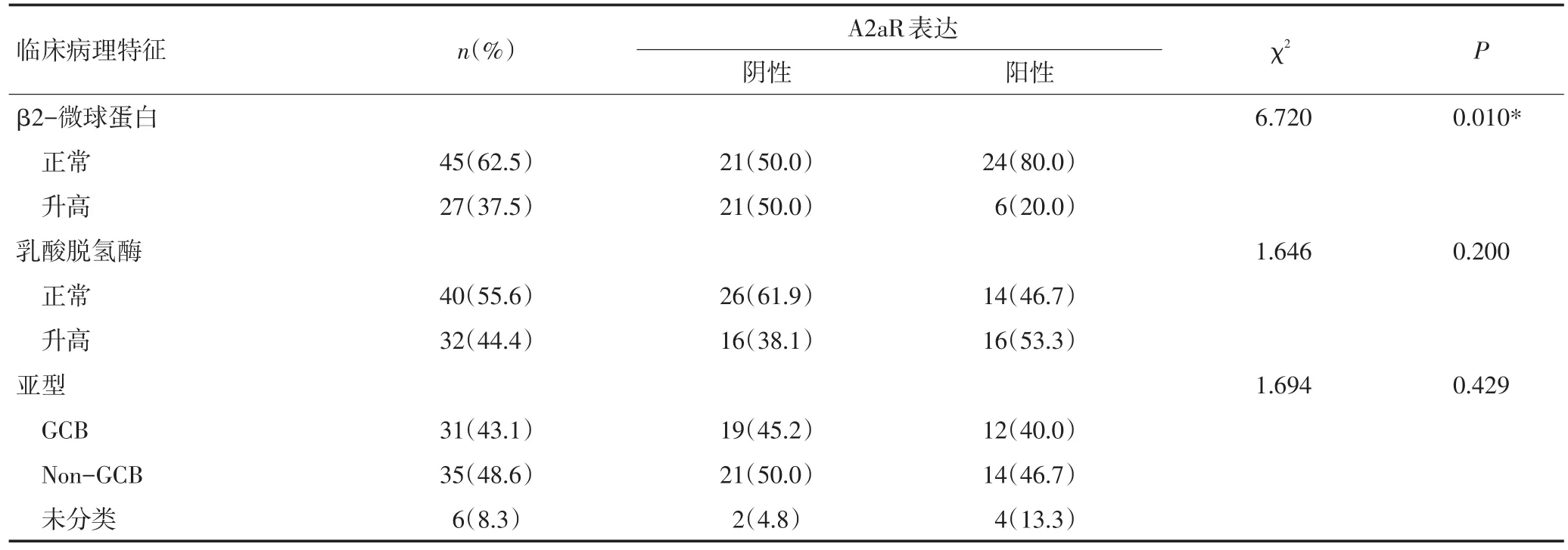
表1 A2aR總表達與患者臨床病理特征之間的關系 (續表1)
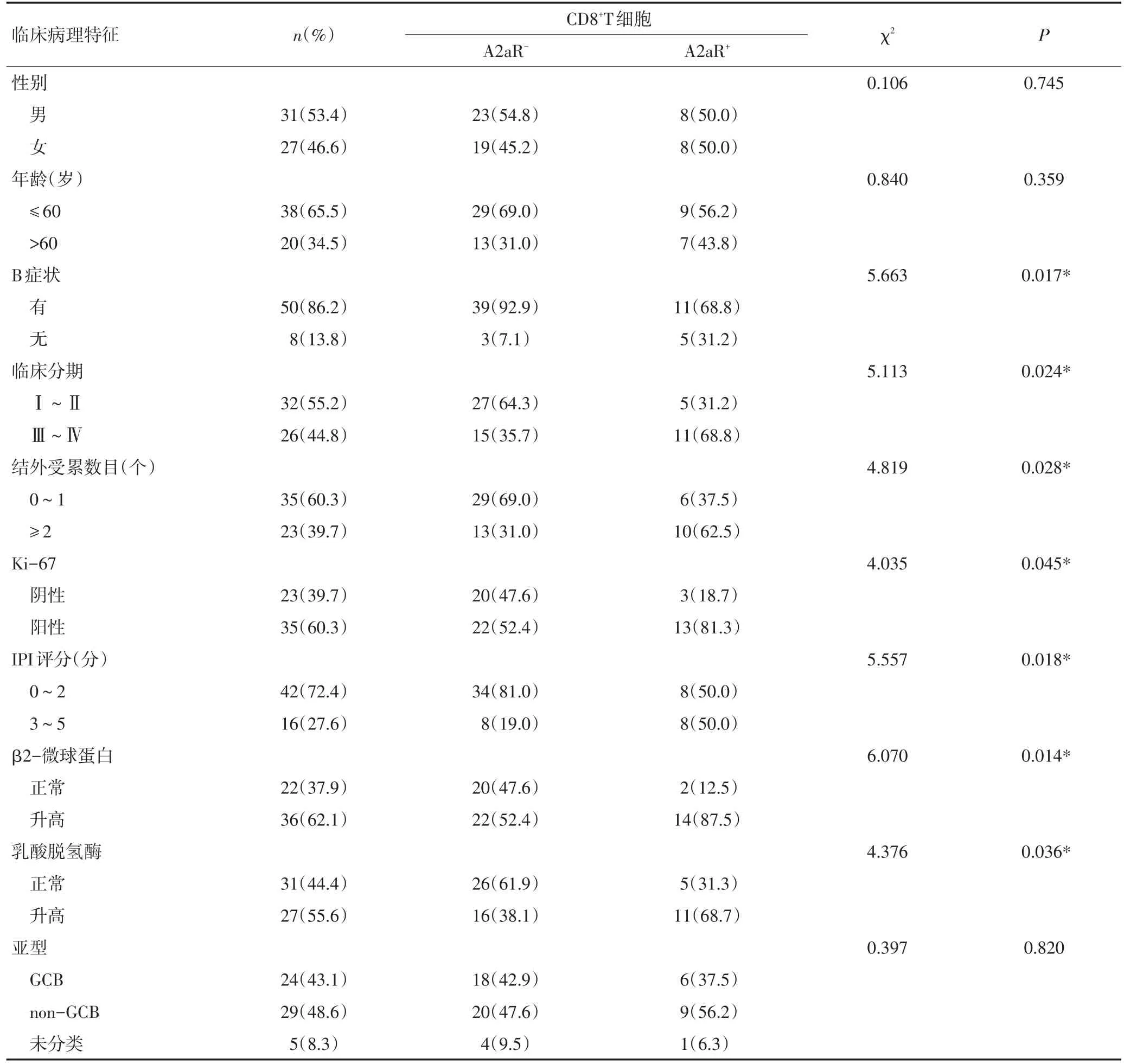
表2 CD8+T細胞上A2AR表達與患者臨床病理特征之間的關系
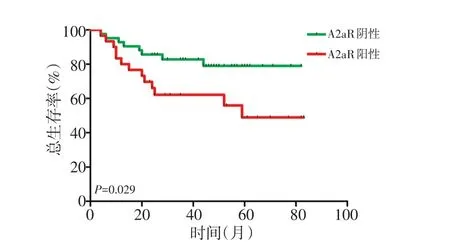
圖3 A2aR總表達與患者總生存期之間的關系
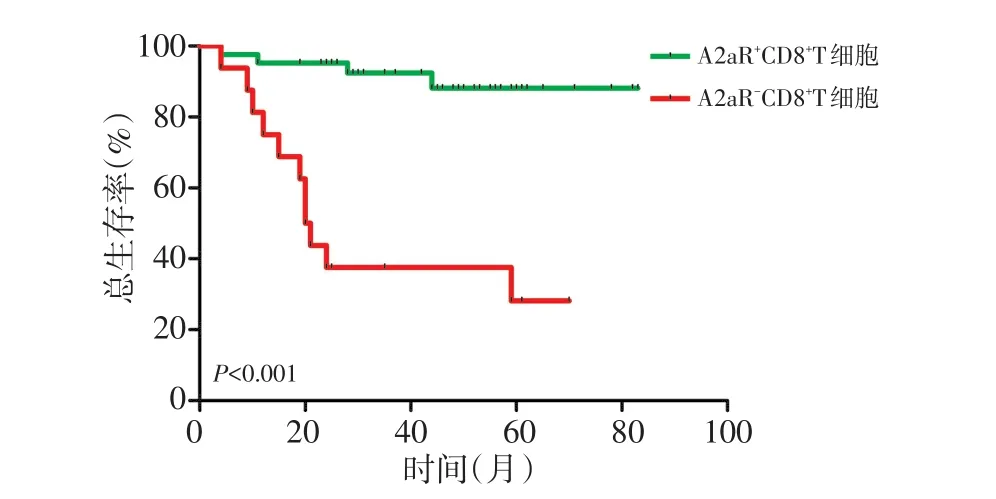
圖4 CD8+T細胞上A2AR表達與患者總生存期之間的關系
3 討論
A2aR屬于新型第二代免疫檢查點分子,是腫瘤微環境CD8+T細胞表面主要的免疫檢查點受體之一,可抑制T細胞上TCR誘導的NF-κB信號通路,抑制IL-2、IL-4、IFN-γ分泌,從而誘導效應T細胞功能失活[5]。A2aR上調T細胞表面其他免疫檢查點,如PD-1、LAG-3等[8]表達,共同介導腫瘤免疫逃逸。此外,A2aR在腫瘤微環境其他免疫細胞,如NK細胞、巨噬細胞等均有表達,通過多種途徑發揮協同免疫抑制作用[2]。目前,關于A2aR蛋白在腫瘤中的表達及臨床意義研究較少。Ma等[3]研究發現,在頭頸鱗狀細胞癌中A2aR表達與患者病理分級、腫瘤大小和淋巴結轉移相關,表明A2aR表達水平與頭頸鱗狀細胞癌惡性程度密切相關。在非小細胞肺癌中,A2aR表達與患者性別、吸煙、病理分類相關,A2aR表達越高,患者預后越好,目前尚無解釋[7]。A2aR在不同腫瘤中表達及預后價值并不相同。本研究分析了A2aR在DLBCL中表達情況和臨床病理特征之間的關系。A2aR總表達與患者分期、IPI評分、Ki-67、β2-MG相關;A2aR+組患者OS較A2aR-組患者差,表明A2aR可能是DLBCL患者不良預后因素之一。CD8+T細胞作為腫瘤浸潤淋巴細胞中效應毒性T細胞,對腫瘤細胞具有直接殺傷作用[9]。T細胞表面多重免疫檢查點的表達可通過不同信號通路抑制T細胞活性,進而抑制機體的抗腫瘤免疫反應[10]。本研究分析了CD8+T細胞上A2aR表達與患者臨床病理特征及預后的關系。A2aR+CD8+與患者分期、IPI評分、β2-MG、Ki-67、LDH、結外受累數目、B癥狀相關,A2aR+CD8+組患者OS較A2aR-CD8+組患者更差。相比A2aR總表達,定位CD8+T細胞上A2aR表達可更好地評價DLBCL患者的預后。
綜上所述,A2aR的免疫治療已顯示出潛在的臨床應用價值。A2aR抗體(PBF-509)聯合PD-1抗體治療非小細胞肺癌的臨床Ⅰ/Ⅰb期試驗(NCT02403193)正在開展。此外,動物實驗表明,聯合A2aR抗體可以降低免疫相關不良反應的發生頻率[2]。A2aR有可能成為DLBCL淋巴瘤中新的免疫治療靶點,并有望聯合其他免疫檢查點抗體應用于臨床,從而進一步提高患者的療效。

