幽門螺桿菌感染與胃癌中PRC2和H3K27me3的表達關系*
張寧 曾智 閻麗萍 楊珂 孫慶文 黃鵬
胃癌是中國常見的惡性腫瘤之一,發病和死亡人數約占世界的50%[1],其發病機制復雜,涉及多基因和多因素的共同作用,其中幽門螺桿菌(Helicobacter pylori,HP)感染與胃癌發生存在密切的關系,但其作用機理目前尚不明確。多梳抑制復合物2(polycomb repressive complex 2,PRC2)是一組轉錄抑制因子,其核心成分果蠅zeste基因增強子同源物2(enhancer of zeste homolog 2,EZH2)具有組蛋白甲基轉移酶活性,通過對組蛋白H3進行甲基化修飾,從而導致腫瘤的發生發展。目前,有關HP感染是否影響表觀調控因子PRC2的表達尚缺乏報道。本研究采用免疫組織化學法檢測胃癌組織中PRC2家族蛋白和組蛋白H3K27me3的表達情況,分析HP感染與上述蛋白表達的相關性,探索HP感染在胃癌發生發展中的作用。
1 材料與方法
1.1 材料
1.1.1 組織標本 選取復旦大學附屬上海市第五人民醫院2014年1月至2017年10月行胃癌手術的84例患者,其中男性55例,女性29例,平均年齡53歲。所有患者術前未經任何抗腫瘤治療且術后均得到明確的病理診斷。本研究通過醫院倫理委員會審查[批號:(2017)倫審(060備)],所有患者簽署知情同意書。
1.1.2 主要試劑 HP快速尿素酶法檢測試劑盒購于山東博邁達生物科技有限公司;DNA提取和PCR試劑盒購自天根生化科技公司;免疫組織化學試劑盒購自福州邁新公司;EZH2抗體購自美國Cell Signaling Technology公司,SUZ12、EED和H3K27me3抗體購自英國Abcam公司。
1.2 方法
1.2.1 標本采集 取手術切除的胃癌組織并在距癌灶5 cm處取癌旁組織。胃癌標本分成3份,1份經10%中性甲醛固定,常規石蠟包埋,制片,用于HP染色和免疫組織化學檢測;1份用于快速尿素酶檢測;1份置于-80℃冰箱保存用于PCR檢測。
1.2.2 HP快速尿素酶檢測 新鮮胃黏膜(1 mm3)取樣后立即置于加有底物反應液的試管內,充分震蕩,室溫靜置5 min,觀察試管內液體顏色。如果呈黃色,為陰性;如果呈淺紅色~玫瑰紅色,為陽性。
1.2.3 HP染色 采用改良的Giemsa染色法檢測HP。石蠟切片脫蠟至水,置于0.5%鹽酸酒精中10 min,充分水洗后將切片置于Giemsa工作液中經微波爐加熱2~4 min。然后用1%冰醋酸快速浸洗,水洗,脫水,透明,封片。
1.2.4 PCR檢測 1)組織DNA提取:將凍存的胃組織剪碎、勻漿,加入20 μL蛋白酶K(20 mg/mL),55℃水浴1 h完全消化后按照試劑盒說明書操作,提取DNA進行純度測定;2)引物設計:針對VacA基因設計引物如下:F':5-GGAGCCCCAGGAAACATTG-3',R:5'-CTGCTTG AATGCGCCAAAC-3'。引物由上海生工生物工程技術服務有限公司合成;3)PCR反應條件:反應總體積為50 μL,上、下游引物各2 μL,應用Touchdown PCR方法擴增基因,94℃預變性4 min,94℃變性0.5 min,自65℃~50℃每降3℃循環3次,最后1個溫度循環15次,所有循環結束后,72℃延伸10 min。
1.2.5 免疫組織化學法檢測 石蠟切片脫蠟至水,微波修復抗原10 min,PBS洗滌,3%過氧化氫孵育20 min。山羊血清37℃封閉30 min,洗滌,分別滴加兔抗人EZH2抗體(1:200)、SUZ12抗體(1:100)、EED抗體(1:200)和鼠抗人H3K27me3抗體(1:100),4℃過夜。PBS洗滌后,分別滴加羊抗兔和兔抗鼠二抗工作液,溫箱中孵育30min。滴加辣根過氧化物酶標記鏈酶卵白素,孵育30 min,DAB顯色,終止反應。結腸癌和乳腺癌組織(由上海健康醫學院基礎醫學院病理教研室收集與提供)用作陽性對照,陰性對照用PBS替代一抗。
1.2.6 免疫組織化學結果判讀 隨機選取5個高倍鏡視野(×400),計數腫瘤細胞總數和陽性細胞數,計算陽性細胞百分比,以≤25%為0分,26%~50%為1分,51%~75%為2分,>75%為3分;對染色強度進行計分,無顯色為0分,淺棕黃色為1分,棕黃色為2分,棕褐色為3分。將上述兩項得分相加,≥3分定義為陽性,<3分定義為陰性。所有切片均由兩名病理醫生獨立閱片和判讀。
1.3 統計學分析
采用SPSS 19.0軟件進行統計學分析。計數資料以百分率(%)表示,PRC2家族和H3K27me3蛋白的表達,以及與HP感染和臨床病理資料之間的關系采用χ2檢驗。以P<0.05為差異具有統計學意義。
2 結果
2.1 HP檢測結果
84例胃癌患者,HP快速尿素酶檢測法檢出率為70.24%(59/84)。Giemsa染色顯示胃黏膜細胞胞質呈粉紅色,胞核呈藍色或紫色,HP呈淡藍色或藍色,彎曲狀或弧形(圖1A),HP檢出率為61.90%(52/84)。電泳結果顯示,VacA基因擴增電泳條帶分子量為353 bp(圖1B),PCR檢測陽性率為76.19%(64/84)。3種檢測方法中任一結果為陽性者均判為陽性。
2.2 PRC2家族和H3K27me3蛋白在胃癌組織中的表達
PRC2家族中3個成員EZH2、SUZ12和EED以及H3K27me3蛋白在胃癌組織中的表達均定位于細胞核,為棕黃色顆粒(圖2A~D)。EZH2、SUZ12、EED和H3K27me3蛋白在胃癌組織的陽性表達率分別為79.76%(67/84)、77.38%(65/84)、40.48%(34/84)和69.05%(58/84),均顯著高于癌旁組織(22.60%、34.52%、8.33%和14.29%),差異具有統計學意義(P<0.05,表1)。
2.3 EZH2和H3K27me3蛋白表達與胃癌臨床病理特征的關系
本研究分析了EZH2和H3K27me3蛋白表達與胃癌臨床病理指標的關系,發現EZH2和H3K27me3的表達與淋巴結轉移相關,發生淋巴結轉移的病例EZH2和H3K27me3蛋白表達均顯著高于無淋巴結轉移的病例(P<0.05,表2),與胃癌患者性別、年齡、腫瘤大小、浸潤深度、Lauren分型、分化程度、TNM分期和生存時間均無顯著相關性。
2.4 胃癌組織中PRC2和H3K27me3蛋白表達與HP感染的關系
在HP陽性胃癌組織中,EZH2、SUZ12、EED和H3K27me3蛋白的陽性表達率分別為89.06%(57/64)、84.38%(54/64)、46.88%(30/64)和82.81%(53/64),均顯著高于HP陰性胃癌組織(50.00%、55.00%、20.00%和25.00%,P<0.05)。差異具有統計學意義(P<0.05,表3)。
2.5 胃癌組織中EZH2與H3K27me3蛋白表達的關系
胃癌組織中,67例EZH2表達陽性的病例中H3K27me3蛋白陽性表達率為74.63%(50/67),17例EZH2表達陰性的病例中H3K27me3蛋白陽性表達率為47.06%(8/17),前者顯著高于后者,差異具有統計學意義(P<0.05),EZH2與H3K27me3蛋白的表達呈正相關(表4)。
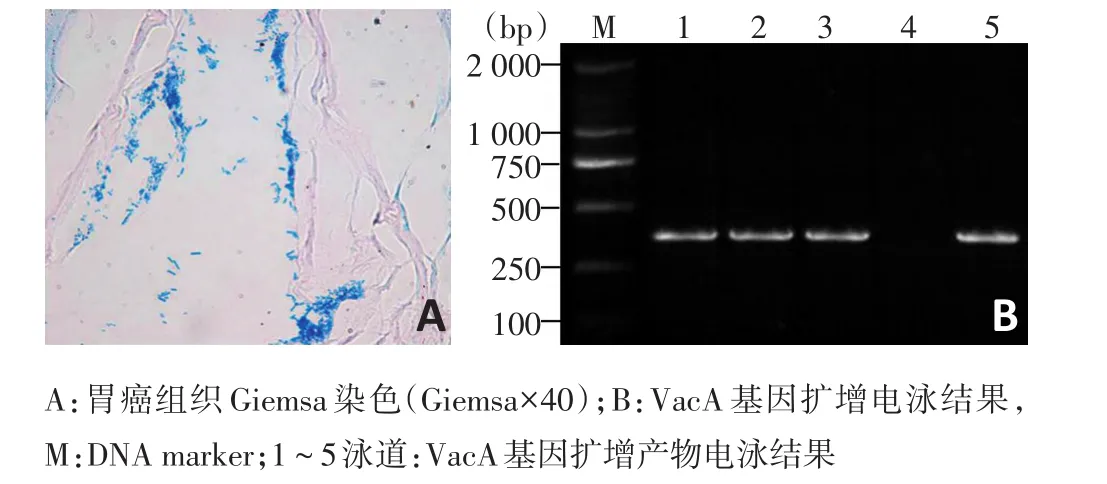
圖1 HP檢測結果
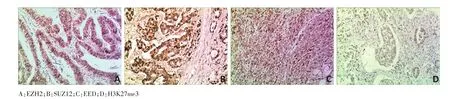
圖2 PRC2家族蛋白和H3K27me3在胃癌組織中的表達(SP法×40)

表1 PRC2家族蛋白在胃癌組織及癌旁組織中的表達
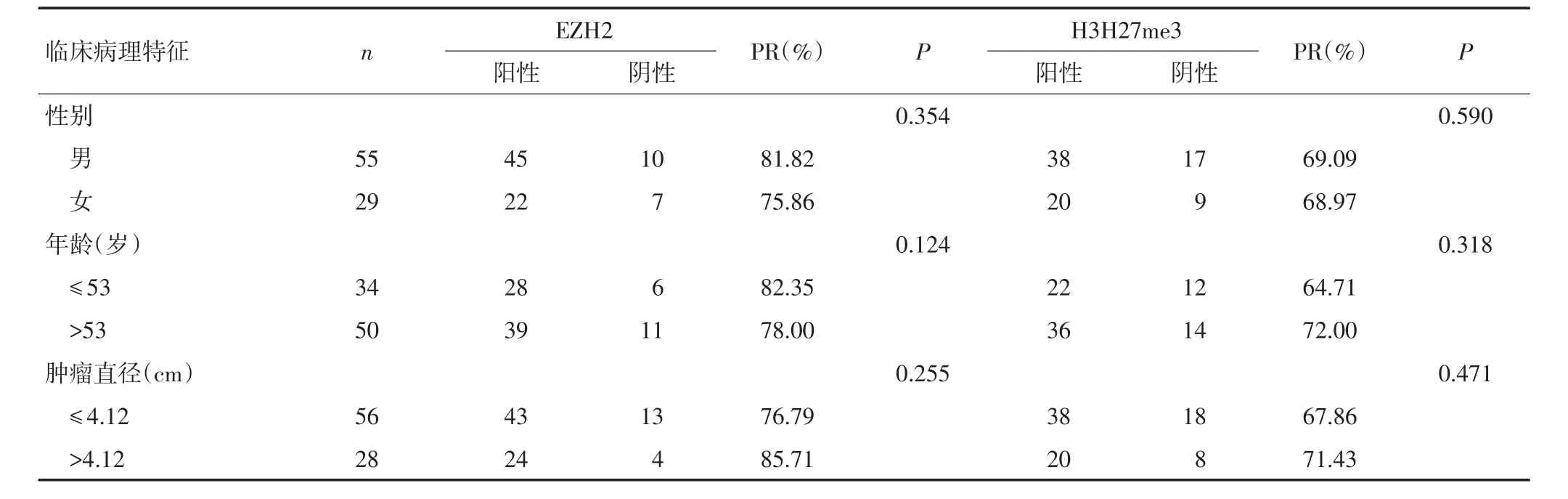
表2 EZH2和H3H27me3蛋白表達與胃癌臨床病理特征的關系
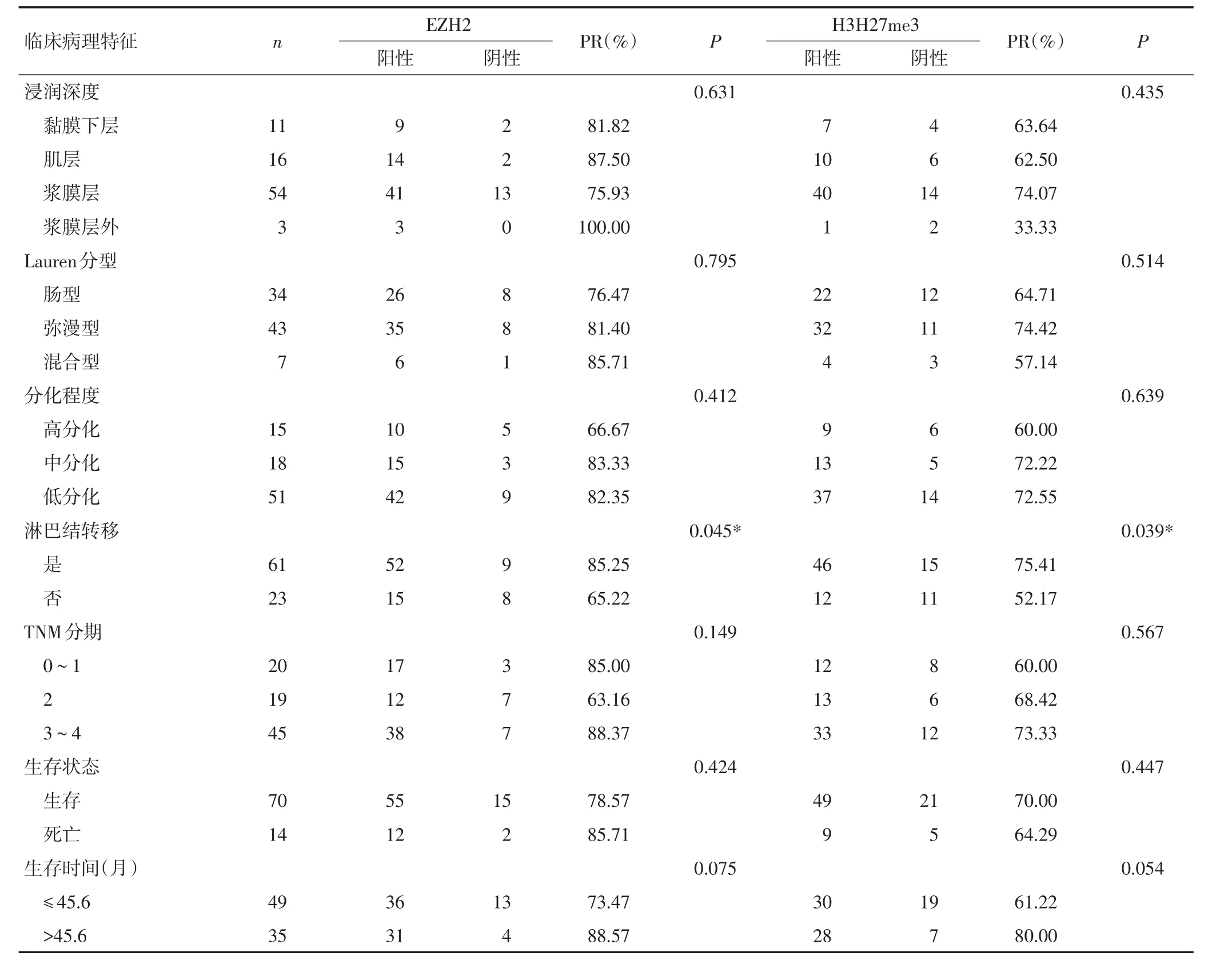
表2 EZH2和H3H27me3蛋白表達與胃癌臨床病理特征的關系(續表2)

表3 PRC2和H3K27me3蛋白在HP陽性及陰性胃癌組織中的表達
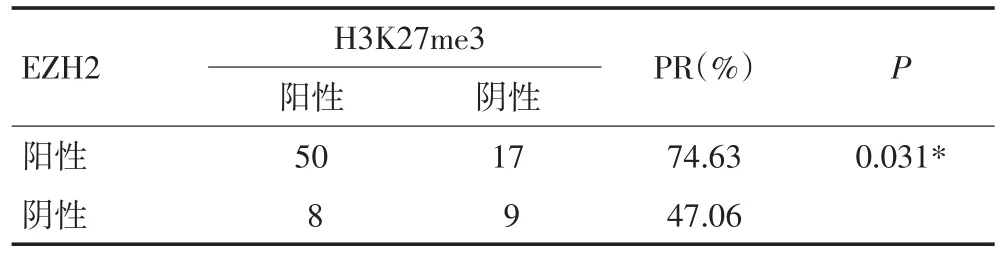
表4 胃癌組織中EZH2和H3K27me3蛋白表達的關系
3 討論
近年來,中國胃癌的發病率不斷升高,在胃癌高發地區,成人HP感染率超過56%[2]。HP致癌機制與尿素酶造成的胃黏膜屏障損傷、空泡細胞毒素(VacA)和細胞毒素相關蛋白(CagA)引起的基因突變和免疫反應有關。有研究發現,HP感染可顯著提高水通道蛋白(Aquaporin 3)和缺氧誘導因子(hypoxia inducible factor 1α,HIF-1α)表達,使人胃癌細胞AGS和GES-1活性氧含量增加,加重胃黏膜上皮細胞損傷[3];還可以調節環氧化酶-2(cyclooxygenase-2,COX-2)和15羥基前列腺素脫氫酶(15 hydroxy prostaglandin dehydrogenase,15PGDH)表達進而使前列腺素E2水平上升[4];此外,還可通過轉錄因子NF-κB上調miR-223-3p表達,進而抑制其下游靶基因ARID1A表達,促進胃癌細胞增殖和轉移[5]。MABK通路中EGFR、RAF和MERK等分子在HP感染時表達上調,進而引發高胃泌素血癥[6]。HP感染還可通過miR-181b激活IL-6/STAT3信號途徑,進而抑制尾型同源盒轉錄因子(caudal type homeobox transcription factor 2,CDX2)表達和p53信號通路,導致胃癌預后不良[7]。目前,有關HP致癌機制的研究雖然取得了一定進展,但仍未完全闡述清楚,特別是HP感染是否影響表觀調控因子的表達。本研究通過分析HP感染與胃癌組織PRC2家族蛋白和組蛋白H3K27me3表達的相關性,尋找其可能的致癌機制。
PRC2是一組轉錄抑制因子,核心成分EZH2基因位于7q35,其編碼產物能對組蛋白進行甲基化修飾,維持下游靶基因沉默,從而誘導腫瘤的發生發展。多項研究表明,EZH2在惡性腫瘤中表達上調,并與腫瘤的侵襲和轉移相關,是預后不良的指標[8-13]。本研究結果顯示,EZH2蛋白在胃癌組織中的陽性表達率顯著高于癌旁組織,且與淋巴轉移相關,這與既往文獻報道相一致[12-13]。Chen等[14]研究表明,EZH2在胃癌組織中高表達,且與腫瘤的大小、浸潤深度、轉移及臨床分期有關,本研究發現上述因素與胃癌組織中EZH2的表達均無顯著相關性。Mattioli等[15]研究發現,EZH2表達水平與腫瘤類型有關,在腸型胃癌中的表達明顯高于彌漫型胃癌。本研究結果顯示,EZH2的表達水平與胃癌Lauren分型無關。EZH2單獨存在時不具有組蛋白甲基轉移酶活性,需要在PRC2家族另外兩個成員SUZ12和EED的共同參與下構成復合物,才能發揮酶活性。由此可見,SUZ12和EED對于維持復合物結構的穩定性和EZH2的酶活性是必需的[16-18]。有研究報道,SUZ12在結直腸癌、肝癌和乳腺癌中表達均上調[19-20]。本研究對SUZ12和EED蛋白的表達進行分析,結果表明胃癌組織中SUZ12和EED蛋白的表達率顯著高于癌旁組織。
組蛋白是染色質的基本組成單位,尾部某些氨基酸殘基發生修飾后可以改變染色質的結構,從而影響基因的表達。組蛋白H3的N末端賴氨酸殘基K27(H3K27)是最常見的甲基化修飾位點,三甲基化修飾后的組蛋白H3K27me3能抑制下游靶基因的轉錄,從而調控基因的表達。有關H3K27me3蛋白在腫瘤中的表達水平和臨床意義的報道不盡相同,在肝細胞癌和膀胱癌中表達上調且預后不良[21-22],而在乳腺癌、卵巢癌和胰腺癌中表達均下調,且與預后不良相關[23]。作為EZH2的甲基化修飾對象,本研究對H3K27me3蛋白的表達進行分析,結果顯示該蛋白在胃癌組織中的表達顯著高于癌旁組織,且與淋巴結轉移相關。
本研究對胃癌組織中PRC2家族蛋白表達與HP感染的相關性進行分析,結果顯示該家族蛋白在HP陽性胃癌組織中的表達顯著高于HP陰性胃癌組織,提示HP感染不僅與PRC2家族核心成員EZH2表達上調呈正相關,還與該家族中另外兩個成員SUZ12和EED表達上調也相關。進一步分析HP感染與胃癌組織中H3K27me3蛋白表達的關系發現,H3K27me3在HP陽性胃癌組織中的表達顯著高于HP陰性胃癌組織,且與EZH2蛋白表達呈正相關,提示HP感染與H3k27me3蛋白的表達相關。
綜上所述,HP感染與胃癌組織中PRC2和H3K27me3蛋白表達上調相關,這為闡述病原體對宿主轉錄調控的影響提供了新的證據,也為探索HP致癌機制提供了新思路。但HP是否直接影響胃癌細胞中PRC2的表達,尚需進一步研究證實。

