DEHP和MEHP對H295R細(xì)胞類固醇激素合成基因表達(dá)的影響
葉婷,董四君,王佳,楊丹,楊文佳,李燦,*
1. 貴陽學(xué)院生物與環(huán)境工程學(xué)院 貴州省山地珍稀動物與經(jīng)濟(jì)昆蟲重點(diǎn)實(shí)驗(yàn)室,貴陽 550005 2. 中國科學(xué)院城市環(huán)境研究所 中國科學(xué)院城市環(huán)境與健康重點(diǎn)實(shí)驗(yàn)室,廈門 361021 3. 泰山醫(yī)學(xué)院公共衛(wèi)生學(xué)院,泰安 271016
鄰苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl)-phthalate, DEHP)作為增塑劑普遍用于聚氯乙烯(poly vinyl chloride, PVC)材料中,如地板、電纜和房屋裝飾材料等建筑材料,還普遍用于血袋、血管和透析儀等醫(yī)療器械[1]。DEHP與聚氯乙烯材料不是以化學(xué)鍵結(jié)合,而是以普通的分子間作用力結(jié)合,所以容易從塑料材料中釋放進(jìn)入環(huán)境中[2],然后通過食物鏈在生物體內(nèi)富集,引起神經(jīng)、免疫、肝臟、生殖等毒性作用[3-4]。人體通過食品攝入、呼吸空氣、飲用水、皮膚吸收及靜脈注射等多種途徑暴露于DEHP[5-7],其中攝入被DEHP污染的食品是暴露DEHP的主要途徑,人體內(nèi)超過90%的DEHP來自食品攝入[8]。DEHP進(jìn)入機(jī)體后,一部分以原型直接被吸收,另一部分受胰腺酶和腸道內(nèi)一些酶的作用,迅速由雙酯轉(zhuǎn)化為單酯,主要代謝產(chǎn)物是鄰苯二甲酸單(2-乙基己基)酯(mono-(2-ethylhexyl)phthalate, MEHP)[9]。很多哺乳動物研究顯示DEHP的代謝產(chǎn)物MEHP的毒性效應(yīng)強(qiáng)于DEHP,并且DEHP產(chǎn)生的毒性效應(yīng)主要是由其代謝產(chǎn)物引起的[10]。許多動物研究表明DEHP和MEHP影響了類固醇合成活性[3-4],但對其機(jī)制缺乏系統(tǒng)的認(rèn)識。目前大多數(shù)關(guān)于DHEP和MEHP的研究局限于體內(nèi)研究,而且關(guān)于DEHP和MEHP對類固醇激素合成的影響,還沒有相關(guān)體外研究進(jìn)行全面的評價。Harvey等[11]提出了H295R細(xì)胞系類固醇合成干擾實(shí)驗(yàn)可作為評價化學(xué)物對類固醇激素生成過程干擾的策略,并指出H295R細(xì)胞系是一種有效的體外篩選環(huán)境類固醇激素干擾物的細(xì)胞模型。美國國家環(huán)境保護(hù)署也正在建立利用H295R細(xì)胞系檢測環(huán)境污染物對類固醇激素生成干擾效應(yīng)的方法來研究環(huán)境中污染物的內(nèi)分泌干擾效應(yīng)[12]。相對基于組織評價類固醇激素干擾的方法,H295R細(xì)胞評價的優(yōu)勢還在于它能評價環(huán)境中的污染物對細(xì)胞活力和細(xì)胞毒性的影響,這是一個重要的特征,以區(qū)別化學(xué)物是通過直接的細(xì)胞毒性作用還是間接的生成類固醇通路的影響產(chǎn)生效應(yīng),這點(diǎn)是體外培養(yǎng)的多細(xì)胞組織方法不能做到的。并且H295R細(xì)胞容易獲得、培養(yǎng)簡單并可穩(wěn)定傳代,可有效代替動物和組織實(shí)驗(yàn)方法,簡單且經(jīng)濟(jì)。因此H295R細(xì)胞系成為體外篩選環(huán)境類固醇激素干擾物及研究其機(jī)制的最具潛力的工具,能同時從基因表達(dá)、酶活力和激素水平幾個層面進(jìn)行檢測[13]。
本研究采用H295R細(xì)胞模型類固醇激素合成干擾試驗(yàn),從細(xì)胞活力、類固醇激素合成關(guān)鍵基因表達(dá)、關(guān)鍵調(diào)控因子和關(guān)鍵受體的基因表達(dá)等方面,對DEHP及其主要代謝產(chǎn)物MEHP的類固醇激素合成干擾效應(yīng)進(jìn)行分子機(jī)制層面的研究。
1 材料與方法(Materials and methods)
1.1 實(shí)驗(yàn)材料
人腎上腺皮質(zhì)腺癌細(xì)胞H295R細(xì)胞系購自國家實(shí)驗(yàn)細(xì)胞資源共享平臺。細(xì)胞培養(yǎng):H295R細(xì)胞系常規(guī)培養(yǎng)于37 ℃、5%CO2恒溫培養(yǎng)箱中。細(xì)胞培養(yǎng)采用DMEM/F12(1∶1)培養(yǎng)基,培養(yǎng)基中需添加成分包括2.5% Nu-Serum I,15 mmol·L-1HEPES,0.00625 mg·mL-1insulin+0.00625 mg·mL-1transferrin+6.25 ng·mL-1selenium+1.25 mg·mL-1bovine serum albumin+0.00535 mg·mL-1linoleic acid。2~3 d更換一次培養(yǎng)液,待細(xì)胞單層生長至80%~95%后,用PBS溶液輕洗2次,加入適量0.05%胰酶-EDTA溶液消化2 min,800~1 000 r·min-1離心5 min后棄上清液,加入培養(yǎng)基重懸細(xì)胞,按照1∶3比例傳代。
1.2 儀器與試劑
儀器:CO2細(xì)胞恒溫培養(yǎng)箱(日本SANYO公司);Spectra Max M5多功能酶標(biāo)儀(美國Molecular Devices公司);HR40-IIA2超凈工作臺(中國Haier公司);UNIVERSAL 320R臺式(常溫/低溫)離心機(jī)(德國Hettich Zentrifugen公司);ND1000超微量紫外可見分光光度計(jì)(美國Gene Companey Limited公司);Mastercycler?personal PCR儀(德國EPPENDORF公司),Lightcycler 480實(shí)時熒光定量PCR儀(瑞士Roche公司);生物顯微鏡(上海長方光學(xué)儀器有限公司,中國);Cascada I超純凈水系統(tǒng)(美國Cascada公司);HS-840-U無菌工作臺(中國蘇州安泰空氣技術(shù)有限公司);細(xì)胞培養(yǎng)瓶、培養(yǎng)板(丹麥NUNC公司)。
試劑:DEHP,優(yōu)級純,購于美國Supelco公司,溶于二甲基亞砜(DMSO,優(yōu)級純,美國Sigma-Aldrich公司),濃度為1 g·mL-1,將母液用DMSO稀釋至0.001 g·mL-1備用;MEHP,優(yōu)級純,購于美國AccuStandard公司。將MEHP用DMSO配成0.001 g·mL-1母液備用;DMEM/F12(1∶1)(美國,HyClone公司);胎牛血清(美國,Life Technologies公司);0.05%胰酶EDTA溶液(美國,Life Technologies公司);Hepes(美國,Sigma公司);Nu Serum I(美國,BD Biosciences公司);MTT(美國,Sigma公司);ITS+Premix A(美國,Life Technologies公司);RNA提取試劑盒(美國,Omega生物技術(shù)公司);反轉(zhuǎn)錄試劑盒(PrimeScriptTM RT-PCR Kit,寶生物工程(大連)有限公司);SYBR Premix Ex TaqTM試劑盒(寶生物工程(大連)有限公司)。
1.3 MTT實(shí)驗(yàn)
MTT法檢測細(xì)胞活力的實(shí)驗(yàn)原理是活細(xì)胞線粒體中存在的琥珀酸脫氫酶可以使黃色的MTT還原為不溶性的藍(lán)紫色結(jié)晶化合物甲瓚(formazan)沉積于細(xì)胞內(nèi),而死細(xì)胞中此酶消失,MTT不能被還原。在一定細(xì)胞數(shù)范圍內(nèi),甲瓚形成的量與活細(xì)胞數(shù)目成正比。二甲基亞砜(DMSO)溶解細(xì)胞中的甲瓚后,用酶標(biāo)儀檢測490 nm波長處的吸收值,從而間接反映活細(xì)胞數(shù)量。MTT法檢測細(xì)胞活力具體的實(shí)驗(yàn)步驟為:用胰酶-EDTA溶液消化對數(shù)期H295R細(xì)胞并收集計(jì)數(shù),然后調(diào)整細(xì)胞懸液濃度,每孔加入100 μL細(xì)胞懸液,細(xì)胞接種密度根據(jù)細(xì)胞生長速度調(diào)整約為1×103~1×105個細(xì)胞/孔,邊緣孔用無菌PBS填充,5% CO2、37 ℃培養(yǎng)24 h。隨后,棄去培養(yǎng)基,DEHP和MEHP母液用DMSO和培養(yǎng)基稀釋,調(diào)節(jié)各孔DMSO含量為0.1%,加入用新培養(yǎng)基稀釋的不同濃度的DEHP和MEHP(0、1、10、100、1 000 μmol·L-1)在5%CO2、37 ℃繼續(xù)培養(yǎng)24 h,接著,每孔加入10 μL MTT溶液(5 mg·mL-1,即0.5% MTT),繼續(xù)培養(yǎng)4 h。小心吸去孔內(nèi)培養(yǎng)液,每孔加入150 μL DMSO,置搖床上低速振蕩10 min,使結(jié)晶物充分溶解。在酶標(biāo)儀OD 490 nm或者550 nm處測量各孔的吸光值。同時設(shè)置調(diào)零孔(含有培養(yǎng)基、MTT和DMSO),對照孔(含有細(xì)胞、培養(yǎng)液、MTT、DMSO)。細(xì)胞存活率%=[(染毒孔OD-調(diào)零孔OD)/(對照孔OD-調(diào)零孔OD)]×100%。
1.4 RT-PCR分析H295R細(xì)胞基因表達(dá)變化
將H295R細(xì)胞接種到6孔板中,每孔2 mL,在37 ℃、5%CO2培養(yǎng)箱內(nèi)培養(yǎng)24 h后,除去舊培養(yǎng)基,用新鮮的培養(yǎng)基將DEHP和MEHP配制成以下濃度:0、1、10、100 μmol·L-1染毒,繼續(xù)培養(yǎng)24 h。接著,除去培養(yǎng)液,用PBS洗2次,細(xì)胞染毒后總RNA的提取采用Omega RNA提取試劑盒,流程按照說明書進(jìn)行,稍加改動,改動如下:染毒后的細(xì)胞,增加了消化步驟以獲得更多的細(xì)胞,然后每孔加入1 mL RNA-Solv Reagent,用槍頭反復(fù)吹打,使細(xì)胞充分裂解;為了使得細(xì)胞充分裂解,低溫冰上孵育較長時間(10 min左右)。提取后采用分光光度法鑒定RNA質(zhì)量,測定RNA濃度,采用反轉(zhuǎn)錄試劑盒進(jìn)行反轉(zhuǎn)錄,獲得cDNA。用SYBR Premix Ex TaqTM試劑盒在羅氏480儀器上進(jìn)行熒光定量PCR反應(yīng)。用于熒光定量PCR的引物序列見表1。以GAPDH為內(nèi)參基因,采用2-ΔΔCT方法分析各染毒組mRNA水平相對于對照組的變化倍數(shù)[14]。

圖1 鄰苯二甲酸二(2-乙基己基)酯(DEHP)和鄰苯二甲酸單(2-乙基己基)酯(MEHP)對H295R細(xì)胞活性的影響注:數(shù)值以Mean±SEM (n=6)表示;與對照相比,* P<0.05,** P<0.01。Fig. 1 Effects of di-(2-ethylhexyl)-phthalate (DEHP) and mono (2-ethylhexyl) phthalate (MEHP) on cell viability of H295R cellsNote: the representative data are expressed as the mean±SEM, n=6 for each replicate. *P < 0.05, **P < 0.01 vs. control.
1.5 數(shù)據(jù)統(tǒng)計(jì)分析
所有實(shí)驗(yàn)數(shù)據(jù)采用平均值±標(biāo)準(zhǔn)誤差表示。并進(jìn)行方差齊性檢驗(yàn)和正態(tài)性檢驗(yàn),如有必要需進(jìn)行對數(shù)轉(zhuǎn)換。采用SPSS16.0軟件進(jìn)行單因素方差分析(One-Way AVONA)和Turkey’s檢驗(yàn)。置信水平P<0.05時差異顯著。
2 結(jié)果(Results)
2.1 DEHP和MEHP對H295R細(xì)胞活力的影響
為了檢測DEHP和MEHP對H295R細(xì)胞的毒性,同時為了確定類固醇合成實(shí)驗(yàn)的處理劑量,本研究采用MTT法對細(xì)胞的活性進(jìn)行分析。如圖1所示,用DEHP處理H295R細(xì)胞24 h后,同對照相比,10和100 μmol·L-1DEHP使細(xì)胞活性略有下降,但差異未達(dá)到統(tǒng)計(jì)學(xué)意義;1 000 μmol·L-1DEHP使細(xì)胞活力顯著降低(P<0.05)(圖1)。MEHP處理H295R細(xì)胞24 h后,同對照相比,10和100 μmol·L-1MEHP使細(xì)胞活性略有下降,但差異未達(dá)到統(tǒng)計(jì)學(xué)意義;1 000 μmol·L-1MEHP使細(xì)胞活力顯著降低(P<0.01)(圖1)。為了檢測類固醇合成相關(guān)基因表達(dá)的改變,DEHP和MEHP的處理劑量應(yīng)保持低于對細(xì)胞致死效應(yīng)較強(qiáng)的劑量。因此在H295R類固醇合成實(shí)驗(yàn)中選擇了0、1、10、100 μmol·L-1DEHP和MEHP。
2.2 DEHP對H295R細(xì)胞類固醇激素合成通路的影響
在細(xì)胞活力測試中,1 000 μmol·L-1DEHP和MEHP對H295R細(xì)胞染毒24 h顯著降低H295R細(xì)胞活力,對細(xì)胞活力影響較強(qiáng),所以本研究采用了較低的染毒濃度(0、1、10和100 μmol·L-1)對H295R細(xì)胞染毒24 h來評估DEHP和MEHP對H295R細(xì)胞類固醇合成通路的影響。H295R細(xì)胞暴露于DEHP和MEHP(0、1、10、100 μmol·L-1)24 h后,檢測細(xì)胞類固醇激素合成過程中關(guān)鍵酶基因(CYP11A、CYP11B1、CYP11B2、CYP17、CYP19a、CYP21、17β-HSD1、17β-HSD4、3β-HSD1、3β-HSD2、STAR)和關(guān)鍵調(diào)控因子NR5A1基因表達(dá)水平的變化。
如圖2所示,與對照相比,1、10和100 μmol·L-1DEHP對H295R細(xì)胞系染毒24 h后,對編碼類固醇合成通路涉及的多種酶CYP11A、CYP21、CYP11B1、CYP17、3β-HSD1、17β-HSD1、17β-HSD4、CYP19a和STAR的基因表達(dá)水平無顯著影響。Nuclear receptor subfamily 5、group A、member 1 (NR5A1/SF-1)類固醇合成因子是在類固醇合成組織中起到關(guān)鍵作用的核受體,在腎上腺和性腺的功能和發(fā)育過程中起到關(guān)鍵的調(diào)節(jié)作用。DEHP對關(guān)鍵類固醇合成因子NR5A1基因表達(dá)水平也無顯著影響。然而,1、10和100 μmol·L-1DEHP顯著增加醛固酮合成酶CYP11B2的基因表達(dá)水平(P<0.01)。10 μmol·L-1DEHP顯著上調(diào)了3-β羥基類固醇脫氫酶(3β-HSD2)的基因表達(dá)水平(P<0.01)。
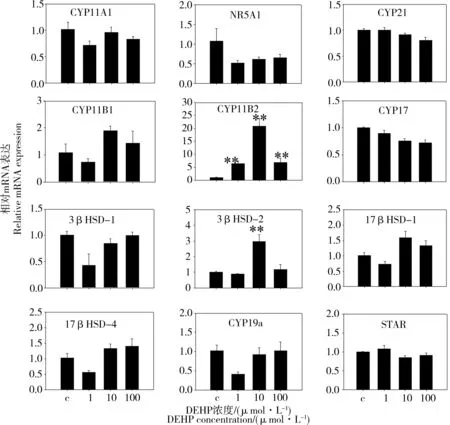
圖2 DEHP暴露對H295R細(xì)胞類固醇合成通路相關(guān)基因表達(dá)的影響注:數(shù)值以Mean±SEM表示(n=3);與對照組相比,* P<0.05,** P<0.01。Fig. 2 Effects of DEHP on the expression of steroidogenic genes in the H295R cellsNote: the representative data are expressed as the mean±SEM, n=3 for each replicate. *P < 0.05, **P < 0.01 vs. control.
2.3 MEHP對H295R細(xì)胞類固醇激素合成通路的影響
如圖3所示,與對照相比,1、10和100 μmol·L-1MEHP對H295R細(xì)胞系染毒24 h后,對編碼類固醇合成通路涉及的多種酶如側(cè)鏈裂解酶CYP11A、CYP11B1和關(guān)鍵類固醇合成因子NR5A1基因表達(dá)水平也無顯著影響。然而,與對照相比,1、10和100 μmol·L-1MEHP顯著下調(diào)了3-β羥基類固醇脫氫酶(3β-HSD1和3β-HSD2)、17β羥基類固醇脫氫酶17β-HSD4、17α羥化酶/17,20裂解酶CYP17和芳香酶CYP19a的基因表達(dá)水平。10和100 μmol·L-1MEHP染毒H295R 24 h顯著下調(diào)了CYP21和STAR的基因表達(dá)水平,然而,10和100 μmol·L-1MEHP顯著上調(diào)了CYP11B2的基因表達(dá)水平。100 μmol·L-1MEHP顯著下調(diào)了17β-HSD1的基因表達(dá)水平。基因表達(dá)結(jié)果顯示,DEHP、MEHP都可影響H295R細(xì)胞類固醇激素合成過程中關(guān)鍵基因的表達(dá)。
3 討論(Discussion)
本試驗(yàn)研究了DEHP及其主要代謝產(chǎn)物MEHP對H295R細(xì)胞類固醇合成過程的影響,主要包括對類固醇激素合成過程中關(guān)鍵酶、關(guān)鍵調(diào)控因子和關(guān)鍵受體基因表達(dá)的影響,用以評價DEHP和MEHP的類固醇激素合成干擾效應(yīng)。研究發(fā)現(xiàn),DEHP、MEHP可不同程度地改變類固醇合成過程中關(guān)鍵酶、關(guān)鍵調(diào)控因子和受體基因的表達(dá)。類固醇激素合成是一個復(fù)雜的過程,涉及了許多酶、因子和受體的調(diào)控,任一調(diào)控點(diǎn)的干擾如編碼類固醇合成相關(guān)酶的基因表達(dá)水平的干擾會引起酶活力的改變,直至激素水平的變化。類固醇合成過程中關(guān)鍵酶、因子和受體基因轉(zhuǎn)錄表達(dá)的改變可能造成類固醇激素分泌的紊亂,由于基因表達(dá)水平的改變相對于其他毒理效應(yīng)檢測指標(biāo)較靈敏[15],為了揭示DEHP和MEHP對H295R細(xì)胞產(chǎn)生類固醇激素合成干擾效應(yīng)的分子機(jī)制,我們選擇基因表達(dá)水平的改變來評估DEHP和MEHP對H295R細(xì)胞類固醇激素合成干擾的影響。H295R細(xì)胞在許多研究中已被用于評估一些內(nèi)分泌干擾化合物改變類固醇合成通路相關(guān)基因表達(dá)的能力[16]。

圖3 MEHP暴露對H295R細(xì)胞類固醇合成通路相關(guān)基因表達(dá)的影響注:數(shù)值以Mean±SEM表示(n=3);與對照組相比,* P<0.05,** P<0.01。Fig. 3 Effects of MEHP on the expression of steroidogenic senes in the H295R cellsNote: the representative data are expressed as the mean±SEM, n=3 for each replicate. *P < 0.05, **P < 0.01 vs. control.
3.1 DEHP和MEHP對H295R細(xì)胞中類固醇生物合成關(guān)鍵基因表達(dá)水平的影響
熒光定量qRT-PCR用于檢測DEHP和MEHP調(diào)節(jié)H295R細(xì)胞中類固醇生物合成關(guān)鍵基因表達(dá)水平。DEHP顯著增加醛固酮合成酶CYP11B2的基因表達(dá)水平,對CYP11B1基因表達(dá)水平無顯著影響。類似地10和100 μmol·L-1MEHP顯著上調(diào)了CYP11B2的基因表達(dá)水平,而MEHP染毒對CYP11B1基因表達(dá)水平無顯著影響。DEHP和MEHP對CYP11B1和CYP11B2基因在轉(zhuǎn)錄水平上產(chǎn)生了不同程度的影響,這可能和CYP11B1和CYP11B2的結(jié)構(gòu)差異和調(diào)節(jié)通路不同有關(guān)系。CYP11B1是一種催化皮質(zhì)醇生物合成過程的最后步驟線粒體細(xì)胞色素酶,CYP11B1和CYP11B2的內(nèi)含子共享了90%的核酸序列,外顯子區(qū)域共享了95%的核酸序列,并且CYP11B1在染色體8q上靠近CYP11B2,然而這2個基因的表達(dá)定位于腎上腺皮質(zhì)不同的帶狀區(qū)域[16]。CYP11B1和CYP11B2調(diào)節(jié)模式的不同還可能是由于CYP11B1和CYP11B2是通過不同通路調(diào)節(jié)的,CYP11B2是ACTH/cAMP、血管緊張素angiotensin II、類固醇合成因子1(SF-1)結(jié)合位點(diǎn)和cAMP響應(yīng)元素(CRE) 2種元素來調(diào)節(jié)的[17],然而,CYP11B1的表達(dá)是ACTH通過cAMP和蛋白激酶A依賴于cAMP響應(yīng)結(jié)合蛋白家族成員(ATF-2)而非SF-1來激活的[18]。DEHP對3-β羥基類固醇脫氫酶(3β-HSD1)的基因表達(dá)水平無顯著影響,而10 μmol·L-1DEHP顯著上調(diào)了3-β羥基類固醇脫氫酶(3β-HSD2)的基因表達(dá)水平,3β羥化類固醇脫氫酶(3β-HSD)對包括醛固酮、皮質(zhì)醇和睪酮在內(nèi)的所有類固醇激素的生物合成都很重要。3β-HSD1和3β-HSD2是定位于染色體1p13.1的2個基因,編碼不同的3β-HSD同功酶[19]。3β-HSD1和3β-HSD2的DNA序列和編碼序列之間的內(nèi)含子部分高度同源[20]。這說明盡管H295R細(xì)胞3β-HSD1和3β-HSD2在基因序列和酶的功能具有很大的相似性,但它們的表達(dá)調(diào)節(jié)模式可能不同。然而各MEHP處理組顯著下調(diào)了H295R細(xì)胞3β-HSD1和3β-HSD2基因表達(dá)水平。DEHP對H295R細(xì)胞芳香化酶CYP19a的基因表達(dá)水平無顯著影響,而各MEHP處理組顯著下調(diào)了H295R細(xì)胞CYP19a基因表達(dá)水平。CYP19a是負(fù)責(zé)將雄激素轉(zhuǎn)化為雌激素的最后步驟限速酶,最近很多研究提出具有改變CYP19活性能力的化合物具有內(nèi)分泌干擾效應(yīng)[21],所以MEHP具有內(nèi)分泌干擾效應(yīng)。
DEHP對H295R細(xì)胞類固醇激素合成過程中其他的關(guān)鍵酶和調(diào)節(jié)因子的基因表達(dá)水平無顯著改變。然而10和100 μmol·L-1MEHP染毒H295R 24 h顯著下調(diào)了CYP21基因表達(dá)水平,CYP21基因產(chǎn)物是在醛固酮和皮質(zhì)類固醇合成過程中需要的酶,這種酶的缺失可導(dǎo)致不產(chǎn)生皮質(zhì)醇和醛固酮[22]。并且,各MEHP處理組顯著下調(diào)了CYP17的基因表達(dá)水平,CYP17催化了醛固酮向皮質(zhì)類固醇底物的轉(zhuǎn)化并最終向性固醇激素底物的轉(zhuǎn)化,MEHP通過抑制CYP17的基因表達(dá)可能抑制了性固醇激素底物的合成,一些化合物如酮康唑(ketoconazole)也同時抑制CYP21和CYP17的基因表達(dá)水平[23]。17β-HSD是類固醇合成酶的一個相對較大的家族,17β-HSD1催化還原反應(yīng),17β-HSD1將雌酮轉(zhuǎn)化為生物學(xué)活性更強(qiáng)的17β雌二醇,相反,17β-HSD4是將生物學(xué)活性較強(qiáng)的類固醇如雌二醇轉(zhuǎn)換為生物學(xué)活性較弱的類固醇如雌酮的氧化酶[24]。100 μmol·L-1MEHP顯著抑制17β-HSD1的基因表達(dá)水平,可能導(dǎo)致雌酮向雌二醇的轉(zhuǎn)化受到抑制。而各MEHP處理組顯著抑制17β-HSD4的基因表達(dá)水平,可能抑制雌二醇轉(zhuǎn)換為雌酮。許多化合物如異黃酮等也抑制17β-HSD的表達(dá)水平[24]。10和100 μmol·L-1MEHP染毒H295R 24 h顯著抑制STAR的基因表達(dá)水平,從而可能抑制膽固醇從線粒體外膜向線粒體內(nèi)膜的轉(zhuǎn)運(yùn),從而影響類固醇激素的合成。
3.2 DEHP及MEHP干擾H295R細(xì)胞類固醇合成機(jī)制的異同點(diǎn)
DEHP和MEHP對類固醇激素合成相關(guān)基因表達(dá)的影響既有相同之處又有不同之處。在本研究中DEHP和MEHP都顯著上調(diào)了CYP11B2的基因表達(dá)水平,而對CYP11B1基因表達(dá)水平無顯著影響。DEHP對3-β羥基類固醇脫氫酶(3β-HSD1)的基因表達(dá)水平無顯著影響,而10 μmol·L-1DEHP顯著上調(diào)了3-β羥基類固醇脫氫酶(3β-HSD2)的基因表達(dá)水平,然而各MEHP處理組顯著下調(diào)了H295R細(xì)胞3β-HSD1和3β-HSD2基因表達(dá)水平。DEHP對H295R細(xì)胞芳香化酶CYP19a的基因表達(dá)水平無顯著影響,而各MEHP處理組顯著下調(diào)了H295R細(xì)胞CYP19a基因表達(dá)水平。DEHP對H295R細(xì)胞類固醇激素合成過程中其他的關(guān)鍵酶和調(diào)節(jié)因子的基因表達(dá)水平無顯著改變。而MEHP抑制了STAR、CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因的表達(dá),所以MEHP可以通過抑制STAR基因的表達(dá),從而將影響類固醇激素合成前體膽固醇在細(xì)胞內(nèi)的轉(zhuǎn)運(yùn);并能顯著性抑制類固醇激素合成過程中CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因的表達(dá),最終將抑制H295R細(xì)胞中類固醇激素的合成。并且與DEHP相比,MEHP對H295R細(xì)胞類固醇激素合成關(guān)鍵基因表達(dá)的影響較明顯。所以在評價DEHP對H295R細(xì)胞類固醇激素合成通路影響時,可選擇CYP11B2和3β-HSD2作為分子靶標(biāo),而對于評價MEHP對H295R細(xì)胞類固醇激素合成通路影響時,可選擇STAR、CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因作為分子靶標(biāo)。類似地,文獻(xiàn)研究顯示MEHP暴露囊狀卵泡導(dǎo)致類固醇激素合成過程涉及的關(guān)鍵酶CYP19A1、3β-HSD1、STAR、CYP11A1、CYP17A1、17β-HSD1 mRNA水平,最終導(dǎo)致睪酮、雌酮和雌二醇水平下降[25],該研究結(jié)果也顯示DEHP和MEHP對類固醇激素合成過程的干預(yù)模式是不同的。一些文獻(xiàn)研究也報(bào)道DEHP的毒性效應(yīng)是由MEHP介導(dǎo)的,體外MEHP暴露抑制了類固醇激素合成[26-27]。體內(nèi)實(shí)驗(yàn)研究顯示圍產(chǎn)期暴露于DEHP下調(diào)了睪丸間質(zhì)細(xì)胞類固醇激素合成相關(guān)基因如StAR、Cyp11a1、3β-HSD、17β-HSD和Cyp-19等的表達(dá),從而顯著降低血清睪酮和雌二醇水平并導(dǎo)致內(nèi)分泌干擾生殖毒性效應(yīng)[28]。然而,也有報(bào)道顯示體外研究中低劑量DEHP和MEHP(0.001 μmol·L-1和0.1 μmol·L-1)暴露MLTC-1細(xì)胞增加了類固醇激素合成相關(guān)基因CYP11A1、CYP17和3β-HSD從而刺激了睪酮的分泌[29],這種研究結(jié)果的差異可能是由于種屬差異導(dǎo)致的。DEHP和MEHP對H295R細(xì)胞類固醇激素合成相關(guān)基因表達(dá)水平影響的差異可能是由于DEHP在H295R細(xì)胞內(nèi)并非完全發(fā)生代謝轉(zhuǎn)化為MEHP,H295R細(xì)胞體內(nèi)負(fù)責(zé)將DEHP轉(zhuǎn)化為MEHP,次級代謝產(chǎn)物的代謝酶如乙醛脫氫酶、酒精脫氫酶和脂蛋白酯酶的水平和活性受到DEHP暴露的影響,DEHP代謝轉(zhuǎn)化為MEHP的轉(zhuǎn)化率以及MEHP進(jìn)一步代謝轉(zhuǎn)化為其他次級代謝產(chǎn)物的轉(zhuǎn)化率需要進(jìn)一步的研究,以便解釋DEHP和MEHP對類固醇生成相關(guān)基因表達(dá)影響的差異機(jī)制。
對比DEHP和MEHP對H295R細(xì)胞類固醇激素合成通路的影響,可知DEHP和MEHP對H295R細(xì)胞類固醇激素合成通路相關(guān)酶、因子和受體基因表達(dá)水平的影響不同,并且與DEHP相比,MEHP對H295R細(xì)胞類固醇激素合成關(guān)鍵基因表達(dá)的影響較明顯。

