紫蘇方膠囊微生物限度檢查方法的研究
張媛媛 曹莧愷 李曉波

摘 要 目的:建立中藥抗菌藥物紫蘇方膠囊微生物限度檢查方法并對其進行驗證。方法:參照2015年版《中國藥典》四部通則,利用卵磷脂、L組氨酸、聚山梨酯80的中和作用,采用薄膜過濾法和平皿法測定紫蘇方膠囊對金黃色葡萄球菌等5種試驗菌種的回收率,并對其進行了控制菌適用性試驗。結果:5種試驗菌回收率均在0.5~2.0范圍,控制菌可檢出。結論:本試驗所建立方法可用于紫蘇方膠囊的微生物限度檢查。
關鍵詞 紫蘇方 驗證 微生物限度試驗
中圖分類號:R286; R927.11 文獻標志碼:A 文章編號:1006-1533(2018)13-0080-04
Verification of microbial limit test method for Zisu Fang
ZHANG Yuanyuan1,2*, CAO Xiankai2, LI Xiaobo1**
(1. Shanghai Jiao Tong University, Shanghai 200240, China;
2. Shanghai Lvgushengmingyuan Pharmaceutical Co., Ltd., Shanghai 201707, China)
ABSTRACT Objective: To establish and verify the microbial limit test method for the traditional Chinese medicine of Zisu Fang capsule. Methods: According to the fourth part of the 2015 edition of Chinese Pharmacopoeia principles, the recovery rates of Zisu Fang capsule against 5 kinds of test microorganisms including Staphylococcus aureus were measured by membrane filtration and Petri dish methods and using the neutralization of lecithin, L-histidine and polysorbate 80, and the applicability test of E.coli as the control bacterium was also performed. Results: The recovery rates of the 5 kinds of experimental microorganisms were in the range of 0.5~2, and the control bacterium could be detected. Conclusion: The methods established in this experiment can be used for the microbial limit test of Zisu Fang capsule.
KEY WORDS Zisu Fang; verification; microbial limit test
紫蘇方為王永炎院士的臨床經驗方并由上海綠谷生命園醫藥有限公司開發為膠囊劑。該方具有清熱燥濕、化痰止咳的功效,用于治療感冒后余邪未凈,低熱咳嗽,周身不適,食欲不振。該方由紫蘇子、紫蘇梗、丹參、黃芩、苦參五味藥組成,主要藥效成分為丹參酮ⅡA、丹酚酸B、迷迭香酸、黃芩苷、苦參堿和氧化苦參堿。藥效研究已發現該方具有較強的抗菌活性,其提取物對大腸埃希菌和金黃色葡萄球菌的體外抗菌活性顯著,與頭孢克洛聯用,能增強多種病原微生物對抗生素的敏感度[1-2]。紫蘇方微生物限度檢查包括需氧菌、霉菌和酵母,控制菌選取大腸埃希菌。中成藥組方具有復雜性,任何成分的抑菌成分均可影響微生物限度檢查的準確性[3]。所以,對于此類藥物,單用稀釋和加中和劑的方法很難使試驗菌(金黃色葡萄球菌、銅綠假單胞菌、枯草芽胞桿菌、白色假絲酵母、黑曲霉)的比值都達到藥典標準。為保障患者的用藥安全,確立可靠的微生物限度檢驗方法,本試驗參照2015年版《中國藥典》四部通則1105、1106非無菌產品微生物限度檢查微生物計數法、控制菌檢查法,對紫蘇方膠囊微生物限度檢查方法進行了摸索與驗證[4],利用卵磷脂、L-組氨酸、聚山梨酯80的中和作用去除紫蘇方膠囊的抑菌性,并采用薄膜過濾法中加入中和劑的方法有效去除抑菌成分。
1 材料和方法
1.1 藥品與試劑
紫蘇方膠囊(規格0.3 g,批號161102、161103、161105,上海綠谷生命園醫藥有限公司)。
pH 7.0氯化鈉蛋白胨緩沖液(批號160829,上海中科昆蟲生物技術開發有限公司);大豆卵磷脂、L-組氨酸、聚山梨酯80(批號分別為20160701、20160901、20161201,潤捷化學試劑有限公司)。
1.2 培養基與菌種
胰酪大豆胨瓊脂培養基(TSA)、胰酪大豆胨液體培養基(TSB)、沙氏葡萄糖瓊脂培養基(SDA)、沙氏葡萄糖液體培養基(SDB)、麥康凱瓊脂培養基、麥康凱液體培養基(批號分別為151130、151223、150821、150210、151217、151109,上海中科昆蟲生物技術開發有限公司)。
金黃色葡萄球菌(Staphylococcus aureus, CMCC(B) 26003)、銅綠假單胞菌(Pseudomonas aeruginosa, CMCC(B)10104)、枯草芽胞桿菌(Bacillus subtilis, CMCC(B)-63501)、白色假絲酵母(Candida albicans, CMCC(F)-98001)、黑曲霉(Aspergillus niger, CMCC(F)-98003)和大腸埃希菌(Escherichia coli, CMCC(B)44102)均來自于中國食品藥品檢定研究院。
1.3 實驗儀器
DHG-BH9243Ш電熱恒溫鼓風干燥箱、SPX-150BS-Ⅱ生化培養箱、MJ-160BS-Ⅱ霉菌培養箱(上海新苗醫療器械有限公司);Testo 206-pH2酸度計(上海佑科儀器儀表有限公司);HH-6數顯恒溫水浴鍋(國華電氣有限公司);YP1002N電子天平(上海精密科學儀器有限公司);YXQ-LS-50SⅡ立式壓力蒸汽滅菌器(上海博訊實業有限公司醫療設備廠);BSC-1000ⅡA2生物安全柜(蘇州安泰空氣技術有限公司);YX940D電動吸引器(上海醫療器械公司醫用吸引器廠)
1.4 實驗方法
參照2015年版《中國藥典》四部通則[4]對紫蘇方膠囊進行需氧菌總數、真菌總數、控制菌檢查方法的確認,其中需氧菌總數采用薄膜過濾法,真菌總數及控制菌檢查采用平皿法。
1.4.1 菌液的制備
參照2015年版《中國藥典》四部通則[4]1105微生物計數法項下方法制備。
對陽性菌菌液濃度進行稀釋,濃度為10-4~10-6,使菌落數不大于100 cfu/ml。
1.4.2 中和劑的制備
取30 g胰酪大豆胨液體培養基,3 g大豆卵磷脂,1 g L-組氨酸,970 ml純化水加熱溶解后,加入30 g聚山梨酯80混合均勻,121 ℃、15 min滅菌后備用(臨用新配)。
1.4.3 供試液的制備
取紫蘇方膠囊10 g,加中和劑90 ml,于不超過45℃的水浴中放置,混勻,作為1∶10供試液。用中和劑繼續稀釋,制備1∶100供試液。
1.4.4 計算公式及接受標準
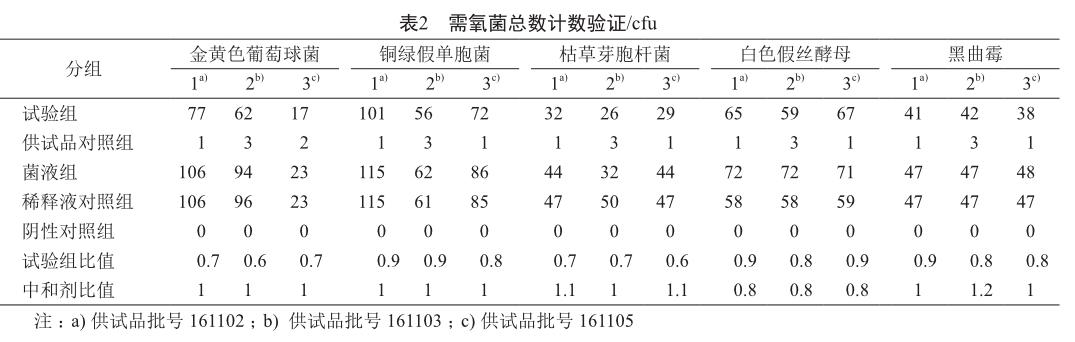
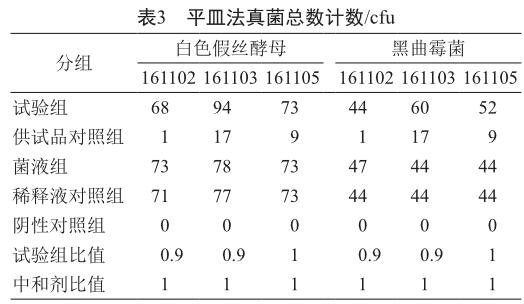
試驗組比值=(試驗組菌落數-供試品對照組菌落數)/菌液對照組菌落數。
中和劑比值=(中和劑對照組菌落數-供試品對照組菌落數)/菌液對照組菌落數。
所得比值均應在0.5~2.0范圍內。
1.4.5 需氧菌總數計數方法驗證
1)需氧菌計數方法的確定(預試驗) 以金黃色葡萄球菌、枯草芽胞桿菌和銅綠假單胞菌為試驗菌。分別采用a,b,c 3種方法對供試品進行處理。①方法a:供試品采用pH 7.0氯化鈉蛋白胨緩沖液1 000 ml(最后沖洗100 ml時加入菌懸液);②方法b:供試品加入中和劑(30 g胰酪大豆胨液體培養基,3 g大豆卵磷脂,1 g L-組氨酸,15 g聚山梨酯80),pH 7.0氯化鈉蛋白胨緩沖液600 ml(最后沖洗100 ml時加入菌懸液);③方法c:方法b中聚山梨酯80改為30 g,于45 ℃水浴保溫,其余條件不變。
2)方法驗證 分別取三批供試品按方法c進行處理,采用薄膜過濾法進行檢查。①試驗組:取1∶100供試液10 ml,按方法c操作,沖洗時加入0.1 ml菌液,濾干,于TSA上培養;②供試品對照組:不加入菌液的供試液,測定供試品微生物數;③菌液對照組;取稀釋液替代供試液,按試驗組操作加入試驗菌液并進行回收試驗;④中和劑對照組:用中和劑替代供試液,按試驗組操作加入試驗菌液并進行回收試驗;⑤陰性對照組:取中和劑10 ml,不加入菌液。
1.4.6 真菌總數計數驗證
取三批供試品采用平皿法進行真菌計數的方法學驗證及菌落計數。①試驗組:取制備好的供試液,加入試驗菌液,取1 ml供試液等量分注5個無菌平皿,分別傾注15~20 ml沙氏葡萄糖瓊脂培養基,培養;②供試品對照組:取制備好的供試液,不加入菌液。測定供試品微生物數;③菌液對照組:取稀釋液替代供試液,按試驗組操作加入試驗菌液并進行回收試驗;④中和劑對照組:用中和劑替代供試液,按試驗組操作加入試驗菌液并進行回收試驗;⑤陰性對照組:平皿中加入1 ml中和劑,培養。
1.4.7 控制菌驗證試驗
以大腸埃希菌作為控制菌采用平皿法進行操作,。①試驗組:取1∶10供試液10 ml置100 ml TSB中,混勻,同時加入大腸埃希菌菌懸液1 ml混合均勻;②陰性對照組:取TSB 100 ml,不加入樣品和菌懸液;③菌液組:取TSB 100 ml加入大腸埃希菌菌懸液1 ml混合均勻。均按藥典方法培養,以接入試驗組的大腸埃希菌被檢出為接受標準。
2 結果
2.1 需氧菌總數計數方法的預實驗
三種預實驗方法試驗結果表明,方法c可用于需氧菌總數計數(表1)。
2.2 需氧菌總數計數方法驗證
按照方法c對三批供試品進行驗證實驗,結果表明采用方法c可用于紫蘇方需氧菌總數計數(表2)。
2.3 真菌總數驗證試驗
采用平皿法對三批供試品進行真菌總數驗證,結果表明,可用于紫蘇方真菌總數計數(表3)。
2.4 控制菌驗證試驗
控制菌選用稀釋10-4倍的大腸埃希菌,3批供試品試驗結果表明,適用性試驗符合標準(表4)。
3 討論
通過上述一系列試驗,成功摸索出了適合于具有抑菌作用的紫蘇方膠囊的微生物限度控制方法,本次驗證試驗中需要注意的兩點:①中和劑一定要臨用現配;②銅綠假單胞菌的計數須在培養24 h內完成,而且試驗中貼膜時要用無菌棉花吸干濾膜水分,否則培養后菌落會連成片,無法計數,從而無法對回收率做出判斷。
微生物限度檢查是判斷藥品受到微生物污染的程度,是企業從原料到成品生產全過程進行微生物評價的主要依據,同時也是藥品安全性檢查的重要項目[5-7]。檢查方法中干擾因素較多,易影響計數結果,如培養條件、培養基、加菌濃度及加菌量等[8-9]。在新藥的研究和開發過程中,建立適當的檢驗方法學驗證必不可少,而且不能簡單照搬,需經驗證確認試驗方法和檢測系統的有效性[10-12]。微生物限度檢查方法常用的方法有薄膜過濾法(必要時可加入中和劑或稀釋培養基)和平皿法。薄膜過濾法是液體類制劑和抑菌作用較強的水溶性藥品進行微生物限度試驗的首選方法[13-14]。由于本次試驗中紫蘇方膠囊具有較強的抑菌作用,本文在薄膜過濾法中加入中和劑,摸索了中和劑的比例及對供試液加溫等方法,成功去除了供試品的抑菌成分,建立了檢查方法,為中藥抑菌藥物的微生物限度檢查方法的建立提供了參考。
參考文獻
[1] 劉菁. 紫蘇方藥物制備物的質量及關聯研究[J]. 大家健康(學術版), 2016, 10(7): 161-162.
[2] 安琪, 唐雪陽, 盧廣英, 等. 紫蘇方藥物制備物的質量表征及其關聯分析[J]. 北京中醫藥大學學報, 2014, 37(6): 414-419, 28, 6.
[3] 馬越, 特玉香, 杜平華, 等. 16種中成藥微生物限度檢查法方法驗證[J]. 中國藥品標準, 2005, 6(6): 12-15.
[4] 國家藥典委員會. 中華人民共和國藥典2015版四部[M].北京: 中國醫藥科技出版社, 2015: 140-144.
[5] 黃諾嘉. 淺談中成藥微生物限度檢查法方法驗證存在的幾點問題與思考[C]//全國藥物質量分析學術研討會. 北京:中國藥學會藥物分析雜志, 2006.
[6] 丁勃, 徐曉潔, 劉廣楨, 等 雙濾膜過濾方法在藥品微生物限度檢查中的應用研究[J]. 藥物分析雜志, 2014, 34(12): 2229-2234.
[7] 易巧, 劉緒平, 張銀花. 藥用輔料苯甲醇新版藥典微生物限度檢查適用性實驗[J]. 中國醫學創新, 2017, 14(4): 48-52.
[8] 陳偉盛, 關倩明, 朱榮峰, 等. 藥品微生物限度檢查中微生物污染的鑒定和溯源分析[J]. 藥物分析雜志, 2014, 34(1): 58-63.
[9] 殷建國. 微生物限度檢查應注意的若干問題[J]. 中國藥事, 2004, 18(7): 456.
[10] 曹曉云, 郭艷娟. 藥品微生物限度檢查方法學驗證試驗及其相關的技術問題[J]. 天津藥學, 2006, 18(6): 49-51.
[11] 劉文, 張廣求, 朱立剛. 2種含碘制劑《中華人民共和國藥典》(2015年版)微生物限度檢查方法的建立[J]. 中國合理用藥探索, 2017, 14(2): 14-17.
[12] 楊曉莉, 李輝, 馬英英, 等. 《中國藥典》2015年版非無菌產品微生物限度檢查: 控制菌檢查法解讀與對策[J]. 中國藥師, 2016, 19(4): 748-752.
[13] 劉戈, 邱唯佳, 費夷敏. 替硝唑栓微生物限度檢查方法適用性試驗研究[J]. 上海醫藥, 2016, 37(13): 73-76.
[14] 殷生楠, 柳冬梅. 8種醫院制劑微生物限度檢查法驗證[J].現代醫藥衛生, 2010, 28(16): 2432-2434.

