土人參Actin基因片段的克隆及序列分析
葉玉妍,陳 曉,楊禮香
(廣州大學生命科學學院,廣東 廣州 510006)
發掘野生植物資源和藥用植物資源的優異功能基因是當前植物分子生物學的研究熱點之一。探究功能基因的表達模式是植物分子生物學的重要方面,基因表達模式的研究通常需要一個穩定表達的持家基因作為參考[1]。Actin即肌動蛋白,在不同物種中高度保守,是細胞骨架的重要組成部分,能參與多種植物細胞的功能調控,響應不同的信號轉導事件。編碼Actin的Actin基因普遍存在于真核生物中,能夠在植物體的不同組織表達,并且在同一時空保持相同的表達水平[2]。因此,在植物分子生物學研究中,常作為植物功能基因的內參基因。Actin基因是一段高度保守的序列,是一個典型、龐大的基因家族,可通過設計簡并性引物擴增不同植物的Actin基因片段[1]。目前,已從多種植物中克隆出了Actin基因片段,如厚藤(Ipomoea pescaprae)[2]、草海桐(Scaevola sericea)[3]、葡萄(Vitis vinifera)[4]、桑樹(Morus alba)[5]、四翅濱藜(Atriplex canescens)[6]、堿蓬(Suaeda glauca)[7]、擬南芥(Arabidopsis thaliana)[8]等。
土人參(Talinum paniculatum)又名水人參、土高麗參等,為馬齒莧科土人參屬一年生或多年生草本植物[9],廣泛分布于長江以南各地,如廣西、廣東、貴州等省(區)[10]。土人參易于栽培,富含黃酮類、多糖等活性物質,莖葉可作為蔬菜食用,根可作為燉湯原料,營養豐富,有補血益氣等作用[11-12]。此外,土人參的提取物還具有抗菌和抗氧化作用[13-14],具有較高的食用和藥用價值。目前關于藥用植物藥用價值和活性成分提取方面的研究較多,但對功能基因的研究鮮見報道,本試驗利用逆轉錄PCR(reverse transcription)技術克隆到土人參Actin基因的cDNA片段,可作為后期研究土人參功能基因的內參基因,為藥用植物土人參功能基因表達和調控的研究提供參考。
1 材料與方法
1.1 試驗材料
以土人參嫩葉為試驗材料。土人參為華南植物園表觀遺傳學實驗室培育,將土人參種子(購自北京綠金藍種苗有限責任公司)種植于混合土壤(蛭石與營養土為1∶3)中,22℃溫室培育30 d后,幼苗移至室外,繼續培養14 d,收集葉片,錫紙包裹置于液氮速凍,保存備用。
主要試劑:大腸桿菌DH5α由華南植物園表觀遺傳學實驗室保存。RNA提取采用HiPure Plant RNA Kits ( R4151)試劑盒法(Magen公司)。cDNA鏈按照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix說明書(全式金公司)進行合成。DNA回收采用HiPure Gel Pure DNA Kits(Magen公司)。高保真Taq酶為ProbestTM DNA Polymerase(TakaRa公司)。pGEM-T載體購于TakaRa公司,其他生化試劑均為進口或國產分析純。
1.2 試驗方法
1.2.1 引物合成 參照郭艷等[1]的方法,在NCBI上查詢多種植物Actin基因序列,根據所查核苷酸序設計簡并性引物ActinP1和ActinP2,用于土人參Actin基因片段的擴增,推測目的片段的長度為598 bp。
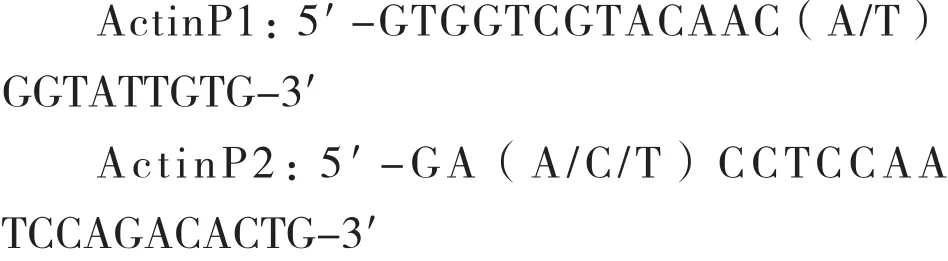
1.2.2 總RNA提取 選取土人參嫩葉,按照Magen公司的HiPure Plant RNA Kits ( R4151)中的說明書方法提取土人參葉片總RNA,采用瓊脂糖凝膠電泳和NanoDrop 1000核酸蛋白檢測儀檢測所提RNA的濃度。
1.2.3 RT-PCR擴增 PCR擴增反應體系參考郭艷等[1]的方法,以總RNA為模板進行逆轉錄反應獲取cDNA第一鏈。cDNA單鏈的合成依照全式金公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 的說明書進行。反應程序為:預變性(94℃,5 min);變性(94℃,30 s)、退火(56℃,45 s)、延伸(72℃,45 s),循環30次,72℃延伸10 min。
RT-PCR擴增所得產物用1%瓊脂糖電泳檢測,獲得單一DNA片段,為RT-PCR擴增所得的Actin基因片段。目的DNA片段的回收按照Magen公司的HiPure Gel Pure DNA Kits說明書方法進行。
1.2.4 陽性克隆的篩選與鑒定 將回收的DNA片段連接于pGEM-T載體上,并轉化至大腸桿菌感受態DH5α中,涂布在含有100 μg/mL AMP的LB固體培養基上,倒置于37℃培養箱培養12 h,隨機用所設計的簡并引物ActinP1和ActinP2進行菌落PCR鑒定,挑取符合條件的菌落進行質粒提取,送至廣州英濰捷基公司測序。
1.2.5 序列的生物信息學分析 通過ORF finder網站(https://www.ncbi.nlm.nih.gov/orffinder/),獲得測序所得核苷酸序列ORF閱讀框以及預測的氨基酸序列。在NCBI上通過BLAST比對,選取較常見且與TpActin1同源性較高的8種植物的Actin基因,下載它們的肌動蛋白基因序列,包括大豆(Glycine max,XP_003523242.1)、擬南芥(Arabidopsis thaliana,NP_001319585.1)、甜菜 actin1(Beta vulgaris,AGW21693.1)、馬齒莧(Portulaca oleracea,AIW52352.1)、紅肉火龍果(Hylocereus polyrhizus,ASZ85168.1)、甜菜actin2 (Beta vulgaris,AGW21694.1)、刺兒菜(Cirsium setosum,AEY77415.1)、玉米(Zea mays,ONM08622.1),進行多序列比對并構建系統進化樹。
TpActin1的氨基酸序列同源性分析采用Clustal Omega程序,在Clustal網站(http://www.clustal.org/)上進行,序列的著色在BoxShade網站(https://embnet.vital-it.ch/software/BOX_form.html)上進行。TpActin1的系統進化樹構建采用MEGA6生物軟件中Neighbor-Joining算法。
2 結果與分析
2.1 總RNA檢測結果
將土人參嫩葉提取的總RNA進行瓊脂糖凝膠電泳檢測,結果顯示,28S rRNA、18S rRNA條帶清晰可見,說明提取的RNA無明顯降解情況;NanoDrop 1 000核酸蛋白檢測儀檢測OD260nm/OD280nm的平均值約為2.17,無蛋白質等雜質污染,表明RNA純度較高,總RNA濃度為239 ng/μL。通過瓊脂糖凝膠電泳以及NanoDrop 1 000核酸蛋白檢測儀檢測后,確認獲得的總RNA可用于下一步RT-PCR擴增試驗。
2.2 RT-PCR擴增
以土人參鮮嫩葉片提取的總RNA逆轉錄得到cDNA第一鏈為模板,進行Actin基因PCR擴增。通過瓊脂糖凝膠電泳檢測擴增產物發現,在Marker 500~800 bp之間有1條清晰明顯的特異條帶,該DNA分子大小與預測的目的Actin基因片段(598 bp)相符(圖1),可能是土人參Actin基因片段,可進行下一步試驗驗證。
2.3 陽性克隆的鑒定與測序
將回收的DNA目的片段連接到pGEM-T載體上轉化至大腸桿菌DH5α。將轉化菌液涂布于LB固體 (含100 μg/mL Amp)培養基平板上,37℃培養12 h。隨機挑取單菌落,用所設計的簡并引物ActinP1和ActinP2進行菌落PCR檢測,得到的擴增片段DNA分子量大小約為598 bp(圖2),與RT-PCR檢測結果一致,表明此克隆為陽性克隆,可以提取質粒,進行測序。
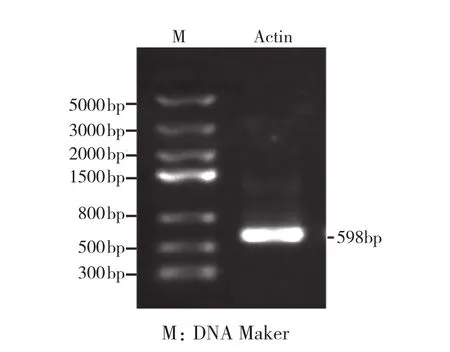
圖1 土人參Actin基因的擴增結果
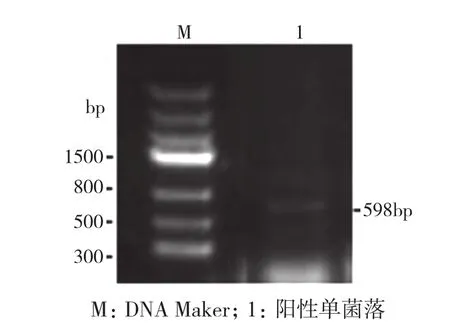
圖2 重組克隆的菌落PCR檢測結果
2.4 序列分析
將陽性克隆擴增培養后提取質粒,重組質粒測序結果顯示,獲得一段大小為598 bp的基因片段可編碼198個氨基酸(圖3)。將該序列在NCBI中進行Blast對比,發現克隆所得片段的核苷酸序列與同為原產熱帶美洲的紅肉火龍果ACT7(MF356257.1)的同源性最高、達93%;與其他Actin基因的核苷酸序列的同源性也在85%以上。克隆所得片段編碼的氨基酸序列與同為馬齒莧科的馬齒莧(AIW52352.1)的同源性最高、達97%;與藜科的甜菜(AGW21693.1)同源性也達97%。表明克隆所得片段為土人參的Actin基因片段,將該基因命名為TpActin1,登錄在GenBank,序列號為MH333039。

圖3 土人參Actin(TpActin1)cDNA片段的核苷酸序列及推測的氨基酸序列
將推測出的土人參Actin基因的氨基酸序列片段與GeneBank數據庫中與土人參Actin基因同源性較高且常見的植物Actin基因編碼的氨基酸進行多重比較,發現TpActin1編碼的保守氨基酸序列多達194個,而非保守氨基酸序列僅有4個,表明TpActin1基因片段在氨基酸水平上同樣高度保守(圖4)。
由圖5可知,馬齒莧科的土人參TpActin1的氨基酸與藜科的甜菜 (Bvactin2)以及豆科的大豆 (Gmactin7)同源性最高,其次為藜科的甜菜 (Bvactin1)、菊科的刺兒菜 (Csactin)、仙人掌科的紅肉火龍果 (Hpactin7)、十字花科的擬南芥 (Atactin2)、馬齒莧科的馬齒莧(Poactin)、禾本科的玉米 (ZmActin1)。本試驗克隆所得的片段在核苷酸和氨基酸水平均高度保守,確定為土人參的Actin基因片段,可應用于下一步基因功能研究。
3 結論與討論
肌動蛋白是真核生物中一種重要的結構蛋白,在細胞活動中發揮著重要作用,其氨基酸序列具有高度的同源性和保守性。Zhu等[15]、Kozuka等[16]、Papakonstanti等[17]認為,肌動蛋白可參與細胞骨架結構的維持及細胞運動、細胞分裂、細胞轉錄等,在細胞內發揮重要的生理功能。Chang等[18]、Calvo等[19]認為,編碼肌動蛋白的Actin基因參與持家基因(House-keeping gene)基本功能的表達,因此常被作為常規基因表達的內源參照。在高等植物中,有關Actin基因結構與表達的研究已較深入,Mcdowell等[20]在擬南芥中報道了8個功能性肌動蛋白基因和2個肌動蛋白假基因。而克隆Actin基因用于發掘植物優異基因,是植物分子生物學研究的重要內容。不同植物Actin基因的克隆和序列分析可進一步用于植物優異基因的研究,為農作物重要功能基因的表達分析提供內參基因,或為研究植物抗逆性基因(抗旱、抗鹽堿)的發掘和表達模式分析提供內參基因[21-23]。
本試驗以土人參嫩葉為材料,提取總RNA,通過反轉錄的方法擴增Actin基因片段,隨機挑取擴增所得的Actin基因片段,克隆得到土人參Actin基因的cDNA片段,大小為598 bp,與鹽生植物堿蓬[7]、多漿旱生植物霸王[22]、旱生植物梭梭[23]克隆所得的基因片段大小相同。將其命名為TpActin1,并登陸在GenaBank,登錄號為MH333039。序列分析表明,TpActin1基因片段的核苷酸序列與同為原產熱帶美洲的紅肉火龍果ACT7(MF356257.1)的同源性最高,氨基酸序列與同為馬齒莧科的馬齒莧(AIW52352.1)的同源性最高,達97%;與藜科的甜菜(AGW21693.1)同源性也達97%。此外,TpActin1基因片段與其他已在GenaBank登錄的植物Actin基因核苷酸序列的同源性均在85%以上,氨基酸序列一致性均在86%以上。因此,確認TpActin1為高度保守且穩定表達的持家基因,可作為土人參的內參基因并用于其功能基因的研究。

圖4 TpActin1與其他植物Actin基因氨基酸序列的多重對比
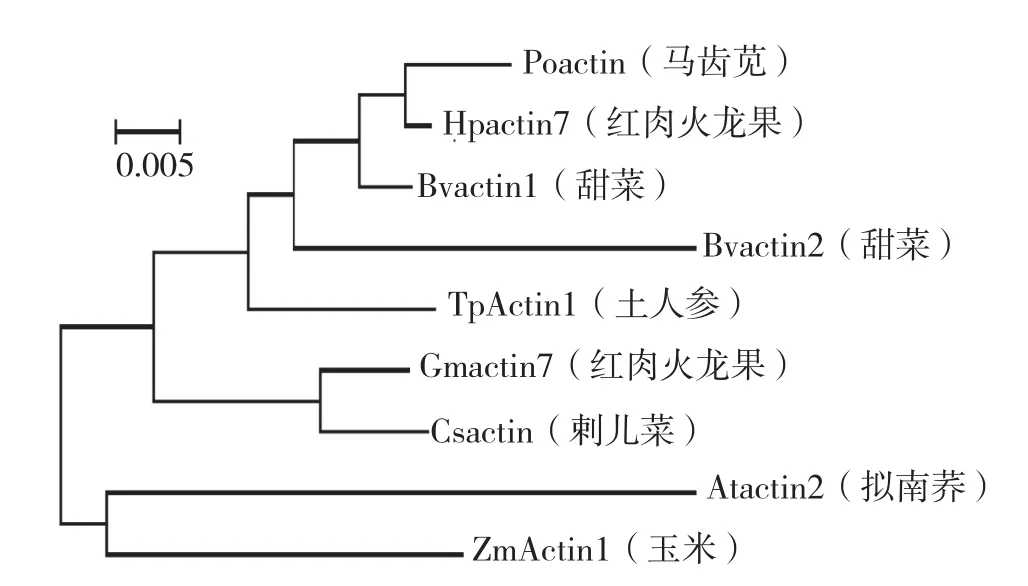
圖5 TpActin1與其他植物Actin基因的氨基酸序列同源性分析

