NaCl脅迫下zma-miR059的表達及其抗鹽性分析
王 紅, 毋若楠, 王爭艷, 楊成成, 武永軍
(西北農林科技大學生命科學學院,陜西楊陵 712100)
土壤鹽漬化導致環境退化,嚴重影響著作物的生長及產量。土壤中鹽離子濃度過高會造成植物根系吸水困難,使植物體內含水量下降,膨壓降低,引起植物細胞脫水死亡,甚至影響植物自身的生存[1]。目前,我國大約有0.33億hm2鹽堿地,而大量農作物耐鹽性差,在鹽堿地中無法種植,因此,如何提高農作物的耐鹽性,對擴大我國耕地面積具有現實意義。
miRNAs是植物體內普遍存在的一類小分子非編碼RNA,其長度在24 nt左右[2]。miRNAs廣泛參與植物的生長發育、形態建成、果實發育、對生物和非生物脅迫的響應等過程[3]。研究發現,擬南芥[4]、玉米[5]中都存在響應鹽脅迫的miRNAs。目前研究miRNAs功能的方法有過表達和基因沉默等。向娟等發現,在擬南芥中過表達番茄的miR397能夠增強擬南芥的抗旱性[6]。2014年Gu等構建了沉默miR165/166的STTM(short tandem target mimic,即短串聯靶標模擬)載體,導致轉基因棉花中靶標基因的表達量明顯上升[7]。
當土壤環境中鹽離子濃度較高時,會破壞植物細胞內的離子平衡,引起膜功能異常,代謝活動減弱,從而影響生長[8]。當植物受到非生物脅迫時,活性氧積累且高度活躍,刺激植物通過抗氧化酶級聯反應來清除活性氧[9],使植物體內清除活性氧相關酶超氧化物歧化酶(superoxide dismutase,簡稱SOD)、過氧化物酶(peroxidase,簡稱POD)、過氧化氫酶(catalase,簡稱CAT)等活性升高[10-11]。此外,在脅迫下,細胞膜會發生膜脂過氧化,產生丙二醛(malonaldehyde,簡稱MDA),因此,可以通過丙二醛了解膜系統受傷害的程度[12]。保護酶活性及MDA含量已被廣泛用來衡量植物受脅迫的程度。
筆者所在實驗室在之前利用高通量測序研究了NaCl處理下玉米miRNAs的表達,發現zma-miR059的表達量在NaCl脅迫下顯著上升。因此本研究以先玉335為試驗材料,試圖明確zma-miR059與鹽脅迫的關系,以期為從轉錄后調控角度改進植物的耐鹽性提供理論依據。
1 材料與方法
1.1 材料
1.1.1 玉米品種和接種的菌株 玉米品種為先玉335,載體pOT2-Poly-cis、pFGC5941-PacI和農桿菌GV3101為筆者所在實驗室保存。
1.2 試驗方法
1.2.1 材料處理和樣品采集 將玉米種子進行消毒、萌發處理,當玉米芽長到2 cm時,用棉花包裹種子,留出根部,插入自制的玉米水培盆小孔中,每天用通氣泵通氣3次。用蒸餾水培養3 d后換Hoagland培養液培養至三葉期,挑出長勢一致的玉米幼苗進行處理。分根處理(將玉米根系分為大致相等的2個部分):將2個部分的根分別放入正常的Hoagland培養液和含有200 mmol/L NaCl的Hoagland培養液中。全部根系NaCl處理:將玉米根系全部放入含有200 mmol/L NaCl的Hoagland培養液中。對照:將全部根系放入不含NaCl的Hoagland培養液中,培養2 d后,取樣進行試驗,每個處理設置3個重復。
培養條件:光—暗周期為15 h—9 h,晝—夜溫度周期為28 ℃—20 ℃。
1.2.2 RNA提取和反轉錄 用十六烷基三甲基溴化銨(CTAB)法提取葉片和根系總RNA。提取RNA后用GoScriptTMReverse Transcription System(Promega,上海)進行反轉錄,嚴格按照試劑盒說明書進行操作。反轉錄參照Chen等發明的stem-loop RT-PCR,設計反轉錄引物:5′-GTCGTA TCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGAC GATC-3′(5′末端是44個固定堿基,3′末端的8個堿基與miRNA成熟體的3′端互補配對)[13]。反應體系為20 μL:2.5 μL 總RNA、4 μL反應緩沖液、1 μL反轉錄引物、2 μL MgCl2、1 μL dNTPs、1 μL RNA酶抑制劑、1 μL 反轉錄酶,7.5 μL 水。反應條件:25 ℃ 5 min,42 ℃ 1 h,75 ℃ 15 min。
1.2.3 實時定量PCR 實時熒光定量PCR采用Promega公司的GoTaq?qPCR Master Mix,操作嚴格按照說明書進行。選擇18S rRNA為內參,zma-miR059和內參的引物由生工生物工程(上海)股份有限公司合成(表1)。反應體系為 20 μL:10 μL 2×GoTaq?qPCR Master Mix,7.4 μL水,各 0.3 μL 上、下游引物(10 μmol/L),2 μL cDNA。反應條件:95 ℃ 5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40個循環。在65~95 ℃,每升高0.5 ℃采集1次熒光,生成溶解曲線。每個樣品設置3個重復,陰性對照以ddH2O為模板。表達量采用相對定量2-ΔΔCT法計算。
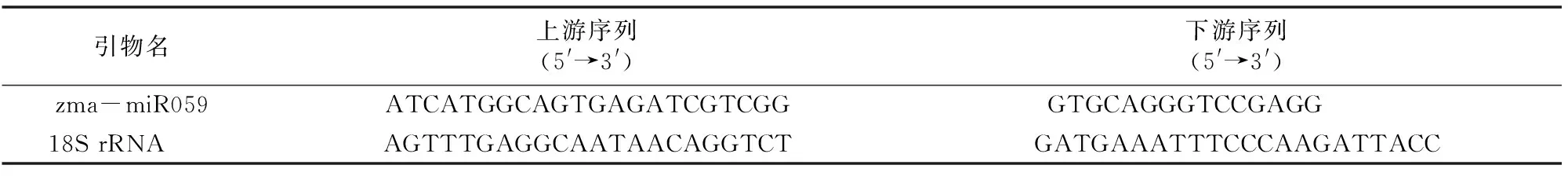
表1 實時定量PCR引物
1.2.4 SOD、CAT、POD活性及MDA含量的測定 參照高俊鳳的方法進行CAT、SOD、POD活性和MDA含量的測定,均為鮮質量活性或含量[14]。
1.2.5 zma-miR059 STTM表達載體的構建 zma-miR059的序列為5′-ATCATGGCAGTGAGATCGTCG-3′,參照Yan等的方法[15]設計zma-miR059的STTM序列,整段序列如下:5′-CATTTGGAGAGGACAGCCCCGACGATCTCATAGCTG CCATGATGTTGTTGTTGTTATGGTCTAATTTAAATATGGTCTA AAGAAGAAGAATCGACGATCTCATAGCTGCCATGATGGTACG CTGAAATCACCAG-3′。根據上述序列設計引物,構建STTM-zma-miR059表達載體,引物序列詳見表2。

表2 構建STTM-zma-miR059的引物
以pOT2-Poly-Cis質粒為模板,PCR擴增STTM(KOD-Plus-Neo,日本),對PCR產物進行回收純化[天根生化科技(北京)有限公司],用Swa[New England Biolabs(NEB)公司,美國]酶切產物,4 ℃過夜自連,轉化TOP10感受態細胞[天根生化科技(北京)有限公司],用卡那霉素(Kan)篩選,選擇陽性菌落以STTM-F、STTM-R為引物送往生工生物工程(上海)股份有限公司測序,進行BLAST比對。
以連接成功的pOT2-STTM為模板,PCR刪除復制起始位點,將產物回收純化,用PacI[New England Biolabs(NEB)公司,美國]酶切pFGC5941-PacI和PCR片段,為了防止載體自連,用pFGC5941-PacI酶切120 min后再在體系中加入1 μL堿性磷酸酶(NEB,USA)處理30 min,純化,4 ℃過夜連接,轉化TOP10感受態細胞,篩選重組載體pFGC5941-STTM,選擇陽性菌落,以STTM-F、STTM-R為引物送至生工生物工程(上海)股份有限公司測序,進行BLAST比對。測序驗證正確后用液氮速凍法將重組質粒轉化到農桿菌GV3101中。
2 結果與分析
2.1 NaCl處理對zma-miR059表達的影響
由圖1可以看出,NaCl脅迫下玉米葉片、根系中的zma-miR059表達量均明顯上升。全根NaCl處理下,葉片表達量是對照葉的3.71倍,根系表達量是對照根系的3.75倍。zma-miR059在分根NaCl處理下的葉片和鹽處理側根系中的表達水平也上升,但沒有全根NaCl脅迫下的上升明顯。分根NaCl處理組葉片的表達量比對照葉片上調了120%,鹽處理側根系的表達量比對照根系上調了85%,水處理側根系的表達量與對照根系相當。結果顯示,在NaCl脅迫下zma-miR059的表達量明顯上升,與前期高通量測序結果一致,進一步表明zma-miR059是一個新的與NaCl脅迫相關的miRNA。

2.2 NaCl處理對玉米SOD、POD、CAT活性和MDA含量的影響
如圖2-A所示,用NaCl處理后,玉米幼苗的葉片和根系中SOD活性均有所提高。NaCl處理對葉片中SOD活性的影響比對根系中SOD活性的影響更大;SOD活性在對照、分根NaCl處理和全根NaCl處理葉片中呈現出明顯的上升趨勢,且在全根NaCl處理的玉米葉片中SOD活性達到最大值;處理組根系中的SOD活性雖然也增加了,但沒有葉片增加得明顯。
NaCl處理能夠在一定水平上影響幼苗的POD活性。如圖2-B所示,NaCl處理后,葉片中的POD活性變化并不明顯,其中分根NaCl處理呈現出微小的下降趨勢。但是全根、分根NaCl處理的幼苗根系中POD活性均增加。
如圖2-C所示,與POD、SOD的活性變化不同,NaCl處理后玉米幼苗根系和葉片中的CAT活性明顯降低,特別是在全根NaCl處理的玉米幼苗中,CAT活性在其葉片中有明顯降低,這與鄭世英等的研究結果一致[16]。
如圖2-D所示,NaCl處理對玉米幼苗的葉片和根系中MDA含量影響明顯,全根NaCl處理的葉片中MDA含量是對照葉片中的4.25倍,分根NaCl處理的葉片中MDA含量是對照的2.06倍。全根NaCl處理的根系中MDA含量增加了 2.91 倍,分根處理的根系中MDA含量增加了2.01倍。經NaCl處理后,MDA含量在玉米幼苗葉片和根系的對照組、分根NaCl處理組及全根NaCl處理組中均呈現出明顯的上升趨勢。

2.3 zma-miR059-STTM表達載體的構建
按照第“1.2.5”節中描述的方法進行載體構建,對重組質粒進行菌落PCR或酶切鑒定,鑒定正確后通過測序最終確定STTM的序列。由圖3可以看出,1、2、3泳道檢測到的菌落PCR片段大小為134 bp,與預期大小一致,表明連接成功。由圖4可以看出,酶切片段為刪除pOT2-STTM復制起始位點的PCR片段,大小為2 837 bp,與PCR片段一樣,說明 pFGC5941-STTM重組質粒連接成功。測序比對后顯示序列正確,表明zma-miR059-STTM的表達載體構建成功。


3 討論與結論
miRNA以調控靶標的方式在轉錄后水平參與植物對逆境脅迫的響應[17]。Ding等研究發現,用鹽處理玉米根系時,miR166、miR319、miR395、miR399等表達水平顯著改變[5]。本試驗結果顯示,用NaCl處理玉米幼苗時,葉片、根系的 zma-miR059表達量均升高,表明zma-miR059可能是玉米抗鹽性相關的miRNA。此外,分根處理的玉米幼苗葉片和根系中zma-miR059的表達量低于全根NaCl處理,表明分根處理能夠在一定程度上緩解玉米的脅迫情況,從而影響 zma-miR059的表達量。
植物體內的SOD、CAT和POD等抗氧化酶是檢測活性氧代謝的生物標志物[18-20],MDA在植物受到傷害后產生,植物受外界脅迫越強,MDA含量越高[12,21-22],因此MDA含量及保護酶活性可以用來評判植物對外界脅迫的抵抗能力。全根NaCl處理和分根NaCl處理后,玉米幼苗葉片、根系中的SOD、POD活性均增加,表明NaCl脅迫導致植物體內膜脂過氧化、活性氧積累,而SOD等保護酶活性的增強可以有效清除活性氧,提高對脅迫的抵御能力。分根NaCl處理的玉米幼苗酶活性增加程度明顯低于全根NaCl處理,表明在NaCl濃度相同時,分根NaCl處理的膜脂過氧化程度低于全根NaCl脅迫,分根處理會在一定程度上緩解植物的膜脂過氧化水平。NaCl處理后,玉米幼苗的葉片、根系中MDA含量明顯增加,分根NaCl處理的玉米幼苗中MDA含量均低于全根NaCl處理,因此可見全根NaCl處理比分根NaCl處理會更大程度地損害植物膜系統。zma-miR059在根中的表達量變化趨勢與MDA含量、POD活性變化趨勢基本相同,都是脅迫后上升,且全根NaCl處理比分根處理增加幅度更大,進一步說明 zma-miR059 與玉米抵抗鹽脅迫相關。
Yan等構建miR165/166的STTM載體侵染擬南芥后,出現了植株葉片不規則、矮小、彎曲的表型[15],與FranCo-Zorrilla等構建的TM載體[23]相比,Yan等構建的突變體沉默效率更高[15]。本試驗表明,zma-miR059是1個與玉米鹽脅迫相關的miRNA,為了進一步研究zma-miR059的作用機制,揭示其功能,筆者構建了STTM載體,并進行了農桿菌轉化,下一步將獲得STTM-zma-miR059轉基因玉米,期望通過轉基因玉米試驗進一步明確zma-miR059與抗鹽性的關系。

