丹參素通過激活Wnt/β-catenin通路促進大鼠原代成骨細胞的分化
閆小飛,張富軍,杜小娟,武麗濤,李冬民,韓 燕
(西安交通大學基礎醫學院生物化學與分子生物學系,西安 710061)
骨質疏松癥是由多種原因導致的骨密度和骨質量下降、骨超微結構破壞,造成骨脆性增加,從而易發生骨折的全身性骨病。目前,全球約有2億人患有骨質疏松癥[1-2]。在骨中,成骨細胞負責骨質形成,破骨細胞參與骨質吸收。骨形成減少、骨吸收增加或不變,導致骨質凈流失均會造成骨質疏松[3]。增強成骨細胞活性與分化,促進骨質生成,是有效預防骨質疏松的方法之一。
丹參是著名的傳統中藥,具有抗氧化、改善微循環和防止血栓形成等多種功能[4-6]。近年來研究發現,丹參可促進骨愈合,預防股骨頭壞死,有效降低絕經期婦女骨質疏松相關生化指標[7-8]。目前,已知丹參中含有丹參素、丹酚酸A和丹酚酸B等多種單體成分。丹參素(β-3,4-dihydroxyphenyl-lactic acid)是中藥丹參主要的水溶性提取物之一[9]。丹參素單體在成骨細胞發育中的作用及機制還不清楚。本研究通過觀察丹參素對體外培養大鼠成骨細胞分化的影響,為闡明丹參素是否具有調節骨生成和防治骨質疏松提供實驗證據。
1 儀器與材料
1.1儀器 Millipore Elix 純水制備系統(美國Millipore公司);Eppendorf AG 22331 Hamburg高速離心機(德國Eppendorf公司);Mx3000P/3005P實時熒光定量PCR儀(美國安捷倫公司);SYNGENE G:BOX F3凝膠成像分析系統(英國SYNGENE公司);TECAN Infinite?M1000 Pro全波長多功能酶標儀(瑞士Tecan公司);Nikon DS-Ri1-U3 數碼顯微成像系統(日本Nikon公司)。
1.2試藥 丹參素(相對分子質量為198.17,質量分數為98%),購自陜西易飛生物科技有限公司;Wnt/β-catenin抑制劑KYA1797K,分析純,購自美國Selleck公司。
1.3材料 膠原酶Ⅳ和alpha-MEM培養基,購自美國GIBCO公司;胎牛血清(fetal bovine serum,FBS)、青霉素/鏈霉素和胰酶,購自美國Hyclone公司;堿性磷酸酶(alkaline phosphatase,ALP)染色試劑和茜素紅染色試劑,購自南京建成生物工程研究所;iScriptTM cDNA 合成試劑盒,實時定量熒光PCR試劑盒,均購自美國Thermo公司。
2 方法
2.1大鼠原代成骨細胞的獲取與培養 大鼠原代成骨細胞的獲取參照文獻[10]進行。選取2~4 d新出生的SD大鼠,用斷頭法處死,在無菌條件下取出顱骨,剔凈后剪成1 mm3的碎塊,用質量濃度為2 g·L-1的膠原酶Ⅳ消化15 min以去除纖維細胞。將碎骨塊用質量濃度為2 g·L-1的膠原酶Ⅳ消化45 min,收集成骨細胞。加入含100 mL·L-1血清的a-MEM培養液,放入37 ℃、50 mL·L-1的CO2培養箱中繼續靜置培養。此后每間隔3 d換液1次,待細胞生長至培養瓶底80%時,用胰蛋白酶-EDTA消化液消化,按照1∶2傳代培養。取第3~10代的細胞進行實驗。在誘導細胞分化時,在細胞培養液中另外添加質量濃度為50 μg·mL-1的抗壞血酸和5 mmol·L-1的β-甘油磷酸鈉[11]。
2.2細胞毒性實驗 以4×103個·孔-1的細胞密度將原代成骨細胞接種于96孔板中,培養過夜。次日分別加入0,0.1,1和10 μmol·L-1的丹參素,分別于藥物作用24,48,72和96 h后,在各細胞培養孔中分別加入20 μL MTT溶液(質量濃度為0.5 mg·mL-1)繼續孵育4 h后,吸去孔內液體,再加入150 μL DMSO,振蕩10 min,在490 nm波長處測定各孔的光密度(optical density,A)值。
2.3Real-time PCR 參照RNA提取試劑盒說明書提取RNA,將提取到的總RNA用分光光度計定量。測定RNA的濃度后取1 μg逆轉錄成cDNA。運用real-time PCR檢測成骨細胞分化標志基因Runx2和Osterix mRNA的表達,選擇GAPDH作為內參。數據采用ΔΔCT法進行分析,為3次重復實驗的平均值。用到的引物序列如下。Osterix上游引物序列:5′-GGAAAGGAGGCACAAAGAAGC-3′,下游引物序列:5′-CCCCTTAGGCACTAGGAGC-3′。Runx2上游引物序列:5′-GACTGTGGTTACCGTCATGGC-3,下游引物序列5′-ACTTGGTTTTTCATAACAGCGGA-3′。GAPDH上游引物序列:5′-CCTCAAGATTGTCAGCAAT-3′,下游引物序列:5′-ACCACAGTCCATGCCATCAC-3′。
2.4ALP染色 將大鼠成骨細胞以5×104個·孔-1的密度接種于24孔板中,待細胞生長至細胞培養孔底80%后,更換培養基對細胞進行誘導培養,7 d后棄上清液,用PBS緩沖液沖洗2遍,乙醇固定30 min后用PBS緩沖液沖洗2遍,加入按照試劑盒要求配制的染液染色10 min,蒸餾水沖洗2遍后鏡下觀察成像。
2.5鈣化結節染色 將大鼠成骨細胞以5×104個·孔-1的密度接種于24孔板中,待細胞生長至細胞培養孔底80%后,更換培養基對細胞進行誘導培養,20 d后去除細胞培養上清液,用PBS緩沖液沖洗細胞2遍,乙醇固定30 min后用PBS緩沖液沖洗2遍,加入質量濃度為2 g·L-1的茜素紅染液(pH值為8.4),37 ℃染色30 min,蒸餾水沖洗2遍后顯微鏡下觀察成像。
2.6Western Blotting檢測蛋白表達 用Western Blotting檢測細胞核內β-catenin含量時,按照碧云天細胞核提取試劑盒方法提取核蛋白。取20 μg蛋白行聚丙烯酰胺凝膠電泳,轉膜,用質量濃度為100 g·L-1的脫脂奶粉封閉,4 ℃特異性單克隆抗體孵育過夜,再用HPR標記的相應二抗室溫孵育1 h,以上各步驟間用TBST洗膜5 min。增強ECL顯影液顯影。用Image J分析軟件測定圖像條帶灰度值,計算蛋白相對含量。
2.7統計學處理 采用SPSS 19.0軟件的單因素方差分析對實驗數據進行處理,以P<0.05為差異有統計學意義。
3 結果
3.1丹參素對原代成骨細胞的增殖活性無影響 通過MTT法檢測丹參素對原代成骨細胞增殖活性的影響。結果發現,0,0.1,1和10 μmol·L-1的丹參素對原代成骨細胞增殖活性均無影響,見圖1。
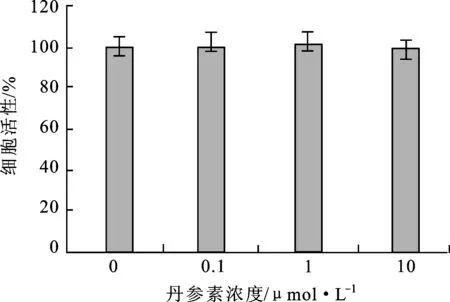
圖1不同濃度的丹參素對大鼠成骨細胞增殖的影響
Fig.1 Effect of different concentration of tanshinol on rat osteoblastic cell proliferation
3.2丹參素提高原代成骨細胞分化基因Runx2和Osterix的mRNA表達 原代成骨細胞在不同條件培養基中培養48 h后,應用Real-time PCR檢測成骨細胞分化基因Runx2和Osterix的mRNA表達。結果發現,與丹參素未處理的細胞相比,在1和10 μmol·L-1丹參素處理的成骨細胞中Runx2和Osterix的mRNA表達明顯升高(P<0.05);然而0.1 μmol·L-1丹參素處理的成骨細胞中Runx2和Osterix的 mRNA無明顯改變。見圖2。
3.3丹參素增強原代成骨細胞ALP的活性 ALP是成骨細胞分化的標志物。ALP染色結果發現,1和10 μmol·L-1丹參素處理組細胞質藍染較深且陽性部位較多。結果表明,1和10 μmol·L-1丹參素處理組細胞ALP染色強度均明顯高于丹參素未處理組,見圖3。提示ALP的活性隨丹參素濃度的升高而增強。
3.4丹參素促進成骨細胞鈣化 細胞培養21 d后,茜素紅染色結果顯示,丹參素未處理組細胞未見鈣化結節形成。而1和10 μmol·L-1丹參素處理組成骨細胞可見大量礦化結節,見圖3。研究結果表明,一定濃度的丹參素能夠促進成骨細胞分化并形成鈣化結節。
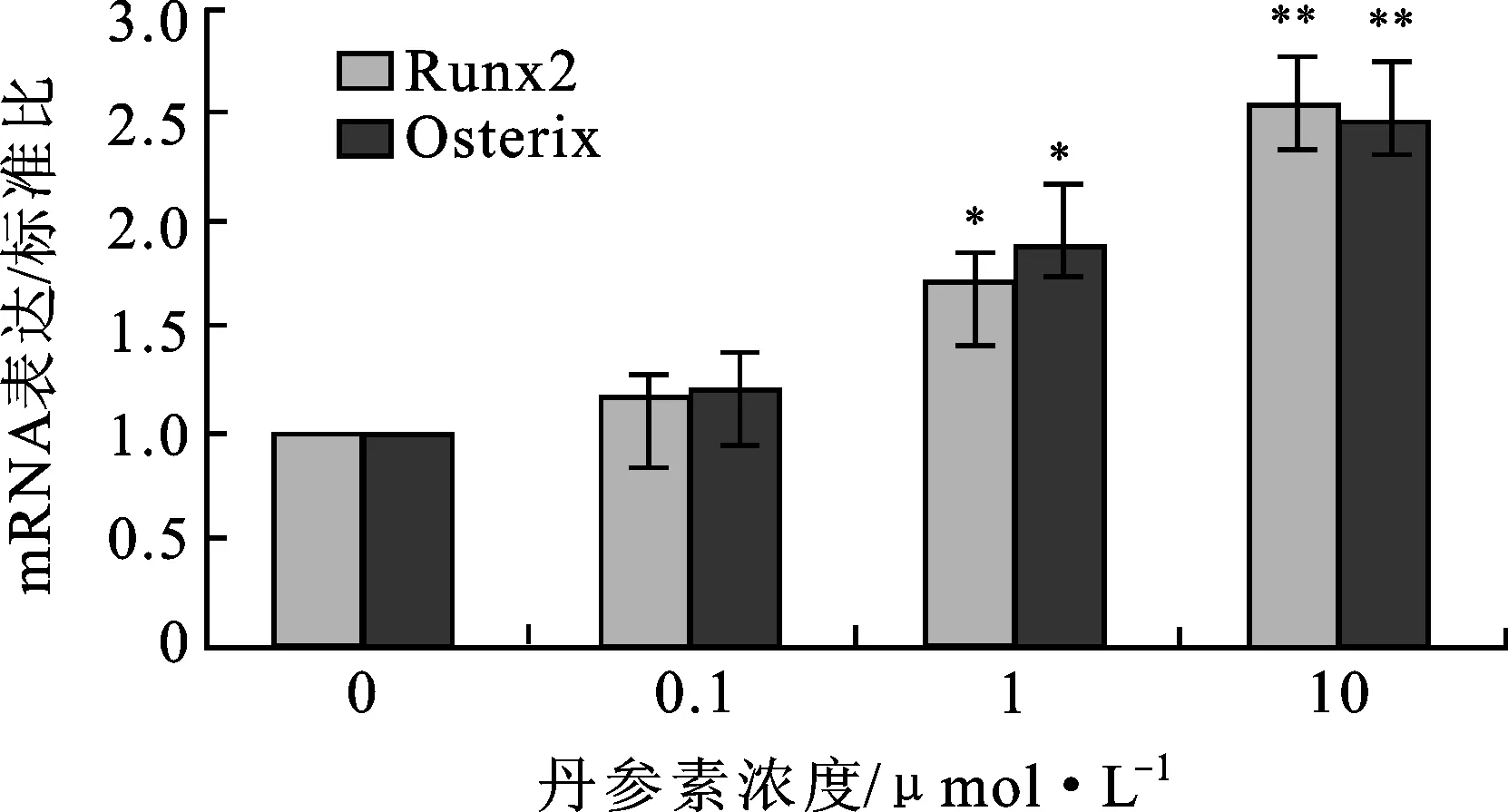
圖2不同濃度丹參素對Runx2和OsteorixmRNA表達的影響
注:*P<0.05,**P<0.01。
Fig.2 Effect of different concentration of tanshinol on Runx2 and Osteorix mRNA expression
Note:*P<0.05,**P<0.01.

圖3成骨細胞染色結果
Ⅰ.ALP染色;Ⅱ.茜素紅染色。A.0 μmol·L-1丹參素處理組(×40);B.0.1 μmol·L-1丹參素處理組(×40);C.1 μmol·L-1丹參素處理組(×40);D.10 μmol·L-1丹參素處理組(×40)。
Fig.3 Staining results of osteoblastic cell
Ⅰ.ALP staining;Ⅱ.ARS staining.A.0 μmol·L-1tanshinol-treated group (×40);B.0.1 μmol·L-1tanshinol-treated group (×40);C.1 μmol·L-1tanshinol-treated group (×40);D.10 μmol·L-1tanshinol-treated group (×40).
3.5Wnt/β-catenin通路活化參與丹參素對成骨細胞的分化調控 文獻報道,Wnt/β-catenin信號通路在調節成骨細胞分化及骨形成過程中具有重要作用[12]。β-catenin由胞漿移至核內是這一信號通路活化的重要環節[13]。原代成骨細胞在不同條件培養基中培養48 h后,收集細胞,提取核蛋白。Western Blotting檢測結果顯示,1和10 μmol·L-1丹參素處理組成骨細胞β-catenin的核內表達量明顯高于丹參素未處理組(P<0.05),見圖4A和4B。KYA1797K是有效的、高度選擇性的Wnt/β-catenin抑制劑[14]。丹參素處理成骨細胞前10 min,在細胞培養基中加入KYA1797K (0.1 μmol·L-1)。分析KYA1797K聯合丹參素共同處理組和丹參素單獨處理組中成骨細胞分化基因Runx2的mRNA表達。結果發現,與丹參素單獨處理組相比,Runx2基因mRNA表達水平在KYA1797K聯合丹參素共同處理組細胞中明顯降低(P<0.05)。結果表明,Wnt/β-catenin通路參與丹參素對成骨細胞分化過程的調控,見圖4C。

圖4Wnt/β-catenin通路活化參與丹參素對成骨細胞的分化調控
A.β-catenin免疫印跡代表圖;B.β-catenin免疫印跡統計結果;C.不同處理條件下Runx2的mRNA表達。*P<0.05,
**P<0.01。
Fig.4 Activation of Wnt/β-catenin pathway was involved in the effect of tanshinol on osteoblastic cell differentiation
A.representative Western blotting ofβ-catenin;B.statistic result on Western blotting data ofβ-catenin;C.Runx2 mRNA expression on different culture condition.*P<0.05,**P<0.01.
4 討論
丹參是被廣泛應用的一味中藥,具有抗氧化、改善微循環、防止血栓形成等多種功能[6,15]。近年來研究發現,丹參能夠促進骨愈合,對預防股骨頭壞死及治療骨質疏松有很好的功效[7]。SD大鼠模型已證實丹參提取物能有效治療由糖皮質激素引起的骨質疏松癥[8]。體外實驗也已證實丹參注射液能夠增強小鼠成骨細胞ALP的活性以及抑制小鼠破骨細胞的生成[16]。
丹參素是中藥丹參的主要水溶性提取物之一。崔燎等[8]在對比研究丹參提取物和丹參素對體外培養成骨細胞ALP活性的影響時發現,丹參提取物的作用與丹參素作用一致,因此推測丹參提取物的作用成分很可能就是丹參素[7,17]。在本研究中,我們用大鼠原代成骨細胞為模型,多指標綜合觀察丹參素對體外培養大鼠成骨細胞分化的影響。Runx2和Osterix是成骨細胞早期分化的標志性基因[18]。Real-time PCR檢測結果顯示,一定濃度的丹參素能夠促進Runx2和Osterix的 mRNA表達,說明丹參素具有促進成骨細胞早期分化的作用。ALP是促進骨間質礦化的重要酶,能夠促進局部鈣、磷濃度升高,有助于骨的鈣化。ALP活性反映成骨細胞的分化狀態[19]。研究發現,丹參素能夠增強原代成骨細胞ALP的活性,且這種增強作用具有劑量依賴性,ALP活性隨丹參素濃度的升高而提高。鈣鹽沉積導致鈣化結節形成是成骨細胞分化至中晚期的主要指標。在誘導分化3周后,我們用茜素紅染色法證實,丹參素能夠促進成骨細胞分化形成鈣化結節。成骨細胞分化是多因子、多通路參與的復雜過程。Wnt/β-catenin是調節成骨細胞分化及骨形成中的一條重要信號通路[12]。當Wnt信號通路活化時,胞質內β-catenin由胞漿轉運至胞核,進而調控下游成骨細胞分化基因轉錄和表達[13,20]。我們用Western Blotting實驗證實,丹參素處理組成骨細胞β-catenin的細胞核內表達量明顯高于對照組,提示丹參素通過激活Wnt/β-catenin通路促進成骨細胞分化。應用Wnt/β-catenin信號通路抑制劑進一步證實,抑制Wnt/β-catenin通路活化能夠抑制丹參素對成骨細胞分化的調控。
成骨細胞的骨形成與破骨細胞的骨吸收兩者間保持動態平衡是維持骨正常狀態的基礎。增強成骨細胞分化是抑制骨質疏松的重要手段。本研究證實,一定濃度的丹參素可有效促進成骨細胞的分化;且丹參素促進成骨細胞的分化與激活Wnt/β-catenin通路有關。本研究為闡明丹參素是否具有抗骨質疏松作用提供了新的實驗依據。

