不同介入栓塞化療方案聯合射頻消融治療原發性肝癌療效及對患者免疫功能的影響
段惠龍
1.空軍軍醫大學西京醫院(西安710032),2.西安市鄠邑區人民醫院腫瘤科(西安710300)
主題詞 肝腫瘤/治療 @介入栓塞化療 @射頻消融 免疫, 細胞
原發性肝癌(PLC)發病率高,進展迅速,約90%的患者發現時,已發展為中晚期。經動脈化療栓塞術(TACE)聯合射頻消融術(RFA)為目前臨床上廣泛使用的治療PLC的非手術方法,其通過對肝癌組織進行精準的栓塞治療,使血供豐富的腫瘤缺血壞死,達到治療目的,具有創傷小、恢復快以及并發癥少等特征[1]。洛鉑與順鉑均為TACE中的常用鉑類抗腫瘤藥物,但關于二者療效比較的研究較少,本研究以134例PLC患者為對象,研究了不同介入栓塞化療方案聯合射頻消融對原發性肝癌患者療效及免疫功能的影響。
資料與方法
1 一般資料 選取2014年1月到2016年12月入我院介入科治療的PLC患者134例,按照隨機數字表法分為洛鉑組和順鉑組,各67例。其中洛鉑組患者男42例,女25例,年齡47~76歲,平均年齡(59.97±6.57)歲,Child-Pugh A級37例,B級30例,左肝33例,右肝34例。奧沙利鉑組男40例,女27例,年齡48~79歲,平均年齡(60.04±6.73)歲,Child-Pugh A級39例,B級28例,左肝35例,右肝32例。兩組患者在性別、年齡、病情等基線資料方面進行比較,差異無統計學意義(P>0.05)。納入標準:患者均經病理學診斷確診為PLC;門靜脈未發生完全阻塞,或發生完全阻塞但有新的側支循環形成;腫瘤直徑>5 cm。排除標準:Child-Pugh分級≥C級;凝血功能嚴重不足者;癌細胞發生遠處轉移,生存期小于3個月者;腫瘤大小占肝臟70%者;其他臟器嚴重功能不全者;并發其他惡性腫瘤者;治療前行射頻消融等治療者;不接受隨訪者;對本研究所用藥物及造影劑過敏者;免疫功能障礙者。研究開始前患者均對本研究知情同意,同時簽署知情同意書,該研究獲得本院醫學倫理委員會批準后進行。
2 治療方法 兩組患者均行TACE和RFA,使用Seldinger法對股動脈進行穿刺,隨后在DSA下將導管置入腹腔動脈中,并在肝動脈注入造影劑,觀察患者腫瘤的位置和大小等,同時在腫瘤動脈血管中置入微導管,注入化療藥物和栓塞劑。順鉑組使用順鉑(國藥準字H20040813)20 mg/m2,5-Fu(國藥準字H20057995)750~1000 mg,絲裂霉素(國藥準字H19999025)10~20 mg,洛鉑使用洛鉑(國藥準字H20050308)20 mg/m2,5-Fu(國藥準字H20057995)750~1000 mg,絲裂霉素(國藥準字H19999025)10~20 mg。根據病灶大小,兩組患者均使用吡柔比星(國藥準字H20045983)20~30 mg和碘化油(批準文號H20050307)5~20 ml,當碘化油使用超過20 ml仍達不到效果后,應使用明膠顆粒進行血管栓塞。行TACE 2~3周后,進行RFA治療,對肝臟進行CT掃描,確定腫瘤的大小、位置后,確定穿刺針的方向、角度、深度等相關信息,并在CT引導下,使用射頻治療儀置入穿刺針,并行消融治療。燒灼功率90 W,消融溫度定為100 ℃,根據腫瘤情況,確定消融時間,當腫瘤較大時,可分多次多點進行。
3 觀察指標 ①T淋巴細胞亞群:采用流式細胞儀測定治療前后患者CD3+、CD8+和CD4+/CD8+的含量變化;②免疫球蛋白:使用比濁法測定治療前后兩組患者的IgA、IgG、和IgM 含量的變化;③甲胎蛋白(AFP):使用ELISA法測定兩組患者治療前后AFP的變化。
4 療效評價 ①RFA治療1月后對兩組患者的療效進行評價,評價標準:治療后患者腫瘤完全消失,并持續時間≥4周為完全緩解;治療后可見腫瘤縮小≥50%,沒有產生新病灶,且持續時間≥4周為部分緩解;治療后腫瘤縮小<50%,或者腫瘤增大≤25%為穩定;治療后腫瘤增大>25%,或者產生新的病灶,為進展。治療有效率=(完全緩解+部分緩解+穩定)×100%/病例數。②1年生存率:觀察并比較兩組患者的1年生存率,記錄起點為患者開始治療的時間,終點為患者死亡或者訪截止時間。
5 安全性分析 對治療后兩組患者出現的副反應進行統計分析,包括下肢水腫、食欲不振、感染、惡心嘔吐、腹瀉、發熱等情況。

結 果
1 兩組患者治療前后的T淋巴細胞亞群變化 治療前,兩組患者的CD3+、CD8+和CD4+/CD8+差異無統計學意義(P>0.05)。與治療前相比,CD3+和CD4+/CD8+顯著升高(P<0.05),CD8+顯著降低(P<0.05)。治療后,順鉑組CD3+和CD4+/CD8+顯著低于洛鉑組(P<0.05),CD8+顯著高于洛鉑組(P<0.05),見表1。
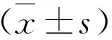
表1 治療前后兩組患者T淋巴細胞亞群的變化
注:與治療前相比,#P<0.05;與洛鉑組相比,*P<0.05
2 兩組患者治療前后的免疫球蛋白和甲胎蛋白變化 治療前,兩組患者IgA、IgG、IgM和AFP水平差異無統計學意義(P>0.05)。與治療前相比,IgA、IgG和IgM水平顯著升高(P<0.05),AFP顯著降低(P<0.05)。治療后,順鉑組IgA、IgG和IgM水平顯著低于洛鉑組(P<0.05),AFP顯著高于洛鉑組(P<0.05),見表2。
3 兩組患者的療效評價 治療后,兩組患者的治療有效率差異無統計學意義(P>0.05),順鉑組的一年生存率顯著低于洛鉑組(P<0.05),見表3。
注:與治療前相比,#P<0.05;與洛鉑組相比,*P<0.05

表3 兩組患者的療效評價 [例(%)]
注:與洛鉑組相比,*P<0.05
4 兩組治療方法的安全性分析 治療后,兩組患者均出現了副反應,下肢水腫、感染和發熱的發生率差異無統計學意義(P>0.05),洛鉑組食欲不振、惡心嘔吐和腹瀉的發生率顯著低于順鉑組(P<0.05),見表4。
注:與洛鉑組相比,*P<0.05
討 論
PLC患者在發病早期常常并無較為明顯的癥狀,等確診時往往為中晚期,且常合并肝硬化、腹水等其他疾病,手術切除難度較大[2]。PLC具有較高的病死率,研究表明,PLC的中位生存時間小于6個月,三年生存率僅為39.5%[3]。目前隨著醫療技術的進步,TACE和RFA等介入技術被廣泛應用于腫瘤的非手術治療方法中。多個研究表明,單純使用TACE治療效果低于TACE聯合RFA,這可能是由于TACE術通過栓塞肝動脈及將抗腫瘤藥物置于腫瘤組織內,往往不能徹底的停止腫瘤組織血液供給,從而可能會造成肝癌的復發及轉移,降低治療效果[4]。肝癌細胞對熱較為敏感,當組織溫度達到100℃時,腫瘤組織即可發生碳化[5]。通過CT引導,確定腫瘤位置和數量,隨后使用RFA,能夠進一步減少TACE術后殘留的癌細胞,并增強TACE中化療藥物的毒性,使腫瘤組織發生壞死,從而達到治療目的[6]。此外,朱德東等[7]使用TACE聯合射頻消融技術治療肝癌,結果表明,與單純使用TACE相比,兩種技術聯合使用能夠顯著改善患者的免疫功能和AFP水平,延長患者的生存時間和生活質量。
PLC患者存在明顯的免疫功能缺陷,表現為機體內T淋巴細胞亞群和免疫球蛋白的變化[8]。研究發現,PLC能夠通過多種有效途徑抑制機體抗癌免疫反應的發生,肝癌細胞通過對免疫細胞的浸潤,使免疫細胞處于無應答狀態,從而導致免疫功能缺陷的發生[9-10]。AFP是檢測患者PLC是否發生轉移或復發較為敏感的指標,AFP顯著降低暗示經過治療后,患者的預后較好[11]。本研究發現,治療后患者的CD3+、CD4+/CD8+、IgA、IgG和IgM顯著升高(CD8+、AFP顯著降低,其中洛鉑組患者的變化更大,表明洛鉑對患者免疫功能的恢復效果更佳。陸莎等[12]對非小細胞癌的研究表明,與順鉑組相比,洛鉑組能夠顯著改善患者的免疫功能,降低不良反應。
洛鉑是一種新型的抗腫瘤藥物,在治療過程中,不需要進行水化和利尿,對機體的不良反應較少。本研究表明,治療后兩組患者治療有效率差異無統計學意義,洛鉑組的一年生存率顯著高于順鉑組,惡心、嘔吐和食欲不振的發生率顯著低于順鉑組,暗示洛鉑對胃腸道的刺激小于順鉑。關于洛鉑和順鉑在PLC患者中的應用需要擴大樣本量進行進一步研究。
綜上所述,使用洛鉑的TACE聯合RFA的治療方案能夠有效改善患者機體免疫功能,提高PLC患者的1年生存率,且不良反應發生率較低,值得在臨床上推廣應用,關于該方案的遠期療效還需要進一步研究。

