丁基苯酞抑制晚期糖基化終產物誘導的內皮細胞損傷及其機制
趙振華 陳枝挺 劉昌云 吳小敏 李元霄 林漢斌 車春暉 黃華品
(福建醫科大學省立臨床學院 福建省立醫院神經內科,福建 福州 350001)
腦梗死、心肌梗死、下肢動脈硬化閉塞癥等是2型糖尿病最常見的并發癥和最主要的死亡原因〔1〕。目前認為內皮功能損傷是動脈粥樣硬化形成和進展的始動因素。在糖尿病狀態下,升高的血糖與蛋白質、核酸或脂質發生非酶糖基化,形成具有極長半衰期的晚期糖基化終產物(AGEs)〔2〕。AGEs與內皮細胞膜上的糖基化終產物受體(RAGE)結合加速了活性氧自由基(ROS)生成,一方面導致血管內皮舒縮功能障礙,另一方面促進炎癥因子表達升高,加快了糖尿病患者內皮細胞損傷,因此,AGEs的持續損傷是糖尿病血管并發癥的重要觸發因素〔3〕。如何對抗AGEs的促動脈粥樣硬化作用一直是學者關注的熱點〔4〕。
左旋丁基苯酞(L-3-n-butylphahalide)又名芹菜甲素(apium graveolens linn),是從芹菜種籽中分離出的有效成分,根據其結構式,其異構體右旋丁基苯酞(d-3-n-butylphahalide)被合成。之后其混合物消旋丁基苯酞(NBP)作為臨床藥物被發展起來〔5〕。NBP能夠通過多種途徑減輕神經細胞缺血缺氧損傷,于2002年11月正式通過國家食品藥品監督管理局的審批成為治療腦卒中的臨床藥物,適應于腦梗死急性期治療〔6〕。Li等〔7〕研究表明NBP對缺氧缺糖損傷的內皮細胞也有保護作用,能夠抑制缺氧缺糖導致的氧化應激、線粒體損傷和細胞凋亡。但NBP對AGEs誘導的內皮細胞非缺氧缺糖損傷是否也具有保護作用尚未見相關報道。本研究建立AGEs誘導的人臍靜脈內皮細胞(HUVECs)模型,采用不同劑量的NBP進行干預,并初步探討NBP對內皮細胞的作用及其相應機制。
1 材料與方法
1.1材料 NBP(純度99.6%)由石藥集團恩必普藥業有限公司贈送。HUVECs購自美國ATCC公司,MTT(美國Sigma公司),胎牛血清(美國Invitrogen公司),DMEM培養液和胰蛋白酶(Gibco公司),Hoechst 33258染色試劑盒(中國碧云天生物技術研究所),熒光定量RT-PCR試劑盒(美國Promega公司),Bax和Bcl-2一抗抗體(美國R&D公司),β-actin一抗抗體(美國GenScript 公司),相應二抗抗體(美國Sigma公司),PCR引物由上海生工生物工程有限公司合成,一氧化氮(NO)檢測試劑盒(南京建成生物工程研究所)。2',7'-二氯熒光黃雙乙酸鹽(DCFH-DA,美國Sigma公司)。
1.2AGEs的制備 5 g牛血清白蛋白(BSA)和9 g D-葡萄糖溶于0.2 mol/L磷酸鹽緩沖液(PBS,pH=7.2)中,將配好的溶液通過0.22 μm的濾頭過濾除菌后恒溫37℃避光孵育12 w。相同條件下,以5 g BSA溶解于0.2 mol/L PBS(pH=7.2)中孵育作為對照。AGEs和BSA內毒素含量由內毒素檢測試劑盒測定并確保<1.0 kU/L。采用聚氰基丙烯酸正丁酯(BCA)法檢測AGEs濃度,加入含10% 胎牛血清的DMEM培養基中配置AGEs終濃度為200 μg/ml。
1.3AGEs環境下內皮細胞培養及實驗分組 HUVECs于含10%胎牛血清的DMEM細胞培養液中常規培養于37℃、飽和濕度、5%CO2的恒溫培養箱中。采用200 μg/ml AGEs對HUVECs進行干預,以200 μg/ml BSA作為正常對照組,AGEs干預組根據不同的NBP終濃度分為0、0.1、1.0、10.0、100.0 μmol/L 5組,其中以NBP終濃度 0 μmol/L組為陽性對照組。用于實驗的內皮細胞接種于6孔板培養基,待細胞貼壁后分別加入不同濃度NBP共培養0.5 h。然后加入200 μg/ml AGEs或 BSA再培養48 h。
1.4MTT法測定細胞增殖率 取不同處理的細胞,調整細胞濃度為1×105ml種植于96孔細胞培養板,每孔100 μl,每組設3個復孔,于37℃、5%CO2培養,待細胞生長融合至70%~80%時開始實驗。每孔加入20 μl MTT(5 mg/ml),繼續培養4 h后,小心吸棄培養液,每孔加入150 μl二甲基亞砜(DMSO),室溫振蕩10 min至藍紫色結晶完全溶解,用酶標儀于波長490 nm處測吸光度OD值。
1.5HUVECs凋亡檢測 在培養板中將已制備完成的細胞爬片用1×PBS浸洗3次,用4%多聚甲醛固定細胞爬片15 min,再用1×PBS浸洗細胞爬片3次,吸干多余的PBS。加入Hoechst 33258工作液染色,室溫培育15 min,再用1×PBS浸洗細胞爬片3次,吸干多余的PBS后,用含抗熒光猝滅劑的封片液封片;然后在激光掃描共聚焦顯微鏡下采集圖像。
1.6蛋白印跡試驗(Western印跡) 檢測各蛋白質表達用冷的PBS洗滌細胞3次后,于細胞裂解液中重懸細胞,冰上裂解30 min,4℃,8 000 r/min離心10 min,將上清液轉移到新的EP管,用改良的Lowry法進行蛋白定量。各組取等量的蛋白上樣,經聚丙烯酰胺凝膠電泳分離后,電轉移至聚偏氟乙烯(PVDF)膜,5%脫脂奶粉室溫封閉,用相應稀釋后的一抗4℃孵育過夜,1×TBST漂洗3次后加入相應二抗,室溫孵育2 h,化學發光法進行顯色,對條帶進行吸光度積分掃描。β-actin作為內參照。Bcl-2和Bax蛋白表達采用目標蛋白吸光度值/內參照吸光度值的比值進行比較。
1.7流式細胞學檢測細胞內ROS含量 各實驗組細胞棄去培養液,加入終濃度為10 μmol/L的DCFH-DA,以DMSO作為溶劑對照,37℃孵育細胞30 min,每3 min顛倒混勻,使探針與細胞充分接觸。棄去培養液,用PBS洗滌3次,以充分去除未進入細胞內的DCFH-DA。0.25%胰酶消化細胞2 min,加入培養基終止消化,3 000 r/min離心5 min收集細胞,用PBS洗滌2次,收獲1.0×106細胞懸液。使用485 nm激發波長,525 nm發射波長,流式細胞儀檢測ROS。
1.8NO檢測 采用硝酸鹽還原法。棄去細胞培養上清,用細胞刮將細胞刮下,加入提取液0.5 ml,混勻2 min,將細胞破碎制成細胞懸液,取樣0.1 ml依照試劑盒說明操作,反應完成后,采用酶標儀分析,比色波長為550 nm。NO含量(μmol/L)=(測定OD值-空白管OD值)/(標準管OD值-空白管OD值)×標準品濃度(20 μmol/L)。
1.9RNA提取和實時熒光定量PCR 收獲1.0×105細胞,棄去培養液,Trizol法提取總RNA。采用逆轉錄試劑盒(Western biotechnology)合成cDNA。采用SYBR-GREEN PCR試劑盒擴增eNOS、iNOS和β-actin。β-actin上游引物:5'-TGACGTGGACATCCGCAAAG-3',下游引物:5'-CTGGAAGGTGGACAGCGAGG-3',iNOS上游引物:5'-GGGACCCGCACCACTACA-3',下游引物:5'-AGATTCTGCCGAGATTTGAGC-3',eNOS上游引物:5'-GACCCTCACCGCTACAACATC-3',下游引物:5'-CACGATGGTGACTTTGGCTAG-3'。采用相對定量法分析eNOS和iNOS的表達量。表達量=2-(Ct干預組-Ct內參基因)-(Ct正常對照組-Ct內參基因),Ct:閾值循環數。
1.10統計學分析 應用SPSS19.0軟件進行t檢驗。
2 結 果
2.1各組HUVECs細胞增殖率比較 AGEs誘導后陽性對照組細胞增殖率明顯下降至(62.27±2.56)%,與正常對照組100.00%比較差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組細胞增殖率分別為(64.61±1.80)%、(66.76±2.12)%、(70.09±1.66)%和(73.56±1.98)%。其中,1.0、10.0和100.0 μmol/L NBP組與陽性對照組比較差異有統計學意義(P<0.05),100.0 μmol/L NBP組與0.1、1.0 μmol/L NBP組比較差異有統計學意義(P<0.05)。Hoechst 33258染色結果示,凋亡細胞的細胞核呈致密濃染或呈碎塊狀致密濃染,細胞質內含有大量濃染致密的顆粒塊狀熒光。陽性對照組異常染色的細胞明顯增多,隨著NBP干預濃度的增高,這些顆粒明顯減少。見圖1。
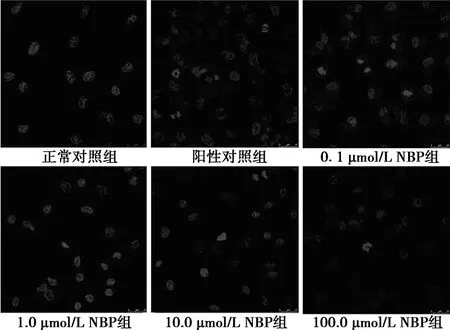
圖1 各組HUVECs細胞Hoechst 33258染色(×200)
2.2各組凋亡蛋白表達比較 AGEs誘導后,陽性對照組Bcl-2蛋白表達較正常對照組明顯降低(0.77±0.16 vs 0.29±0.02),差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組Bcl-2蛋白表達逐步升高(0.29±0.42、0.39±0.02、0.43±0.05、0.54±0.01),其中10.0 μmol/L和100.0 μmol/L NBP組與陽性對照組比較差異有統計學意義(P<0.05)。
AGEs誘導后,陽性對照組Bax蛋白表達與正常對照組相比明顯升高(0.80±0.08 vs 0.32±0.04),差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0 μmol/L和100 μmol/L NBP組Bax蛋白表達逐步降低(0.76±0.09、0.67±0.07、0.55±0.02、0.45±0.02),其中1.0、10.0和100.0 μmol/L NBP組與陽性對照組差異有統計學意義(P<0.05)。見圖2。

圖2 各組Bcl-2和Bax蛋白表達情況
2.3各組ROS比較 AGEs誘導后,陽性對照組ROS生成的熒光值為(763.0±33.8),與正常對照組(93.0±4.6)比較差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組熒光值逐漸降低(366.0±16.1、203.7±6.4、155.00±5.6、141.0±3.6),與陽性對照組比較差異均有統計學意義(均P<0.05)。
2.4各組eNOS、iNOS mRNA及NO比較合成 AGEs誘導后,陽性對照組eNOS表達明顯減少至正常對照組的(0.286±0.072)倍,與正常對照組相比差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組eNOS表達逐漸增加,分別為正常對照組的(0.29±0.07)倍、(0.47±0.09)倍、(0.62±0.05)倍和(0.87±0.30)倍,其中10.0和100.0 μmol/L NBP組與陽性對照組比較差異有統計學意義(P<0.05)。
AGEs誘導后,陽性對照組iNOS表達明顯增加至正常對照組的(3.94±0.56)倍,與正常對照組相比差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組iNOS表達逐漸減少,分別為正常對照組的(3.78±0.38)倍、(3.10±0.97)倍、(2.29±0.46)倍和(1.74±0.55)倍。其中,10.0和100.0 μmol/L NBP組與陽性對照組比較差異有統計學意義(P<0.05)。
AGEs誘導后,陽性對照組細胞內NO合成明顯減少至(14.254±0.555)μmol/L,與正常對照組(20.263±0.820)μmol/L相比差異有統計學意義(P<0.05)。經NBP干預后,0.1、1.0、10.0和100.0 μmol/L NBP組NO合成分別為(14.273±0.163)、(15.646±0.257)、(16.485±0.322)和(18.568±0.567)μmol/L。其中,1.0、10.0和100.0 μmol/L NBP組與陽性對照組比較差異有統計學意義(P<0.05)。
3 討 論
本研究初步證實了NBP能有效抑制AGEs對內皮細胞的損傷。Hoechst 33258染色證實了NBP能夠有效抑制AGEs誘導的內皮細胞凋亡。凋亡相關蛋白Bax和Bcl-2表達的相應改變進一步支持了NBP的作用。NBP降低了AGEs誘導的ROS生成,在0.1 μmol/L的NBP干預下細胞內ROS的生成即明顯減少,且隨著NBP濃度的升高,ROS生成也逐漸減少,表現出明顯的劑量依賴性。內皮細胞功能障礙,特別是NO生物合成減少導致的內皮功能障礙,普遍存在于糖尿病患者中。這是糖尿病血管并發癥的發生和進展的重要因素〔8〕。NO是內皮細胞功能的標志物之一,是體內最強大而有效的血管舒張因子。研究表明,糖尿病患者體內NO合成減少和活性降低,導致血管痙攣和異常收縮、誘發血小板聚集及血管增生〔3〕。張勝雷等〔9〕研究表明100 mg/L的AGEs能夠導致人臍靜脈內皮生成NO明顯減少,且隨著AGEs濃度的繼續增加,NO生成進一步減少。本研究結果表明NBP能夠有效緩解AGEs對HUVECs NO生成的抑制作用。
一氧化氮合酶是NO合成的限速酶,包括內皮型、神經型和誘導型。其中,eNOS主要存在于內皮細胞,是血管壁上NO的主要來源,eNOS脫耦聯是內皮細胞NO下降和氧自由基升高的重要機制〔10〕。iNOS則是在各種細胞因子或內毒素刺激情況下才出現大量表達,導致NO大量產生和釋放,進而直接損傷細胞〔11〕。既往研究顯示動脈粥樣硬化患者較健康對照人群體內NO 基礎水平降低,表明一氧化氮合酶的最終效應仍然是以eNOS為主導〔12〕。Xu等〔13〕研究表明,AGEs可以作用于內皮細胞,通過降低eNOS的磷酸化和蛋白表達,從而降低eNOS的活性,減少NO生成,介導血管內皮細胞功能失調。本研究結果提示,調節內皮細胞NOS表達可能是NBP上調HUVECs NO生成的途徑。
綜上,NBP存在抗自由基,保護神經元,減輕線粒體損傷等多種藥理學活性。NBP可能存在抑制AGEs誘導的內皮功能障礙的積極作用,抑制氧化應激損傷和調節NOS表達可能是NBP保護內皮細胞的機制。

