視黃醇X受體小分子配體衍生物對宮頸癌細胞周期及細胞凋亡的影響
張小麗,涂許煌,謝國斌,蔣福全,張曉坤
(廈門大學藥學院,福建廈門361102)
核受體(nuclear receptors)是廣泛分布在真核生物體內的一大類蛋白轉錄因子超家族[1].根據其天然配體的不同,核受體主要分為三大類:類固醇激素受體、非類固醇激素受體和孤兒核受體[2].視黃醇X受體(RXR)是非類固醇激素受體家族的一員,屬于配體依賴型轉錄因子.RXR在核受體中具有重要且獨特的作用,許多其他核受體通過與RXR形成二聚體來發揮生理功能[3].RXR在機體內具有廣泛的生物學作用,與配體結合后被激活、識別并與DNA上特定的應答元件結合,調控靶基因轉錄,參與調節機體的生長發育、新陳代謝、免疫、細胞增殖、分化等多種生理病理學過程[4];其表達、定位或功能異常均會導致嚴重的人類疾病,如生殖系統疾病、代謝性疾病、神經退行性疾病、腫瘤等[5],而RXR的小分子配體能夠通過調控其功能而治療疾病[6].因此,RXR是藥物開發的重要靶點.
生物體內細胞周期分為G0/G1、S、G2和M期,其調控是決定細胞命運如增殖、生長、分化等一系列生物學過程的基本機制.細胞周期受到許多監管機制的嚴格調控,有多個基因和蛋白參與,形成復雜的正、負反饋調控的分子信號系統,周期蛋白依賴性蛋白激酶(CDK)及其負調控因子在細胞周期調控中發揮重要作用[7].腫瘤的發生發展與腫瘤細胞周期的異常調控有關[8].很多臨床常用的抗腫瘤藥物如氟尿嘧啶、甲氨蝶呤、依托泊苷、長春新堿等,通過誘導腫瘤細胞周期阻滯進而誘導腫瘤細胞凋亡[9].許多新型靶向抗腫瘤藥物也是作用于腫瘤細胞增殖周期,通過靶向細胞周期的關鍵蛋白發揮抗腫瘤效應[10-11].因此,細胞周期阻滯類化合物在抗腫瘤藥物開發中具有重要意義.
已有研究發現RXRα可參與調節細胞周期相關蛋白的表達,進而調控細胞增殖[12].本實驗室前期報道了一種RXRα的小分子配體XS-23,該化合物可結合于RXRα表面的共調節因子結合位點(圖1),通過抑制腫瘤細胞中tRXRα(RXRα的N端截短片段)/PI3K/Akt 生存通路的激活,誘導多種腫瘤細胞凋亡[13].為進一步開發XS-23,本實驗室對XS-23進行結構改造和優化,合成了一系列衍生物,初期檢測衍生物的生物活性時發現部分衍生物能夠明顯影響細胞周期,這可能是RXRα新的作用機制.本研究以人宮頸癌HeLa細胞為模型,對XS-23部分衍生物(圖2)進行細胞周期活性篩選,以期從中篩選出作用于細胞周期進而誘導HeLa細胞凋亡的化合物.
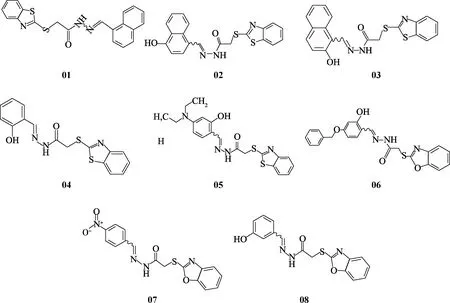
圖2 XS-23衍生物的結構Fig.2 Chemical structures of XS-23 derivatives
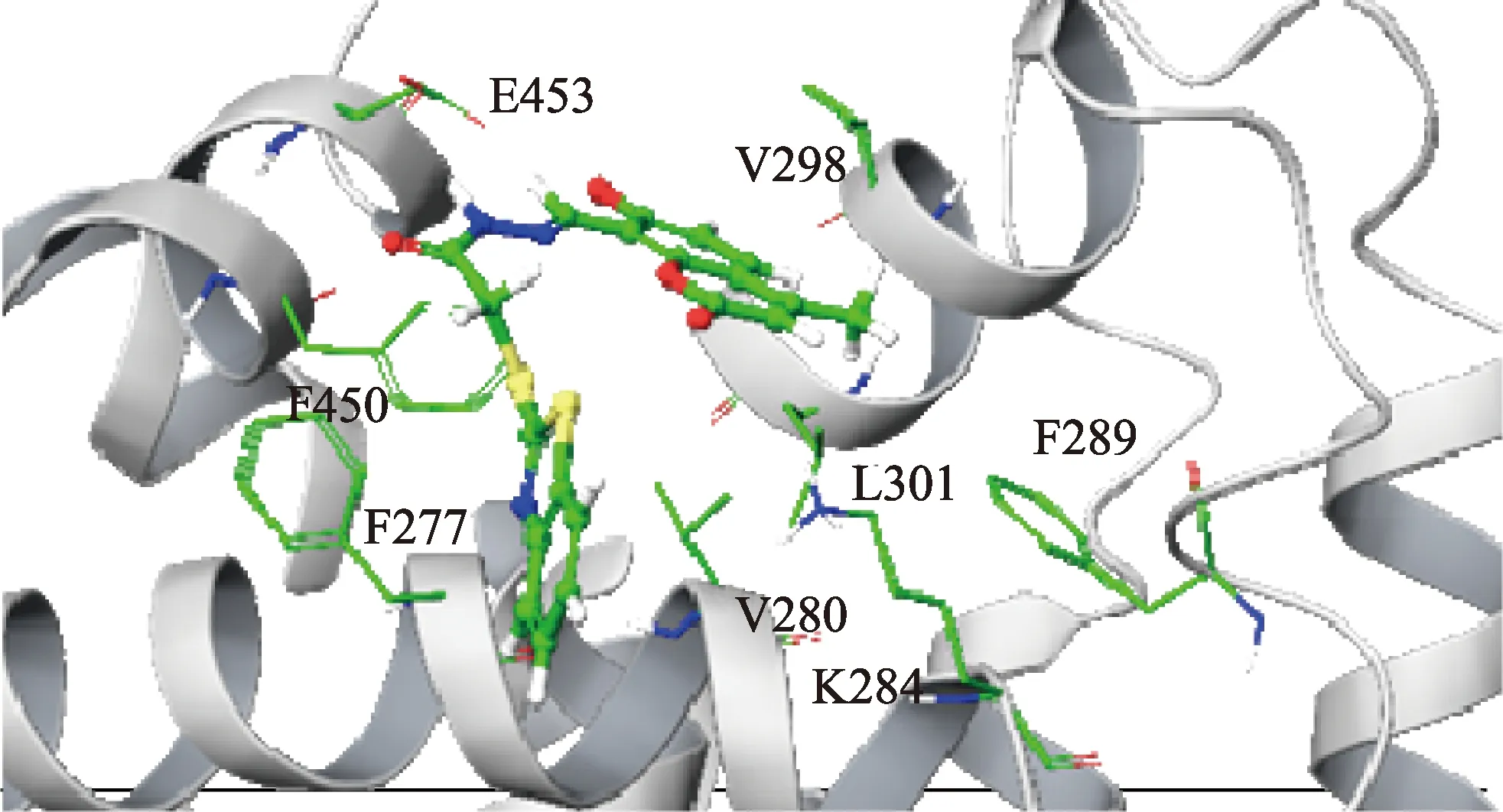
圖1 XS-23與RXRα結合模式的分子對接Fig.1 Proposed binding mode of XS-23 with RXRα by molecular docking
1 材料與方法
1.1 材 料
1.1.1 細胞株
人宮頸癌HeLa細胞來源于ATCC(American Type Culture Collection).
1.1.2 藥品與試劑
供篩選的化合物(純度>98%)由廈門大學藥學院藥物化學實驗室合成提供;聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)、細胞M期周期蛋白Cyclin B1(D5C10)、p21 WAF1/CIP1 (12D1)抗體購自CST公司;β-actin抗體購自Sigma公司;RXRα(D-20)抗體購自Santa Cruz公司;偶聯辣根過氧化物酶的山羊抗鼠、山羊抗兔二抗購自Millipore公司;脂質體2000購自Thermo公司;MEM/EBSS培養基、胎牛血清購自Gibco公司;含100 U/mL鏈霉素和青霉素的雙抗母液購自Hyclone公司;增強型化學發光(ECL)底物購自APG Bio公司;BCA蛋白分析試劑盒購自Pierce公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole dihydrochloride,DAPI)購自Roche公司;Annexin V-FITC/碘化丙啶(PI)凋亡檢測試劑盒購自BD Biosciences公司.
1.1.3 儀器設備
3111型CO2細胞培養箱、Multiskan FC型酶標儀購自Thermo公司;5424型低溫離心機、5424R型常溫離心機、A00-1-1102型流式細胞儀購自Beckman公司;MK2000-2型干式恒溫器購自杭州奧盛儀器有限公司;PowerPac200電泳儀購自Bio-Rad公司.
1.2 方 法
1.2.1 細胞培養
HeLa細胞用含10%(體積分數)胎牛血清,含100 U/L鏈霉素和青霉素的MEM/EBSS培養基于37 ℃、5%(體積分數)CO2培養箱中培養,取對數生長期的細胞進行實驗.
1.2.2 細胞轉染siRNA
當細胞密度達滿盤的70%左右時,轉染前用不含血清、不含雙抗的新鮮MEM/EBSS培養基為細胞換液,在2 mL離心管中分別用適量的培養基稀釋雙鏈siRNA、siControl(20 μmol/L)和脂質體2000,5 min后混合siRNA和脂質體溶液(siRNA和脂質體2000的體積比為2∶1),室溫放置20 min,使siRNA-脂質體復合物形成,混勻后逐滴加入細胞培養液,4 h后更換新鮮的完全培養基,干擾48~72 h后收集樣品.
1.2.3 蛋白免疫印跡(Western blotting,WB)分析
化合物處理后收集的細胞用磷酸鹽緩沖液(PBS)洗2次,細胞培養板置于冰上,加蛋白裂解液(50 mmol/L Tris-HCl(pH 7.4)、150 mmol/L NaCl、5 mmol/L乙二胺四乙酸、1%(體積分數)NP-40、0.005 g/mL脫氧膽酸鈉、0.001 g/mL十二烷基磺酸鈉(SDS),含蛋白酶抑制劑混合物和磷酸化酶抑制劑),收集細胞于1.5 mL離心管中,冰上裂解30 min;4 ℃、12 000 r/min離心10 min,取上清;用酶標儀于560 nm下測定蛋白濃度后,吸取上清加入5×SDS loading buffer,之后置于干式恒溫器中,100 ℃沸水浴5 min,常溫10 000 r/min離心30 s后上樣,或置于-20 ℃凍存備用.用12%(質量分數,下同)的SDS變性聚丙烯酰胺凝膠進行電泳分離蛋白(分離PARP及其切割蛋白用8%),90 V轉膜1.5 h;用TBST(10 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl,0.05%(體積 分數)Tween 20)配制5%(質量分數)脫脂牛奶,封閉1 h;一抗(1∶1 000稀釋)4 ℃孵育過夜(大于8 h),用TBST洗3次,每次10 min;二抗室溫孵育1 h,用TBST洗3次,每次10 min;加ECL底物,暗室中膠片曝光、顯色.
1.2.4 細胞周期分析
胰酶消化后收集細胞,2 000 r/min離心3 min,棄去培養液;PBS洗2次,2 000 r/min離心3 min,棄去PBS,加入70%(體積分數)冷乙醇4 ℃固定過夜;2 000 r/min 離心5 min,棄去固定液,用PBS洗1次,2 000 r/min 離心5 min,棄去PBS,加入400~500 μL DAPI染色液(1 μg/mL),常溫染色10 min;200目以上的篩網過濾,轉至流式檢測管,用流式細胞儀PB450通道收集細胞,檢測細胞周期.
1.2.5 Annexin V-FITC/PI檢測細胞凋亡率
胰酶消化后收集細胞,4 ℃、2 000 r/min離心3 min,棄去培養液;用預冷的PBS洗2次,2 000 r/min離心3 min,棄去PBS;用1×binding buffer 500 μL重懸細胞,加入5 μL Annexin V-FITC,混勻,室溫(25 ℃)下避光孵育10 min;再加5 μL PI,混勻,室溫下避光孵育5 min;流式細胞儀檢測,1 h內完成.
1.2.6 統計學分析
使用SPSS 23.0軟件進行統計分析,計量數據以平均值±標準差表示,兩兩比較采用t-檢驗,p<0.05為差異顯著.
2 結果與分析
2.1 化合物活性篩選
對XS-23衍生物(01~08)的活性進行初步篩選.用10 μmol/L化合物分別處理細胞6 h,通過WB檢測HeLa細胞中p21 WAF1/CIP1(細胞周期G1期檢驗點蛋白/CDK抑制蛋白,下文簡稱p21)和Cyclin B1的表達水平,分析化合物對細胞周期的影響.結果顯示,與對照二甲基亞砜(DMSO)相比,化合物05和06可以引起p21表達上調和Cyclin B1表達下調,而其余化合物無明顯影響(圖3),說明化合物05和06可能具有阻滯腫瘤細胞周期的活性.
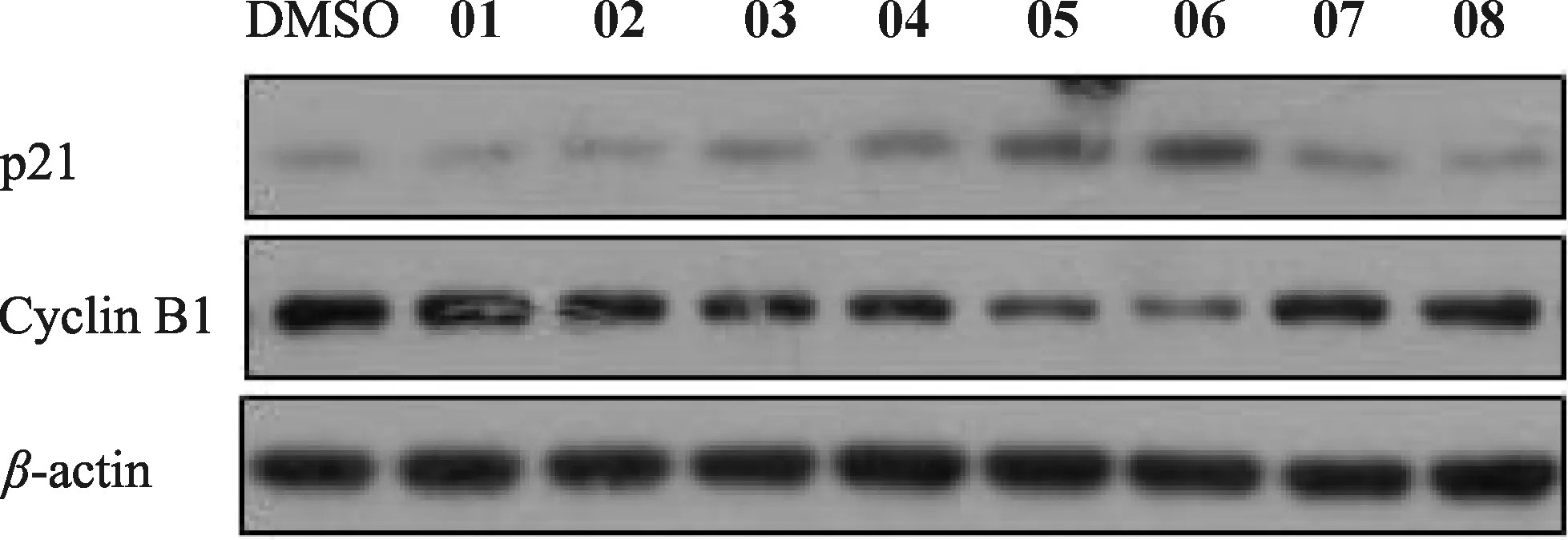
圖3 XS -23衍生物的初步篩選Fig.3 Preliminary screening of XS -23 derivatives
2.2 化合物05和06導致人宮頸癌HeLa細胞周期阻滯于G0/G1期
為了進一步檢測化合物05和06對HeLa細胞周期的影響,采用流式細胞術檢測細胞周期的變化.結果顯示:與DMSO相比,用化合物05和06(10 μmol/L,6 h)處理后G0/G1期細胞比例顯著上升(p<0.05),同時G2/M期細胞比例顯著下降(p<0.05)(表1,圖4),說明化合物05和06可以造成HeLa細胞周期阻滯于G0/G1期,且效果明顯.

圖4 化合物05和06對HeLa細胞周期的阻滯作用Fig.4 Cell cycle arresting effect on HeLa cells by compounds 05 and 06

處理G0/G1SG2/MDMSO69.37±0.458.33±0.1422.04±0.460582.69±0.32*7.89±0.499.30±0.46*0681.02±0.80*8.19±0.4810.38±0.32*
注:*與對照(DMSO)比較,p<0.05,下同.
2.3 化合物05和06對細胞周期阻滯作用的RXRα依賴性
如圖5所示:化合物05和06作用于HeLa細胞后,WB檢測結果顯示p21表達水平顯著上調(p<0.05);而用siRNA瞬時干擾RXRα的表達后,化合物05和06引起p21表達水平上調的作用減弱,與DMSO相比無顯著差異(p>0.05),說明化合物05和06對細胞周期的阻滯作用在一定程度上依賴于RXRα.
2.4 化合物05和06誘導HeLa細胞凋亡
為了進一步探討化合物05和06是否具有誘導HeLa細胞凋亡的作用,應用Annexin V-FITC/PI檢測凋亡細胞,并應用WB檢測PARP蛋白切割情況(PARP切割蛋白出現則表示細胞開始凋亡).不同濃度(10和20 μmol/L)的化合物作用于HeLa細胞24 h后,流式細胞儀檢測結果顯示:化合物05和06均可導致HeLa細胞凋亡,且隨化合物濃度增加,凋亡細胞數目逐漸升高(圖6);10 μmol/L化合物05、20 μmol/L化合物05、10 μmol/L化合物06和20 μmol/L化合物06處理下,細胞凋亡率依次為(16.59±1.84)%,(21.20±2.06)%,(13.31±0.89)%和(16.73±0.69)%,與DMSO組(3.15±0.31)%相比均有顯著性差異(p<0.05).WB檢測結果顯示,化合物05和06均可造成HeLa細胞中PARP蛋白切割,且切割效率存在濃度依賴性(圖7).上述結果說明化合物05和06具有誘導HeLa細胞凋亡的作用.
2.5 化合物05和06誘導HeLa細胞凋亡作用的RXRα依賴性
siRNA瞬時干擾實驗結果顯示:與對照(DMSO)相比,干擾RXRα表達后,化合物05和06引起的PARP切割蛋白水平均有所下降(圖8),說明化合物05和06誘導HeLa細胞凋亡的作用在一定程度上依賴于RXRα.
2.6 計算機模擬化合物05和06與RXRα的可能結合位點
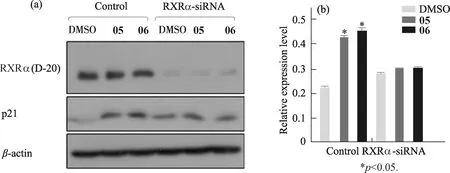
圖5 化合物05和06的細胞周期阻滯作用對RXRα的依賴性Fig.5 RXRα-dependent cell cycle arresting effect of compounds 05 and 06

圖6 Annexin V-FITC/PI檢測凋亡細胞Fig.6 The detection of apoptosis by Annexin V-FITC/PI
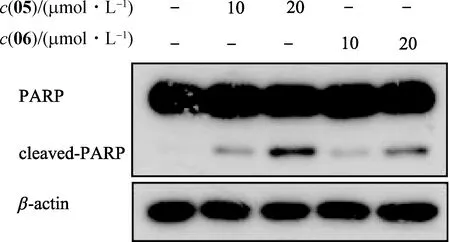
圖7 WB檢測PARP切割蛋白Fig.7 Detection of cleaved-PARP by WB
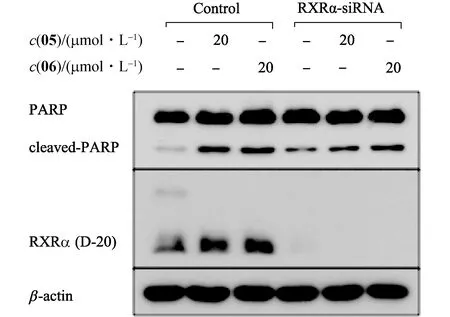
圖8 化合物05和06誘導HeLa細胞凋亡作用對RXRα的依賴性Fig.8 RXRα-dependent apoptosis effect of compounds 05 and 06
XS-23結合于RXRα表面的共調節因子結合位點,而非傳統配體所結合的配體結合口袋(ligand binding pocket, LBP),其中位于RXRα配體結合區域表面的V298位點對XS-23的結合至關重要[13].為驗證化合物05和06是否具有與XS-23相似的RXRα結合模式,使用計算機模擬對化合物05和06與RXRα結構(PDB:3FUG)進行分子對接.結果顯示:化合物05和06均可能與RXRα蛋白的helix12、helix3、helix4形成的表面區域結合;其中,位點E453和V298對2個化合物與RXRα的結合均至關重要;此外,L301對化合物05與RXRα的結合也很重要(圖9).計算機模擬結果說明,化合物05和06可能具有與XS-23相似的RXRα結合模式,但具體的結合位點可能存在差異.
3 討 論

圖9 計算機模擬化合物05 (a)和06 (b)與RXRα表面的結合位點Fig.9 Compounds 05 (a) and 06 (b) binding sites to RXRα surface by computer modeling
宮頸癌是威脅女性健康最常見的惡性腫瘤之一.在我國,宮頸癌的發病率位居女性惡性腫瘤第二位,是15~44歲女性中第三大高發癌癥[14].宮頸癌也是世界范圍內的女性高發惡性腫瘤,死亡率在所有癌癥中居第四位[15].目前,治療宮頸癌的主要手段是手術和放療.化學藥物主要使用順鉑,聯合放療用于晚期宮頸癌的治療,但多伴有較大的毒副作用,臨床上尚缺乏其他安全有效的治療宮頸癌的化學藥物[16].因此,研發治療宮頸癌的安全有效的新型藥物是近些年來國內外科研機構和制藥企業重點關注的領域之一.
抗腫瘤藥物開發的指導思想之一是直接殺傷癌細胞或是抑制腫瘤細胞的生長,而細胞增殖周期與細胞的生長直接相關.p21是CIP家族的一員,屬于抑癌因子p53的下游CDK的負調節因子,與CDK復合物結合并抑制CDK復合物的功能,阻滯細胞周期,是細胞G0/G1期檢驗點的關鍵負調節因子[17].有研究顯示p21可通過p53非依賴途徑發揮作用,而RXRα參與調控p21的表達[18].在本研究對RXRα的小分子配體XS-23衍生物的篩選中發現,化合物05和06能夠上調HeLa細胞中p21的表達水平,阻滯HeLa細胞周期于G0/G1期,最終誘導HeLa細胞凋亡,且具有一定的RXRα依賴性.實驗結果顯示化合物05和06可能通過靶向RXRα調控 p21 的功能進而影響細胞周期.此外,分子對接模擬化合物05和06與RXRα的結合可看出化合物05和06可能具有與XS-23相似的RXRα結合模式,即與RXRα表面結合,但具體的結合位點可能不同,還需進一步的實驗驗證.
近年來,靶點藥物開發成為各國藥企開發創新藥物的重點.靶向細胞周期調節蛋白以及選擇性地阻斷腫瘤細胞增殖周期是近年來靶向抗腫瘤藥開發的熱點之一[19].在精準醫療時代,腫瘤的新藥研發也取得了重大進展與突破,由傳統的大量化合物的盲目篩選轉為基于潛在有效成分或化學基團的細胞分子篩選:首先篩選找到有活性的化合物,再有針對性地進行優化,縮短了篩選周期.本研究在前期已發現的能夠誘導腫瘤細胞凋亡的RXRα小分子配體XS-23基礎上,基于結構多樣性對其結構進行改造和優化,發現了2個能夠阻滯細胞周期誘導HeLa細胞凋亡的XS-23衍生物,為該類周期阻滯類化合物的進一步優化提供了參考依據,也為進一步研究RXRα在細胞周期中的功能以及開發新型靶點抗腫瘤藥物提供了方向和思路.

