高通量測序研究李氏禾生態浮床凈化污水的微生物群落結構變化
李 楊,王 芳,楊海滟,潘 珉 ,杜勁松*
(1.昆明市滇池生態研究所,云南 昆明 650228;2.西南林業大學林學院 國家林業局西南地區生物多樣性保育重點實驗室,云南 昆明 650224;3.西南林業大學 云南省高校生物質化學煉制與合成重點實驗室,云南 昆明 650224)
【研究意義】中國許多湖泊存在水質污染和生態退化等突出問題,水體富營養化與難降解有機物污染是水污染治理的難題。據報道,中國大約75 %的地表水體不同程度的受到氮、磷、重金屬、有機污染物等污染,嚴重危害水生態系統的健康,威脅經濟發展與人民健康。因此,解決湖泊的污染、恢復水體的良好生態是可持續發展亟待解決的關鍵任務之一。【前人研究進展】湖泊污染治理是政府和學界關注的熱點,目前污水治理的技術主要有3方面,一是截污減排,通過截污、節水與污水回用技術減少污水入湖總量;二是提高水體自凈能力,包括水系疏通、生態護坡、生態修復技術等恢復水生態提高自凈能力;三是底泥治理,包括物理方法、化學方法、生物方法等。每種技術各有其優缺點,而針對中國湖泊目前存在的問題,迫切需要迅速改善污染水質,修復受損的湖泊生態系統,提高水體自凈能力,促進生態系統良性循環。隨著生物技術和生物科學的不斷進步,生物修復的優勢逐漸被人們所認知,水體和污染底泥生態系統的生物修復已成為湖泊修復的熱點,具有廣闊的市場發展前景。針對不同區域水污染特征,選擇廉價、高效且無二次污染的水污染修復技術,對于水體的修復凈化具有重要的意義。李氏禾(LeersiahexandraSwartz)又名秕殼草,在熱帶及亞熱帶地區廣泛分布,為多年生禾本科草本植物,具發達匍匐莖和細瘦根狀莖,有頑強的生命力,已有研究表明可生長于河道邊、湖邊,對重金屬、富營養化水體有良好的凈化作用,是修復湖泊、河流的優良植物[1-2]。本研究表明,在生物修復方法即種植李氏禾的同時,輔以物理修復如曝氣或缺氧處理可提高李氏禾對污染水體COD或TP的去除率,對提高污水凈化效果具有重要作用,同時在污染物的去除過程中微生物群落也發揮著至關重要的作用[3]。【本研究的切入點】關于在種植李氏禾+氧氣處理條件下,污水中的微生物發生了怎樣的變化?哪些微生物在污水凈化過程中發揮著重要功能?是否隨著污水處理時間發生動態變化?仍然是未知。在生物修復,聯合物理修復過程中,開展污水中功能微生物群落的研究有助于深入揭示污水凈化的生物學機理,為指導湖泊、河道的修復奠定理論與實踐基礎。【擬解決的關鍵問題】通過高通量基因測序Illumina Miseq技術研究修復污染水體的功能微生物群落,相比傳統技術,可更全面地揭示污水凈化中的功能微生物。此技術克服了傳統分離方法只獲得少量微生物的局限性,超越了DGGE、T-RFLP、克隆文庫方法的通量。應用此技術比較分析靜態污水、污水中設置李氏禾生態浮床、李氏禾生態浮床+曝氣以及李氏禾生態浮床+缺氧處理幾種污水凈化體系中功能微生物群落的差異及其隨時間的動態變化,揭示污水的生物凈化機理,為將來的污水治理實踐提供理論指導。
1 材料與方法
1.1 試驗材料
試驗植物為李氏禾,采自西南林業大學人工模擬濕地,污水由綠化中水加4 mg/L KNO3(氮源)與0.4 mg/L NaH2PO4(磷源)配制而成。共設4組生態浮床靜態污水試驗檢測不同處理對模擬污水的凈化效果,包括處理A,對照,模擬污水樣本,未種植李氏禾;處理B,污水中種植李氏禾;處理C,污水中種植李氏禾+曝氣(O2);處理D,污水中種植李氏禾+缺氧處理。生態浮床構置如下:體積30 L塑料整理箱,加入20 L模擬污水,在2 cm泡沫浮床上種植6株李氏禾、間距12 cm,每組樣品3個重復。曝氣處理用氧氣泵每天上午、下午分別充氧1 h;缺氧處理將李氏禾根部采用保鮮膜包裹。靜態水試驗共進行14 d,分別于1、3、7、14 d取樣,測定水體中總氮TN(Total Nitrogen)、總磷TP(Total Phosphorus)、化學耗氧量COD(Chemical Oxygen Demand)以及水體中微生物群落的變化,檢測不同處理對模擬污水的凈化效果。
1.2 研究方法
污水凈化指標TN、TP、COD的測定依據傳統方法進行[4],水體中的微生物群落通過微孔濾膜過濾污水獲得后,采用環境樣本DNA提取試劑盒(ZYMO Research 公司)進行基因組DNA抽提,使用0.8 %瓊脂糖凝膠電泳檢測基因組DNA的完整性。采用具有Barcode 標記的引物515F與806R對細菌16S rRNA V4區進行擴增。PCR擴增采用TOYOBO KOD-Plus-Neo DNA聚合酶,每個樣本進行3次PCR重復,擴增后將樣本混合并通過凝膠純化試劑盒純化(QIAGEN 公司),用2 %瓊脂糖凝膠電泳檢測純化效果。用Qubit 2.0對純化后的PCR產物進行定量,使用Illumina公司的試劑盒TruSeq DNA PCR-Free Sample Prep kit(FC-121-3001/3002)進行文庫構建,應用高通量Illumina Miseq測序的方法,對不同處理水體中的微生物群落進行分析。
1.3 數據統計分析
微生物的多樣性采用觀測微生物的多樣(OTU 數目)與Chao1、Shannon(香農-維納指數))、Simpson(辛普森多樣性指數)、PD(譜系多樣性指數)分析方法進行評估。微生物的分類在97 %相似水平上,使用UPARSE算法進行OTU的分析。作圖應用R3.2.1軟件完成,不同處理對污染水體中功能微生物群落組成的影響采用主坐標分析(principal coordinate analysis,PCOA)以及聚類分析方法進行分析比較。基于Heatmap分析每個處理中優勢的菌屬,應用Boxpot圖分析不同處理中的優勢菌種。
2 結果與分析
2.1 不同處理對李氏禾凈化污水效果的影響
模擬污水空白對照對COD、TN與TP的去除效率最低,種植李氏禾可明顯提高污水的凈化效果,COD、TN與TP去除率分別提高12.5 %、25.0 %與40.9 %(表1)。種植李氏禾、種植李氏禾+曝氣、種植李氏禾+缺氧3個處理均對污水中TN去除達到理想的效果。種植李氏禾+曝氣處理,對COD的去除率最高,可達到93.6 %;相比之下,種植李氏禾+缺氧處理,對TP的去除效果最好(表1)。李氏禾的生長,需要氮磷等營養物質,因此可提高去除污水中的氮磷。同時,李氏禾在生長過程中,根系分泌物刺激污水中微生物的生長,對污水中的微生物具有篩選和富集作用,微生物群落的變化可影響水中COD的去除。曝氣處理,增加污水中的溶氧,有助于好氧微生物的生長,氧氣的增加也會加速好氧的化學反應進程,因此種植李氏禾+曝氣處理明顯提高COD的去除能力。在缺氧處理中,李氏禾根系包裹保鮮膜,影響根系分泌物與污水中的微生物的接觸,進而影響污水中微生物組成,這種根際微生態環境刺激了一些磷代謝相關微生物的繁殖,從而有利于污水中磷源的去除。由此可知,在污染湖泊或河道水體凈化及修復過程中,可預先對湖泊中水體的污染物進行檢測分析,若COD含量高,可采用種植李氏禾處理聯合應用曝氣裝置系統,加速COD的去除;若水體中磷源含量高,則可在種植李氏禾的同時,適當進行缺氧處理,以增加磷的去除。
2.2 不同處理條件下,李氏禾根際水體中微生物多樣性的變化
不同處理的多樣性分析研究表明,觀測微生物的多樣性(OUT 數目)與Chao1、Shannon(香農-維納指數)、Simpson(辛普森多樣性指數)、PD(譜系多樣性指數)分析的多樣性結果基本一致(圖 1)。污水空白對照(即第1 d的水樣中未種植李氏禾)中微生物的多樣性最高,對模擬污水試驗處理,3 d后水樣中未種植李氏禾(處理A)的微生物多樣性急劇減少,處理時間延長到7或14 d,水樣中的微生物多樣性也沒有明顯增加。相比之下,種植李氏禾+曝氣處理(處理C)在試驗3 d時,李氏禾根際水體的微生物多樣性最高,種植李氏禾(處理B)與種植李氏禾+缺氧(處理C)中微生物的多樣性指標相似。處理時間延長到7或14 d時,單獨種植李氏禾(處理B)的微生物多樣性逐漸提高,可見隨著曝氣時間的增加曝氣并未提高李氏禾根際水體微生物多樣性;李氏禾缺氧處理(處理D)的根際微生物多樣性呈現先降低后升高的趨勢(圖1)。研究表明,污水中的微生物多樣性在處理的不同時間段,呈現動態的變化,可能受污水環境的多種因素影響,如營養鹽、溶氧及植物等。新配制的模擬污水(處理A)中營養及氧氣充足,在短時間內污水中會繁殖大量的微生物,因此在第1天,對照處理的微生物多樣性最高;隨著污水靜態放置時間的延長,水中營養物質及氧氣被微生物消耗降低,微生物之間產生競爭,因此微生物的多樣性到第3天顯著降低,隨著時間的延長多樣性增加不明顯。污水中種植李氏禾(處理B),隨著植物的生長,根系不斷向水中分泌物質,提供了多樣的營養物質類別,進而提高污水中微生物的多樣性,微生物群落呈現出功能冗余現象,一類微生物因環境變化消失時,其功能可由其它微生物取代[4-6],因此種植李氏禾可提高污水中微生物抵御外界環境變化的能力,增加降解污水中污染物的潛力。污水中引種李氏禾聯合曝氣(處理C)時,李氏禾的根系分泌物以及曝氣會緩解污水中營養物質的降低,有利于污水中的微生物生長,到第3天微生物的多樣性最高;隨著時間的延長多樣性也逐漸降低,可能是由于曝氣水中的溶氧選擇富集了特異性好氧微生物群落。雖然種植李氏禾+曝氣處理隨著處理時間的延長,污水中的微生物多樣性降低,但并未影響到TN及COD的去除能力,因此污水中微生物的多樣性與TN和COD的去除無正相關性。
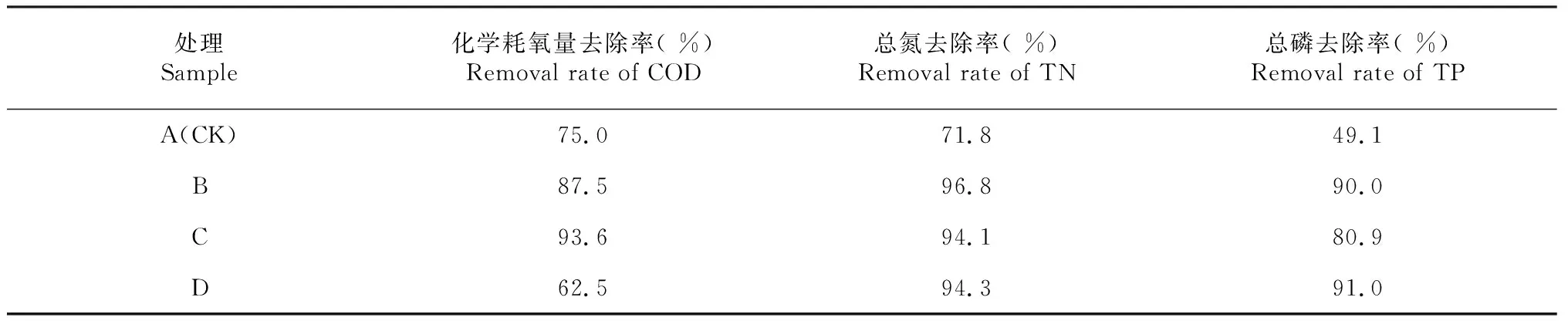
表1 不同處理李氏禾對污水的凈化效果
注:處理時間為14 d。
Notes:The treatment time was 14 days.

圖1 不同處理對李氏禾根際微生物多樣性的作用及其隨時間變化規律Fig.1 The effect of different treatments on the rhizosphere microbial diversity of Leersia hexandra Swartz and the microbial diversity changing with time
2.3 種植李氏禾、曝氣及缺氧處理對水體中微生物群落的作用
比較種植李氏禾,李氏禾+曝氣,李氏禾+缺氧3種處理對污染水體的凈化作用,應用PCOA分析不同條件下水體中功能微生物群落組成的差異,PCOA的第一軸解釋了微生物群落組成變化的20.5 %,第二軸解釋了18 %。進一步分析結果表明模擬污水樣品中第1天的微生物群落組成與其它的樣品分開,說明處理時間、李氏禾種植及曝氣、缺氧處理影響污染水體中微生物群落的分布。水體中的微生物群落隨著處理時間的增加,呈現動態性變化,即3 d與7 d或14 d處理顯著分開(圖2),表明靜態污水的處理時間對微生物群落的影響較大。但是無論在哪個處理時間段,未種植李氏禾與種植李氏禾+缺氧處理的微生物群落組成相似性較高;種植李氏禾與種植李氏禾+曝氣處理的微生物組成更為相似(圖2)。聚類分析圖展示的結果與PCOA分析結果基本一致(圖3)。種植李氏禾+缺氧處理與靜態污水相比,雖然種植了李氏禾,但由于在李氏禾根際進行了包膜處理,一定程度上阻礙了根系與污水中微生物群落的接觸,因此這兩個處理中微生物群落的組成更為相似。相比之下,種植李氏禾與種植李氏禾+曝氣處理,李氏禾的根系分泌物可以與污水中的微生物群落相互作用,且兩種處理中均會增加污水中的溶氧,因此形成了相似的微生物群落組成。
2.4 不同處理條件下,水體中功能微生物群落的種屬組成差異分析
試驗模擬的污染水體中的微生物群落在門的水平上主要屬于變形菌門(Proteobacteria),相對含量約占總微生物組成的50 %;其次是厚壁菌門(Fermicutes)與擬桿菌門(Bacteroidetes),分別約占35 %與10 %;其它的少量微生物屬于放線菌門(Actinobacteria)及梭桿菌門(Fusobacteria)。種植李氏禾、李氏禾+曝氣以及李氏禾+缺氧3種處理雖未顯著改變水體中的優勢微生物門類,但優勢微生物的相對含量發生了明顯的變化,新增了幾種微生物門類,且隨著處理時間的延長,呈現出一定的變化趨勢(圖4)。模擬的污水樣品在靜置3 d后,變形菌門(Proteobacteria)占絕大部分(約90 %),隨著靜置時間的延長放線菌門(Actinobacteria)的相對含量明顯增加。缺氧處理對污染水體中微生物組成的影響與污染水體的靜置處理變化趨勢相似。對比之下,污水中種植李氏禾在3、7、14 d處理中擬桿菌門(Bacteroidetes)的相對含量明顯增加,而厚壁菌門(Fermicutes)相對含量顯著降低(圖4)。種植李氏禾+曝氣處理中擬桿菌門(Bacteroidetes)相對含量增加,厚壁菌門(Fermicutes)含量降低,同時曝氣處理有利于疣微菌門(Verrucomicrobia)的生長繁殖(圖4)。
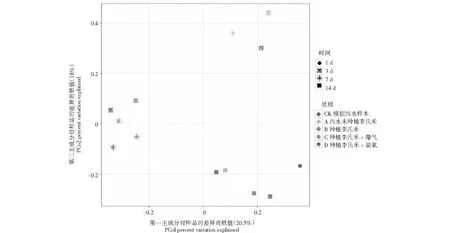
圖2 PCOA 分析揭示不同處理對李氏禾根際微生物群落組成的影響以及微生物群落組成在不同處理時間的分布變化Fig.2 Effect of different treatments on Leersia hexandra Swartz rhizosphere microbial community composition and the dynamic variation of microbial composition with time displayed by PCOA analysis
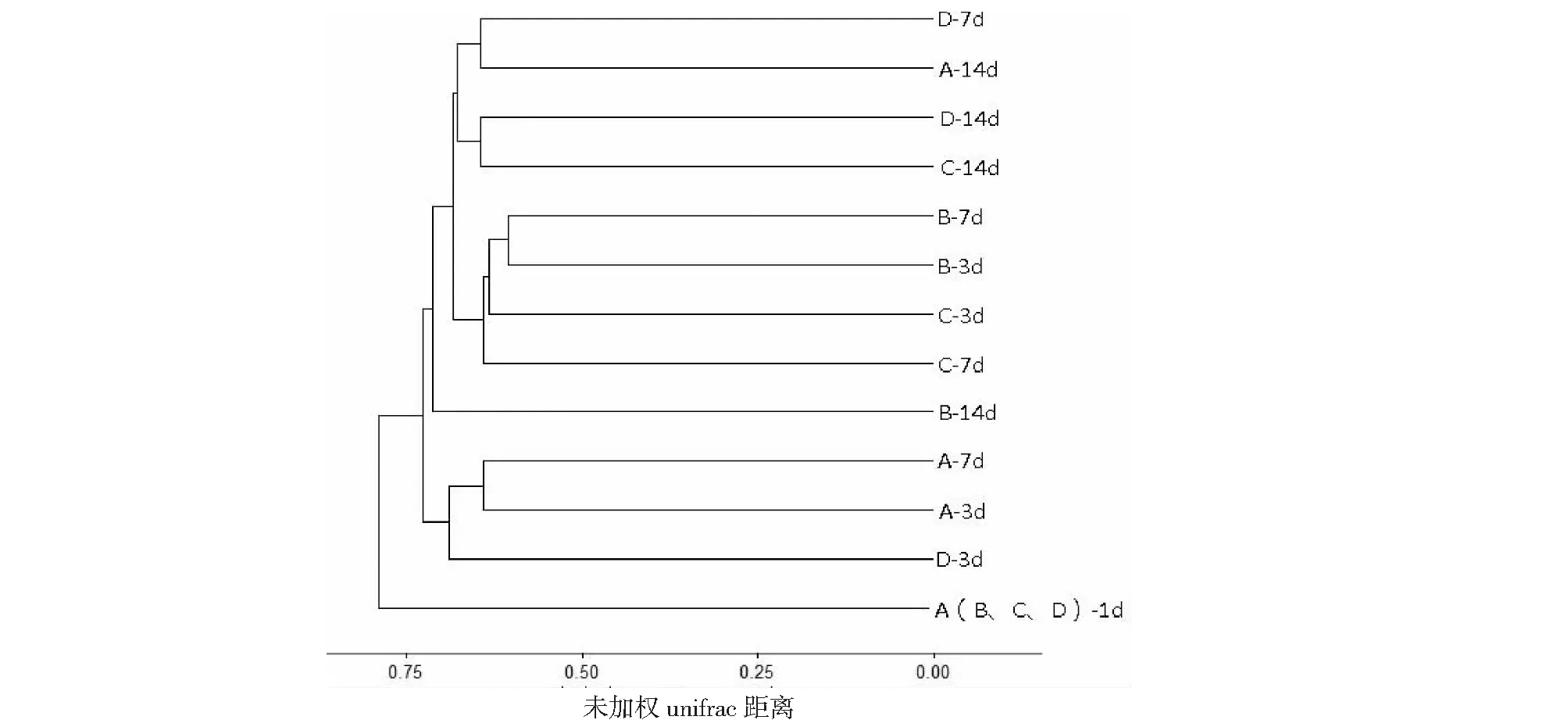
圖右側D-7d表示不同的處理-處理時間,下同The D-7d in the right of figure meant different treatments-different treatment time,the same was below圖3 不同處理條件下李氏禾根際微生物群落聚類分析Fig.3 The cluster analysis of Leersia hexandra Swartz under different treatments
為揭示不同污水處理中發揮作用的功能微生物屬,通過Heatmap圖分析比較了種植李氏禾根際微生物的優勢屬,以及種植+曝氣或缺氧處理條件下,李氏禾根際的功能微生物屬差異(圖5)。幾個處理中的優勢微生物菌屬隨污水處理時間的延長,均呈現出動態變化。在模擬污水樣本中鞘氨醇單胞菌屬(Sphingomonas)、乳酸桿菌屬(Lactobacillus)、顫螺菌屬(Oscillospira)、雙歧桿菌屬(Bifidobacterium)以及屬于草酸桿菌科(Oxalobacteraceae)和根瘤菌目(Rhizobiales)的微生物菌屬占優勢地位。靜置3 d后,污水樣品中優勢菌屬變為假單胞菌屬(Pseudomonas)、嗜甲基菌屬(Methylotenera)、芽單胞菌屬(Blastomonas)與萊茵海默氏菌屬(Rheinheimera)。隨著時間延長到7及14 d時,黃桿菌屬(Flavobacterium)、噬氫菌屬((Hydrogenophaga)與紅桿菌屬(Rhodobacter)成為最主要的微生物菌屬。與污染水體對照相比,種植李氏禾的處理到第3天,黃桿菌屬(Flavobacterium)、噬氫菌屬(Hydrogenophaga)、假單胞菌屬(Pseudomonas)與紅桿菌屬(Rhodobacter)即發展為優勢菌屬,此外海生桿菌屬(Sediminibacterium)、Emticicia以及屬于叢毛單胞菌科(Comamonadaceae)、赤桿菌科(Erythrobacteraceae)、醋酸桿菌科(Acetobacteraceace)與鞘脂桿菌目(Sphingobacteriales)的微生物發展為優勢菌屬(圖5)。種植李氏禾+曝氣處理中優勢微生物菌屬與單獨種植李氏禾處理相似,曝氣處理新增優勢微生物為新鞘氨醇桿菌屬(Novosphingobium)與蒼黃桿菌屬(Luteolibacter)的微生物。種植李氏禾+缺氧處理到3 d時,假單胞菌屬(Pseudomonas)微生物為豐度最高的菌屬;7或14 d時,黃桿菌屬(Flavobacterium)與紅桿菌屬(Rhodobacter)均為優勢菌屬;此外,軍團桿菌科(Legionellaceae)中的菌屬為缺氧處理中特有的優勢微生物。

圖4 不同處理條件下李氏禾根際微生物群落組成差異(門水平)Fig.4 The microbial community composition differences (phylum level) of waterweed (Leersia hexandra Swartz) rhizosphere under different treatments
通過箱式圖分析不同處理條件下,微生物在種水平上的差異及優勢菌種。模擬污水的處理中,運動嗜甲基菌(Methyloteneramobilis)以及噬氫菌屬(Hydrogenophaga)、鞘氨醇單胞菌屬(Sphingomonas)與芽單胞菌屬(Blastomonas)中不可培養的微生物為優勢菌種。種植李氏禾的處理中,不可培養的微生物占優勢,它們分屬于噬氫菌屬(Hydrogenophaga)、乳酸桿菌屬(Lactobacillus)、紅桿菌屬(Rhodobacter)、海生桿菌屬(Sediminibacterium)及赤桿菌科(Erythrobacteraceae);種植李氏禾+曝氣與單獨種植李氏禾處理的優勢微生物菌種相似,叢毛單胞菌科(Comamonadaceae)與噬氫菌屬(Hydrogenophaga)中不可培養微生物占優勢地位。表明其他的未知的菌種在污水處理過程中也發揮著重要的功能。
3 討 論
靜態污水、種植李氏禾、種植李氏禾+曝氣和種植李氏禾+缺氧處理中的微生物群落組成,在處理的不同時間段呈動態變化,這受環境的多種因素影響,如營養鹽、溶氧和植物生長等。但各個處理均未顯著改變水體中的優勢微生物門類,通過高通量分析根際微生物群落組成在門水平上的組成顯示,無論在哪個處理中變形菌門(Proteobacteria)的微生物均占絕對優勢,是污水處理的優勢菌種,這與污水處理廠中微生物群落的研究相似,通過功能基因芯片對污水處理廠中的功能基因及其與凈水關系的研究發現變形菌門(Proteobacteria)的微生物是污水處理廠中最重要的功能微生物[8],還有研究表明屬于鞘脂桿菌門(Sphingobacteria),黃桿菌門(Flavobacteria)和變形菌門(Proteobacteria)的微生物在污水凈化中也起著重要作用[9]。種植李氏禾、種植李氏禾+曝氣處理中,隨著處理時間的延長,擬桿菌門(Bacteroidetes)相對含量增加,有研究顯示在污水處理中檢測到大量的放線菌門(Actinobacteria)、厚壁菌門(Firmicutes)與擬桿菌門(Bacteroidetes)[10-11]的微生物。而幾種處理中的優勢微生物菌屬隨污水處理時間的延長,均呈現出動態變化。與污染水體對照相比,種植李氏禾處理中,赤桿菌科(Erythrobacteraceae)、醋酸桿菌科(Acetobacteraceace)與鞘脂桿菌目(Sphingobacteriales)的菌屬發展為優勢菌屬。研究表明赤桿菌科(Erythrobacteraceae)中的微生物為好氧異養生長,普遍可利用葡萄糖、乙酸鹽、丙酮酸鹽以及谷氨酸鹽為唯一碳源,具有降解烴類、芳香族以及鹵化物等有機污染物的能力,因此可在水體生態系統的碳循環和能量代謝過程中發揮作用[12]。在脫氮的生物反應器以及低濃度氯處理的再生水中,發現海生桿菌屬(Sediminibacterium)為優勢菌屬;而在高濃度氯處理的再生水中鞘脂桿菌目(Sphingobacteriales)的微生物為優勢微生物,表明這兩類菌具有一定的抗氯能力[13-14]。Emticicia在水體及土壤中均有存在,報道顯示此菌屬為嚴格好氧菌,其中個別菌種具有水解淀粉能力[15]。種植李氏禾+曝氣處理中新增優勢微生物為新鞘氨醇桿菌屬(Novosphingobium)與蒼黃桿菌屬(Luteolibacter)的微生物。新鞘氨醇桿菌屬(Novosphingobium)微生物參與有機污染物如多環芳烴、苯酚類、雌激素等的降解[16-18]。據報道蒼黃桿菌屬(Luteolibacter)微生物在護城河底泥中是豐度最高的微生物,此屬的菌種可利用葡萄糖、麥芽糖、甘露糖等碳源生長,具有水解木聚糖能力[19-20]。表明種植李氏禾以及種植李氏禾+曝氣處理有利于一些碳循環相關的微生物的生長繁殖,而且富集了一些具有有機污染物降解能力的微生物類群,因此種植李氏禾+曝氣處理在實踐應用中有望處理COD、有機污染物含量高的污水。種植李氏禾+缺氧處理到3 d時,假單胞菌屬(Pseudomonas)微生物為豐度最高的菌屬;7或14 d時,黃桿菌屬(Flavobacterium)與紅桿菌屬(Rhodobacter)均為優勢菌屬;此外,軍團桿菌科(Legionellaceae)中的菌屬為缺氧處理中特有的優勢微生物。有報道表明假單胞菌屬(Pseudomonas)、黃桿菌屬(Flavobacterium)中的微生物是極為重要的解磷菌,紅桿菌屬(Rhodobacter)中的微生物具有較強的攝磷能力[21-23],由此解釋了在種植李氏禾+缺氧處理總磷去除能力較高的原因。

橫坐標軸上表示不同的處理-處理時間,下同The A-1d of abscissa axis meant different treatments-different treatment time, the same as below圖5 不同處理中李氏禾根際的優勢微生物差異(屬水平)Fig.5 The abundant genus differences with different treatments of Leersia hexandra Swartz rhizosphere(genus level)

圖6 不同處理中李氏禾根際優勢種相對含量的差異(種水平)Fig.6 The predominant species with different treatments of Leersia hexandra Swartz rhizosphere (species level)
4 結 論
高通量分析結果顯示污水中的微生物多樣性與污水的凈化無明顯正相關性,種植李氏禾+缺氧處理的微生物群落組成與靜態污水對照相聚集在一起,相識度較高,而種植李氏禾與種植李氏禾+曝氣處理相似度較高。種植李氏禾+曝氣處理有利于碳循環相關的微生物生長如叢毛單胞菌科(Comamonadaceae)、赤桿菌科(Erythrobacteraceae)、海生桿菌屬(Sediminibacterium)、Emticicia屬、新鞘氨醇桿菌屬(Novosphingobium)與蒼黃桿菌屬(Luteolibacter)的微生物,促進COD的去除。種植李氏禾+缺氧處理富集解磷功能菌屬如假單胞菌屬(Pseudomonas)、黃桿菌屬(Flavobacterium)和紅桿菌屬(Rhodobacter)占絕對優勢,有利于磷源的去除。

