低氧環境下SDF-1對間充質干細胞遷移影響的初探
姜楊 ,李永濤 ,徐桂清 ,郭林娜 ,張彧婷 ,沈雷 ,姚立杰 ,王玉
1.齊齊哈爾醫學院解剖學教研室,黑龍江齊齊哈爾 161006;2.齊齊哈爾醫學院基礎醫學院,黑龍江齊齊哈爾 161006;3.齊齊哈爾醫學院細胞生物學教研室,黑龍江齊齊哈爾 161006
肌腱損傷是常見的運動性損傷,疾病多見于大量運動和年齡老化人群,主要表現為肌腱斷裂、腫脹、運動受限,嚴重影響患者的身體健康。據報導,全球每年大約有3 000萬肌腱損傷患者,由于肌腱組織缺少血液和細胞,再生修復能力較弱,很多患者存在嚴重后遺癥。肌腱治療方法主要是自體肌腱移植、異體肌腱移植、外科手術治療,但存在異體排斥反應、移植后再次斷裂等不良反應。目前利用干細胞組織工程移植到損傷肌腱部位修復技術日益彰顯良好的診療效果,并有報道其可對損傷肌腱愈合有促進作用[1]。間充質干細胞(Mesenchymal Stem Cells,MSCs)是骨髓主要來源的多向能分化細胞,受到誘導可分化為骨組織、軟骨組織、脂肪組織。多向MSCs是較理想肌腱損傷修復的種子細胞。SDF-1又稱基質細胞衍生因子-1,是CXC類趨化因子,與受體CXCR4受體結合激活[2]。研究顯示,損傷部位高表達SDF-1可有效募集循環系統或損傷部位留存的CXCR4激活間充質細胞到達損傷部位,修復受損組織[3]。目前利用組織工程修復損傷肌腱的研究不是很多,如何招募體內MSCs歸巢到組織工程肌腱,促進宿主自身MSCs參與肌腱修復。如何激發宿主自身MSCs參與再生修復、降低免疫排斥反應、加速肌腱修復。該實驗在2017年3月—2018年3月期間利用體外實驗模擬體內低氧微環境觀察一定濃度SDF-1刺激間充質干細胞遷移及細胞活性,為臨床研究提供有力的研究支撐。
1 材料與方法
1.1 主要試劑和儀器
DMEM 培養基(HyClone,美國),胎牛血清(Gibco,美國),青鏈霉素(Gibco,美國),胰蛋白酶,4%多聚甲醛,大鼠 SDF-1(Abcam,美國),MTT 試劑盒(Sigma,美國)。
超凈工作臺,CO2恒溫細胞培養箱,O2/CO2/N2三氣培養箱,倒置相差顯微鏡(Olympus,日本),Transwell(Corning,美國),高速離心機(Eppendorf,德國),震蕩儀(躍進儀器廠),Emax酶標儀為美國 Molecular Devices。公司產品。
1.2 實驗動物
4~6周齡SD大鼠雄性購自齊齊哈爾醫學院動物實驗中心。
1.3 實驗方法
1.3.1 細胞低氧微環境 利用三氣培養箱建立低氧微環境。
1.3.2 間充質干細胞的分離、培養及鑒定 大鼠斷頸處死,無菌處理取大鼠股骨兩端剪開,5 mL DMEM培養基沖洗骨髓腔3~5次,收集細胞懸液1 000 r/s,離心10 min,上清液倒掉,用培養液吹均勻離心管下層組織,在25 cm2培養瓶培養,48 h換液,觀察細胞培養瓶有霧狀細胞集落,去除未貼壁細胞,以后每3 d換液。顯微鏡觀察細胞形態、狀態,細胞長滿80%~90%進行消化、傳代,使用第3代間充質干細胞進行實驗。
1.3.3 實驗分組 低氧環境下培養的間充質干細胞為低氧對照組,在低氧環境下加入120 ng/mL SDF-1為實驗組,正常環境下培養的間充質干細胞為正常對照組。
1.3.4 Transwell實驗 參考文獻方法[4],將第3代MSC用0.25%胰酶消化1~2 min,調整細胞密度1×105cells/mL,Transwell小室的上室加入 200 μL 細胞懸液,24孔板加入120 ng/mL濃度SDF-1的DMEM培養液500 μL,對照組為500 μL DMEM培養液,每組設3個復孔,其分別放入37℃和5%CO2培養箱內和低氧環境37℃培養箱,12~15 h進行培養,上室培養液倒掉,PBS沖洗3遍,將聚碳酸酯膜上細胞擦拭掉,4%多聚甲醛固定,PBS沖洗3遍,20 min蘇木精染色,倒置相差顯微鏡下觀察拍照,每個復孔隨機選取5個視野進行計數統計。
1.3.5 MTT實驗 將第3代間充質干細胞用胰酶消化1~2 min,1×105cells/mL 種于 96 孔板, 每孔 200 μL,每組設3個復孔。DMEM培養液培養過夜,24 h后加入含120 ng/mL SDF-1培養液培養和不含SDF-1培養液培養,37℃、5%CO2培養箱和低氧培養箱內,每孔加入 5%MTT 20 μL,避光孵育 4 h,然后添加 100 μL二甲基亞砜(DMSO),490 m波長測定每個樣品吸光度(OD值)。
1.4 統計方法
實驗數據采用SPSS 18.0統計學軟件分析,計量資料以(±s)表示,行t檢驗,P<0.05 為差異有統計學意義。
2 結果
Transwell細胞遷移實驗:檢測正常對照組、低氧對照組和實驗組間充質干細胞的遷移影響。實驗結果表明細胞遷移率實驗組(43.5±8.4)×103與正常對照組(26.7±5.6)×103比較差異有統計學意義 (P<0.01);低氧對照組(37.5±7.2)×103與正常對照組(26.7±5.6)×103相比較差異有統計學意義(P<0.05)。見圖1。
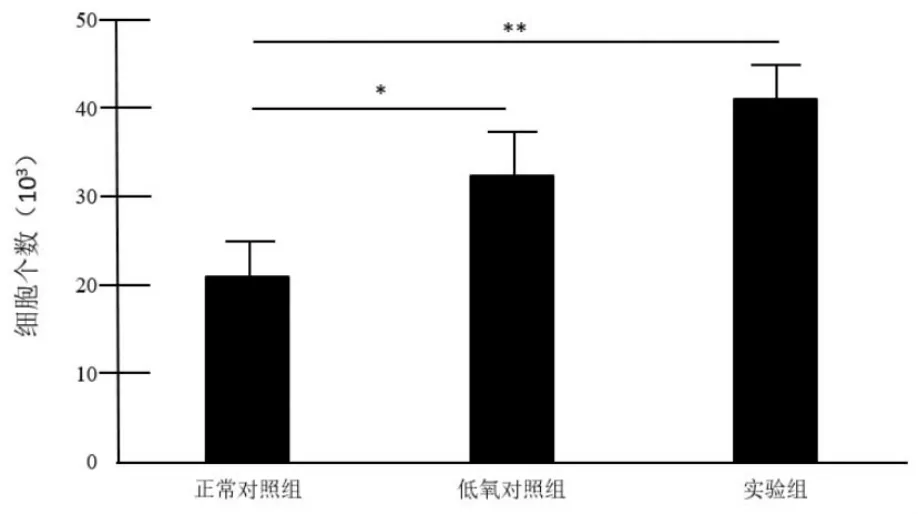
圖1 低氧環境下120 ng/mL SDF-1對MSCs趨化作用
MTT實驗檢測正常對照組、低氧對照組和實驗組間充質干細胞活性的影響。在低氧環境下加入120 ng/mL SDF-1因子對間充質干細胞增殖能力。結果是實驗組加入120 ng/mL SDF-1因子對間充質干細胞增殖數量比較正常對照組和低氧對照組增加,差異有統計學意義。見表1。
表1 低氧環境下120 ng/mL SDF-1對MSCs相對吸光度的影響(±s)
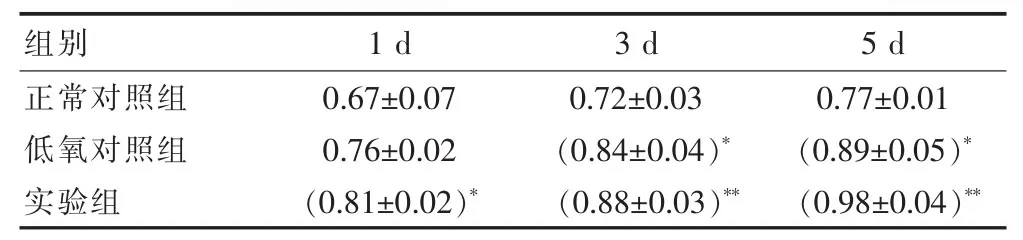
表1 低氧環境下120 ng/mL SDF-1對MSCs相對吸光度的影響(±s)
注:與正常對照組相比較 *P<0.05,**P<0.01。
?
3 討論
肌腱損傷是目前醫學較難解決的問題之一,是運動性損傷治療的瓶頸問題,臨床治療方案主要停留在手術治療,雖有一定治療效果,但只能恢復原肌腱力學的40%,還伴有肌腱斷裂、粘連等一些列并發癥,給患者帶來較大的身體、心理及精神創傷。近年來,組織工程技術的日漸成熟,前景廣闊[5],許多研究者運用干細胞復合支架來修復損傷組織、器官。間充質干細胞取材簡單方便,易于培養,適應生存在微環境,具有免疫源性低,而且分化能力強,是理想的種子細胞。本實驗通過模擬體內肌腱損傷周圍低氧微環境加入趨化因子SDF-1來觀察間充質干細胞遷移能力和活性。目前趨化因子共50多種,有CXC、CC、C和CX3C四大亞家族[6]。SDF-1是應用較多是趨化因子,屬于CXC家族,SDF-1與CXCR4結合,激活受體蛋白,并下一步激活下游蛋白,募集間充質干細胞到損傷部位,參與修復再生。
郝璐等[7]研究發現:在不加入SDF-1因子低氧環境下BMSCs遷移能力增強,加入趨化因子SDF-1后BMSCs遷移能力加強。該實驗通過Transwell實驗結果表明:低氧對照組較正常氧對照組的MSCs遷移效果增強,在加入120 ng/mL濃度SDF-1趨化因子在低氧環境下MSCs趨化現象也明顯增強于低氧對照組,同時在低氧的環境下,隨著培養時間的延長MSCs細胞的趨化能力也高于正常氧的環境。因此,該研究認為SDF-1及低氧環境對MSCs細胞有趨化作用,進而推測在低氧環境下及低氧環境下加入SDF-1因子能夠使MSCs細胞趨化至損傷肌腱部位,從而參與修復損傷肌腱,為進一步實驗開展提供了實驗依據。
以往研究資料表明[8]可以利用MTT實驗檢測在不同濃度下 10、50、100 ng/mL和 200 ng/mLSDF-1因子在低氧環境下細胞的增殖活性。黃曉等[8]報道,在SDF-1濃度小于100 ng/mL時,對BMSCs細胞活力無影響;在SDF-1濃度等于100 ng/mL時,BMSCs細胞活力減弱。該實驗通過MTT實驗檢測發現:在低氧環境下加入120 ng/mL濃度SDF-1組細胞增殖活性相對比正常氧MSCs組,低氧SDF-1組細胞增殖活性明顯增高,表明低氧加入120 ng/mL SDF-1能夠有效地加強MSCs細胞增殖活性;低氧對照組細胞增殖活性與正常對照組相比較也有差別,低氧對照組MSCs細胞增殖活性也明顯強于正常對照組。
綜上所述,上述的實驗研究結果可作為臨床肌腱損傷招募肌腱干細胞歸巢并修復損傷部位奠定了理論支撐。但SDF-1因子招募細胞歸巢機制目前尚不明確,需要進一步實驗驗證,以及間充質干細胞在損傷組織發揮修復作用機理等,尚需要進一步討論研究。

