腎臟增強CT三期掃描用于測量腎功能的可行性和準確性初探
楊征宇,楊光,袁小東
解放軍第309醫院 a. 西山門診部;b. 放射科,北京 100091
引言
99mTc-DTPA腎動態顯像的Gates法是目前測定腎小球濾過率(Glomerular Filtration Rate,GFR)的臨床標準(Gates-GFR)。在Gates法中,靜脈注射放射性藥物99mTc-DTPA一段時間后檢測藥物在腎臟的放射性計數從而計算GFR[1]。CT增強檢查所用碘對比劑,如碘普羅胺或碘海醇的腎臟排泄,與99mTc-DTPA相似,即自由濾過鮑曼氏膠囊,在腎小管沒有分泌或重吸收[2-3]。因此,碘對比劑也是很好的GFR示蹤劑。由于碘對比劑濃度與CT值呈線性關系[4-5],腎臟內碘對比劑的數量可通過腎體積和CT的強化值的乘積(Products of Volume and Enhancement,VE)來估算,該乘積即有可能被用來評估腎小球濾過率[6]。以往基于Patlak圖形分析法的CT腎功能成像原理復雜、測量結果可靠性差并且輻射劑量大,一直未能用于臨床[7-10]。常規增強CT通常包括動脈期、靜脈期和實質期,本研究旨在比較這三期CT圖像在描述腎功能時的準確性。
1 研究方法
1.1 受試對象
該前瞻性研究經我院機構審查委員會批準,并獲得所有患者的書面知情同意書。在2016年9月至2017年2月期間,先前曾接受過超聲檢查或CT平掃的56例候選患者被前瞻性納入本項研究。納入標準為:① 存在腎臟疾病,并申請CT增強評估和99mTc-DTPA動態顯像檢查;② 無碘對比劑應用禁忌。排除標準為:① CT檢查時無法合作(1名受試者);②99mTc-DTPA動態成像未在CT檢查前24 h內未進行(2名受試者);③ 存在明顯的對比劑外滲(1名受試者)。最終52例患者(26個病變腎臟)被納入本項研究進行數據分析 平均年齡 (42.7±10.3)歲,范圍25~74歲,男性33例,女性19例。26個病變腎臟包含:17例腎臟腫瘤(10例腎透明細胞癌,2例乳頭狀腎細胞癌,5例腎血管平滑肌脂肪瘤),6例結石,3例腎結核。
1.2 C T掃描協議
所有患者在CT檢查前30 min被要求排空膀胱并飲用600 mL水。本研究采用320排CT掃描儀(Aquilion ONE,東芝醫療系統公司,日本Otawara)。首先,從左側膈頂到恥骨聯合處獲得腹部的平掃CT。然后,以0.5 mL/s的劑量通過肘靜脈注射0.8 mL/kg的注射劑,接著以相同的速率注射20 mL的鹽溶液(Iopromide,370 mgI/mL,Bayer Schering,德國柏林)。開始注射對比劑后大約10 s,以2 s為間隔進行跟蹤掃描,監測腹主動脈管腔中對比劑的濃度。觸發閾值預設為250 HU,當主動脈管腔內CT值大于或等于250 HU時,進行動脈期圖像采集(屏氣采集)。動脈期采集30 s后采集靜脈期圖像。然后,腎實質期在動脈期采集后100 s進行采集。CT掃描參數如下:0.5 mm×64檢測器,螺距因子=0.828,100 kV,自動管電流調制,0.35 s旋轉時間,FOV=350 mm,3 mm厚度,3 mm間隔用于圖像重建。原始數據進行迭代重建(AIDR3D)以在劑量減少情況下保持較好的圖像質量。記錄每位患者的輻射劑量長度乘積(Dose Length Product,DLP)。
1.3 圖像后處理和C T腎功能評估
將CT三期增強圖像和平掃圖像一并發送至Vital Workstation(Vitrea version 6.0,Vital Images,Minnetonka,MN,USA)。對每一期CT圖像均進行如下處理:使用器官選擇工具自動選擇整個腎臟(包括腎實質,腎內收集系統和腎盂),然后在必要時手動編輯,使用編輯工具在軸向圖像上排除病變(腫瘤,結石和囊腫)、鄰近器官以及腎門血管[5]。每個腎的體積(Volk)和平均CT值(HUnephr)由軟件自動確定。腎臟的基線CT值(HUprecontr)是通過在腎門水平處對腎臟輪廓的手繪感興趣區域(ROI)在軸位CT平掃圖像上測量。計算各期掃描腎臟中碘對比劑的累積量(CMk)為 Volk×(HUcontrast-HUprecontr),來評估腎功能。這個過程由兩位分別有10年和8年經驗的放射科醫師獨立完成。兩名觀察者都不知道對方的處理結果和Gates-GFR的結果。最終結果是兩位觀察者的平均值。
1.4 Gates-GFR測量
所有患者在腎動態顯像前30 min被要求排空膀胱并飲水600 mL。在靜脈推注175 MBq的99mTc-DTPA之前,進行注射器的6 s放射性計數。使用SPECT單元(通用電氣公司GE醫療系統千兆MPR,美國通用電氣公司)用低能量通用平行孔準直器進行腎動態成像,使用20%窗寬,140 keV能量峰值和128×128矩陣。坐位采集腎臟動態圖像。注射后采集注射器的放射性計數。手動繪制雙腎感興趣區,新月形背景區被放置在腎臟的外下側區域。輸入患者的體重和身高數據后使用Gates法計算單腎Gates-GFR[1]。
1.5 統計學分析
本項研究中,統計分析的單位是腎臟。統計分析包括52名患者的52個病變腎臟。首先對Gates-GFR,動脈期、靜脈期、實質期腎臟體積和增強CT值的乘積(A-VE、V-VE和P-VE)進行正態分布檢驗(Shapiro-Wilk檢驗)。分別對Gates-GFR和CT腎功能評估值(A-VE、V-VE和P-VE)做Pearson相關分析,以前者為參考標準來評估后三者的準確性。使用商業統計軟件(SPSS 17.0,Chicago IL)進行統計分析。P<0.05時認為差異有統計學顯著性。
2 結果
52名患者的52個病變腎臟被納入數據分析。這52個病變腎臟的Gates-GFR為(30.06±11.70)mL/min,動脈期、靜脈期、實質期腎臟體積和增強CT值的乘積(A-VE、V-VE、P-VE)分別為:A-VE:(10475.34±5335.65)mL·HU,V-VE:(8862.42±4071.02)mL·HU,P-VE:(10697.87±4410.89)mL·HU。Shapiro-Wilk檢驗結果顯示上述數據均呈正態分布。Gates-GFR和A-VE的相關系數r=0.793,95%CI (0.669, 0.884),P<0.001。Gates-GFR和V-VE的相關系數r=0.848,95%CI (0.722, 0.924),P<0.001。Gates-GFR和P-VE的相關系數r=0.927,95%CI(0.886, 0.959),P<0.001(圖1)。對于52名患者,CT檢查的DLP為(391.2±71.8)mGy·cm。有效輻射劑量為(5.87±1.11)mSv。
3 討論
常用的CT對比劑,如碘普羅胺或碘海醇的腎臟排泄與菊糖類似,即自由濾過鮑曼氏膠囊,在腎小管沒有分泌或重吸收[11-13]。因此,CT對比劑也可用于測量腎功能,即腎小球濾過率。在這種情況下,腎小球濾過率相當于CM的腎清除率。同樣,由于CT衰減值與其濃度之間具有良好的線性關系,CT掃描儀是研究碘對比劑腎臟過濾的可靠工具,并且由于這種線性關系的存在腎臟體積和CT強化值的乘積(VE)可以用來描述CM的濾過量,也就是說VE有可能用來評估腎臟功能[2,6]。然而腎臟CT值的增加不僅來自對比劑的過濾,還來自腎臟的血流灌注,并且不同的采集時相血流灌注和濾過效應對腎臟CT值的增加會有不同的貢獻[2,6],從而影響CT評估腎臟功能的準確性。本研究發現動脈期、靜脈期、實質期腎臟VE和參考標準Gates-GFR之間的相關性不盡相同,P-VE的相關性最好,V-VE次好,A-VE略差,這可以解釋為A-VE受血流灌注的影響最大,V-VE受影響次之,P-VE受血流灌注的影響最小,而其濾過效應最高。
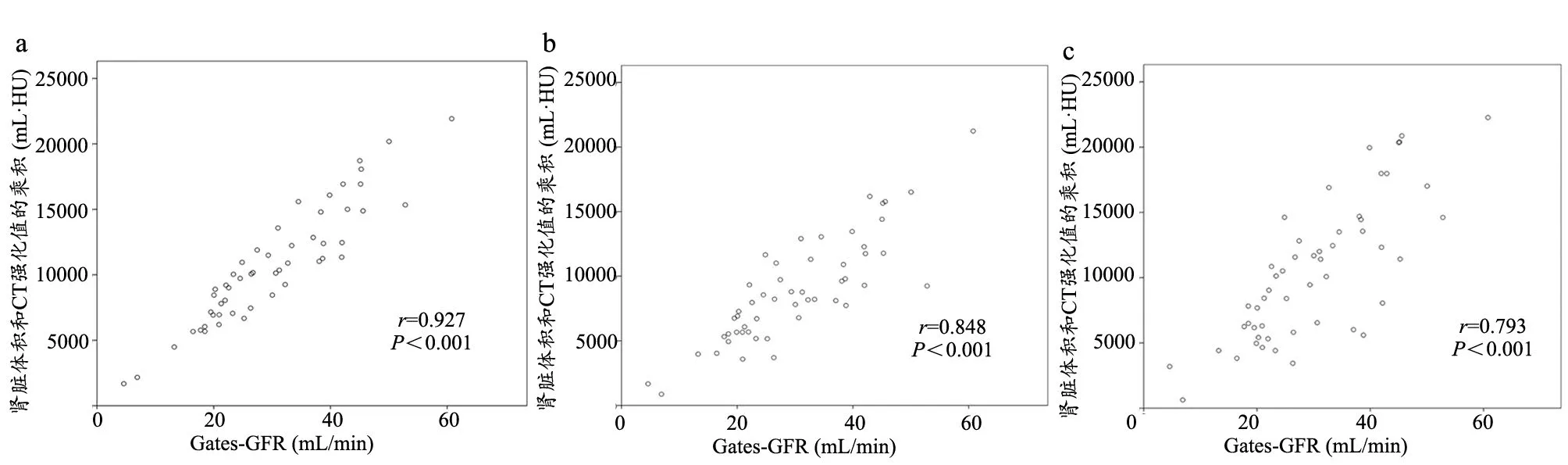
圖1 增強CT腎臟體積和CT強化值的乘積(V-VE)與腎圖Gates-GFR的相關性
以往的研究通常采用Patlak法或其改良法來進行CT腎功能的測量,Patlak法的實現基于如下假設:① 示蹤劑從血管內空間(腎小球)到血管外細胞外空間(鮑曼囊)的轉移過程為不可逆,且轉移速度(Ktrans)相對恒定;②對比劑在數據采集時局限于感興趣區內[14-16]。相對恒定的轉移速度(Ktrans)需要在相對恒定的對比劑濃度梯度下才能實現。因此,主動脈中CM濃度的快速變化會影響Ktrans的穩定性和可靠性。關于后一種假設,通常難以評估示蹤劑是否局限于某個感興趣區。因此Patlak方法在GFR評估中有其局限性。此外,Patlak法通常需要幾分鐘時間對整個腎臟進行動態掃描,導致輻射劑量增加,而且結果經常會受到移動偽影的干擾。
局限性:本研究發現腎臟動脈期、靜脈期和實質期體積和強化值乘積(A-VE、V-VE、P-VE)均與Gates-GFR有相關性,Pearson相關系數r值分別為0.793 (0.669, 0.884),0.848 (0.722, 0.924),0.927 (0.886, 0.959)。P-VE的r值最大,提示腎臟實質期CT圖像用來評估腎功能可能更為準確,但是這三個相關系數的95%的置信區間尚有重疊,因此需要大樣本研究來進一步鞏固我們的結論。
由本文得出,腎臟增強CT三期掃描均可用來評估腎功能,實質期可能更為準確。

