黑曲霉內切葡聚糖酶系的基本酶學特征解析
佟新新,金 鵬,李偉國,劉曉光,路福平,Suren Singh,王正祥
(1. 天津科技大學生物工程學院,天津 300457;2. 天津科技大學化工與材料學院,天津 300457;3. 德班理工大學食品生物工程系,德班 4001,南非)
β-葡聚糖是由右旋葡萄糖通過 β-1,3-(1,4)-糖苷鍵聚合而成的多糖,是植物細胞壁的主要組成成分之一[1],在谷物、海藻和海帶等生物質中含量豐富[2].β-葡聚糖酶是一類能降解β-葡聚糖的水解酶類的總稱.除了作為水解纖維素的重要酶系,β-葡聚糖酶在食品加工、動物飼料、發酵和紡織等工業領域有廣泛應用[2-3].按照其水解 β-葡聚糖的特異性,可將β-葡聚糖酶分為 4類,即特異性的 β-1,3-1,4-葡聚糖酶(地衣多糖酶,EC 3.2.1.73)、非特異性的 β-1,3(4)-葡聚糖酶(EC 3.2.1.6)、β-1,3-葡聚糖酶(昆布多糖酶,EC 3.2.1.39)和 β-1,4-葡聚糖酶(纖維素酶E1,EC 3.2.1.4)[4-5].
目前,微生物是β-葡聚糖酶的主要來源.工業上使用的 β-葡聚糖酶主要來源于曲霉和木霉等絲狀真菌[6-7].盡管研究者們已經對許多不同來源(細菌、酵母和絲狀真菌)的內切葡聚糖酶進行了基因克隆表達和酶學性質研究,但基本上都是單個酶的研究報道.石潤潤[8]采用構建酶庫的方式成功將 22個不同來源的內切葡聚糖酶基因在大腸桿菌(Escherichia coli)中進行了克隆表達,但只對其中3個酶進行了酶學性質研究.迄今為止,還沒有系統研究某一微生物體內全部β-葡聚糖酶生化特征的報道.
已知黑曲霉是自然環境中 β-葡聚糖酶系極為完整與豐富的生物物種,前人從黑曲霉中克隆表達和分離鑒定了多種內切葡聚糖酶,包括 En4gB[9-15]、En4gG[16-19]、EglC[20]、XengA[21]等.隨著黑曲霉基因組的解析完成[22],從基因組水平再認識這一物種的內切葡聚糖酶系成為可能.本課題組前期將黑曲霉來源的 3個 β-1,3(4)-葡聚糖酶(En3gA、En3gB 和En3gC)進行了基因克隆表達和酶學性質的初步解析[23].在此基礎上,本研究進一步通過基因克隆與異源表達,對黑曲霉基因組中全部可能的內切葡聚糖酶進行系統研究與比較分析,解析了其基本組成與酶學特征.由于此菌同時具有蔗糖酶和內切菊粉酶等果糖基水解酶系[24],本研究將為全面認知黑曲霉 β-葡聚糖酶系及其可能的工業應用奠定基礎.
1 材料與方法
1.1 菌株、質粒及培養條件
菌株黑曲霉(A.niger)CICIM F0510是從自然樣本分離保藏的野生菌株,由江南大學中國高校工業微生物資源與信息中心提供[23].大腸桿菌(E.coli)JM109由本實驗室保藏.畢赤酵母(P.pastoris)GS115以及質粒pPIC9k購自Invitrogen公司.
黑曲霉通常采用 PDA培養基進行培養,為了獲得 eglA基因的 mRNA,培養該菌的培養基(g/L):NaNO33,K2HPO41,MgSO4·7H2O 0.5,KCl 0.5,FeSO40.01,酵母膏 5,蛋白胨 10,乳糖 20,菊粉 10,果糖10.大腸桿菌采用LB培養基培養;畢赤酵母及其重組菌的培養基及其培養方法按照 Invitrogen公司的畢赤酵母操作手冊進行.
1.2 主要試劑
PyrobestTMDNA Polymerase、限制性內切酶和T4 DNA連接酶,大連寶生物工程有限公司;小量DNA產物純化回收試劑盒、質粒小量提取試劑盒,Omega Bio-Tek公司;酵母基本氮源培養基(YNB)、G418,Sigma Aldrich公司;RNA抽提試劑盒、cDNA合成試劑盒,Roche公司;氨芐青霉素、3,5-二硝基水楊酸和羧甲基纖維素鈉(CMC-Na,聚合度 800~1200),國藥集團化學試劑有限公司;茯苓多糖(含量為 50%),西安森冉生物工程有限公司;胰蛋白胨和酵母提取物,英國 Oxiod公司;其他生化試劑均為國產分析純.
1.3 黑曲霉內切葡聚糖酶系的基因克隆與表達
1.3.1 畢赤酵母工程菌的構建
黑曲霉總 RNA的提取以及 cDNA的制備按照試劑盒說明書進行.PCR產物、質粒的純化、酶切、連接、電轉化以及轉化子的篩選等參考文獻[24]方法進行.此外,基因克隆過程中所采用的 17對寡核苷酸引物均由上海生工生物工程有限公司合成,其核苷酸序列見表1,下劃線部分為限制性酶切位點.

表1 引物序列Tab. 1 Sequence of primers

續 表
1.3.2 重組酶的誘導表達與制備
采用前期建立的 MMH-CMC平板篩選法[23]篩選陽性轉化子,并通過透明圈大小初步判斷轉化子的酶活力.選取酶活力較大的轉化子接種到 25mL BMGY 培養基中培養至 A600=2~6(約 16~18h).5000r/min離心 5min后,將酵母細胞重懸于50mL BMMY 培養基中使得 A600=1.0,30℃、200r/min搖床培養,每隔24h補加100%甲醇至終體積分數為 0.5%以維持誘導,同時進行取樣測定酶活力.發酵結束后,12000r/min離心 10min收集發酵上清液(即為粗酶液),-20℃保藏備用.
1.4 內切葡聚糖酶的酶活力測定
以1% CMC-Na(溶于0.2mol/L磷酸緩沖液,pH 6.0)為底物,采用黏度法[23]對內切葡聚糖酶的酶活力進行測定.1個單位的內切葡聚糖酶的酶活力定義:在50℃、pH 6.0的條件下,每分鐘從1%的CMC-Na溶液中降解釋放1mg CMC所需的酶量.
1.5 重組內切葡聚糖酶的酶學特征分析
1.5.1 最適作用溫度的測定
取500μL經過適當稀釋的酶液,加入30mL 1%CMC-Na溶液(溶于0.2mol/L磷酸緩沖液,pH 6.0),分別在 30、40、45、50、55、60、70、80℃水浴反應30min后,煮沸 10min滅酶.待樣品冷卻至室溫后,用黏度法進行酶活力測定.以酶活力最高者為100%,并計算所處溫度下的相對酶活力.
1.5.2 最適作用pH的測定
分別將重組酶的酶液用pH為3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0的 Na2HPO4-檸檬酸緩沖液進行適當稀釋后,取 500μL加入到 30mL用相應 pH的Na2HPO4-檸檬酸緩沖液配制的1%CMC-Na溶液中,于每種酶的最適反應溫度下準確反應 30min后,煮沸處理10min進行滅酶.冷卻至室溫后,用黏度法進行酶活力測定,并計算重組酶的相對酶活力.
1.5.3 熱穩定性的測定
分別取 500μL經過適當稀釋的酶液置于 30、40、45、50、55、60、70、80℃的水浴條件下孵育2h.每隔30min取出樣品,在冰上放置10min后,加入30mL 1% CMC-Na溶液.于各種酶的最適反應溫度條件下反應 30min,采用黏度法測定殘余酶活力,以未進行熱處理酶液的酶活力為 100%,計算相對酶活力.
1.5.4 pH穩定性的測定
分別將重組酶的酶液用pH為3.0、4.0、4.5、5.0、5.5、6.0、7.0和8.0的Na2HPO4-檸檬酸緩沖液適當稀釋后,取 500μL加入到 3mL相應 pH的 Na2HPO4-檸檬酸緩沖液中,室溫(25℃)孵育 1h.分別加入12mL 0.2mol/LNa2HPO4-檸檬酸緩沖液(pH 6.0),最后加入 15mL 2% CMC-Na溶液(溶于 0.2mol/L的Na2HPO4-檸檬酸緩沖液,pH 6.0),于各種酶的最適反應溫度下反應 30min,滅酶并冷卻至室溫,然后進行酶活力測定.以酶活力最高者為 100%計算殘余酶活力,確定內切葡聚糖酶的pH穩定性.
1.5.5 重組內切葡聚糖酶的底物水解特征
按照1.4節的酶活力測定方法,研究內切葡聚糖酶對 CMC-Na的水解特征.以 2mL 1%茯苓多糖溶液(溶于 0.2mol/L的 Na2HPO4-檸檬酸緩沖液,pH 5.0)為底物,加入經過適當稀釋的 200μL粗酶液,對照組為200μL畢赤酵母GS115的發酵液.50℃水浴反應 30min后,采用 3,5-二硝基水楊酸法(DNS法)[25]進行酶活力測定,以確定內切葡聚糖酶對茯苓多糖的水解特征.
1.6 黑曲霉內切葡聚糖酶的生物信息學分析
將黑曲霉 CICIM F0510的 17種內切葡聚糖酶進行測序后,獲得新的氨基酸序列.利用 Clustal X2軟件對序列進行多序列比對,并通過軟件 MEGA 4.0以鄰近法(Neighbour-joining)構建進化樹[26].采用在線軟件MUSCLE(http://www.ebi.ac.uk/Tools/msa/muscle/)進行氨基酸序列比對.
2 結果與分析
2.1 基因的克隆、表達與重組酶的制備
依據 A.niger CBS 513.88基因組序列信息(EMBL AM270980—AM270998),采用BLAST等分析方法獲得了確定或疑似內切葡聚糖酶編碼基因信息(共 17個基因).以 A.niger CICIM F0510的cDNA為模板,對上述 17個目標基因進行 PCR擴增.PCR產物經純化、XbaⅠ酶切后,將其克隆入pPIC9K 的 SnaBⅠ和 AvrⅡ位點.經 PstⅠ酶切驗證和 DNA測序,確認重組質粒構建成功.由測序結果可知,所克隆的 17個基因均具有完整的開放閱讀框(表 2).其中,除了 en4gC、en4gD、en4gF、en3gC、eglC和eglD的序列與A.niger CBS 513.88基因組公布序列有較大差異之外,其他基因的序列與公布序列基本一致.此外,除了 en3gB和 englA不含信號肽,其他基因均含有信號肽.
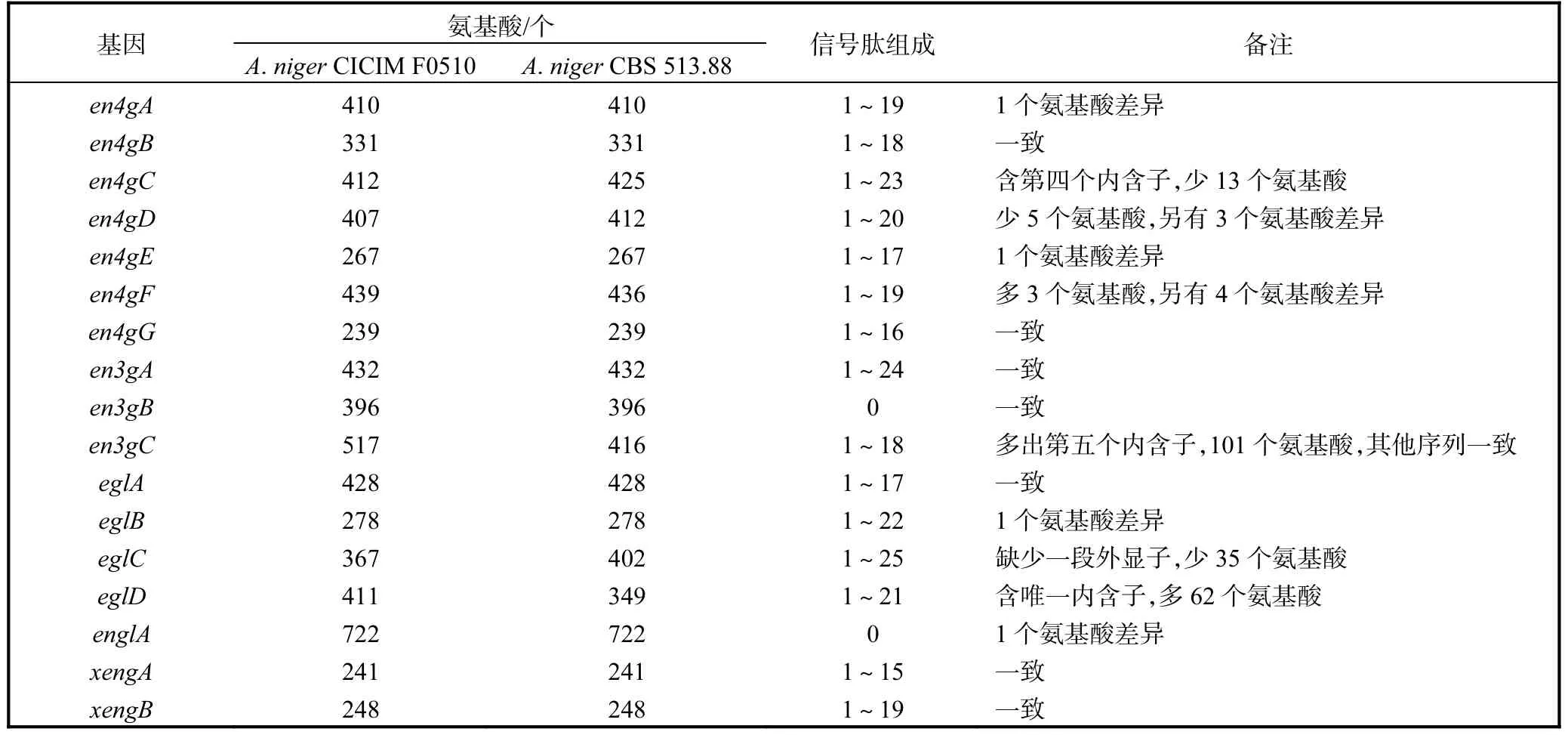
表2 黑曲霉CICIM F0510內切葡聚糖酶的基本特征Tab. 2 Basic properties of endoglucanases from A. niger CICIM F0510
將構建獲得的重組質粒用限制性酶線性化后,電轉化入畢赤酵母中,獲得重組菌.在50mL搖瓶中進行培養時,這17個重組酶的酶活力測定結果見表3.
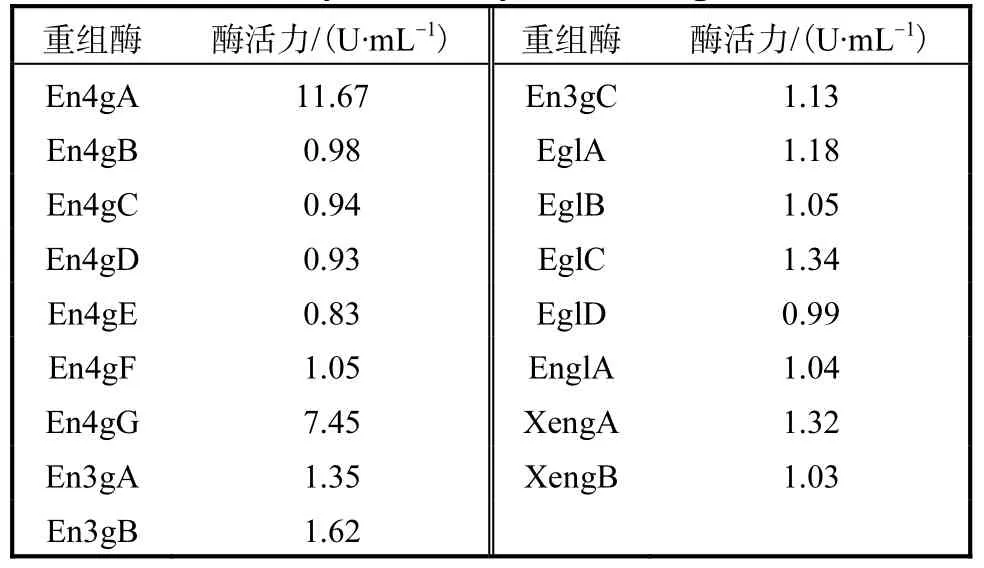
表3 17種內切葡聚糖酶酶活力Tab. 3 Enzyme activity of 17 endoglucanases
其中,En4gA和 En4gG的酶活力遠高于其他重組酶的.以分泌表達的重組酶液為樣本,進行相關酶學性質的研究與分析.
2.2 黑曲霉內切葡聚糖酶的基本酶學性質
2.2.1 最適反應溫度和最適反應pH
對全部17種黑曲霉內切葡聚糖酶進行最適作用pH、最適作用溫度的測定,結果如圖1所示.
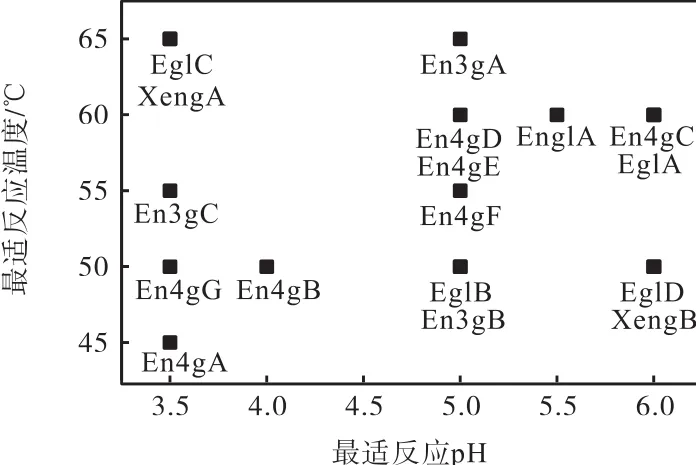
圖1 重組內切葡聚糖酶的最適反應pH和最適反應溫度Fig. 1 pH and temperature optima of recombinant endoglucanases
來源于黑曲霉的17種內切葡聚糖酶具有一定的差異性.除了少數重組酶的最適反應溫度為 45℃(En4gA)和 65℃(EglC、En3gA 和 XengA)外,大部分重組酶的最適反應溫度均為50~60℃.這17種重組酶的最適反應pH都在酸性范圍內(pH 3.5~6.0),而且大部分重組酶的最適作用pH均為3.5或5.0.
溫度和pH對17種重組內切葡聚糖酶酶活力的影響見表4.所有重組酶的酶活力高于80%的溫度范圍和 pH范圍分別為40~75℃、pH 2.0~8.0.其中,在65℃以上和pH 5.0~5.6范圍內具有80%以上酶活力的重組酶有 En4gC、En4gD、En4gE、En4gF、En3gA、EglA和EnglA.
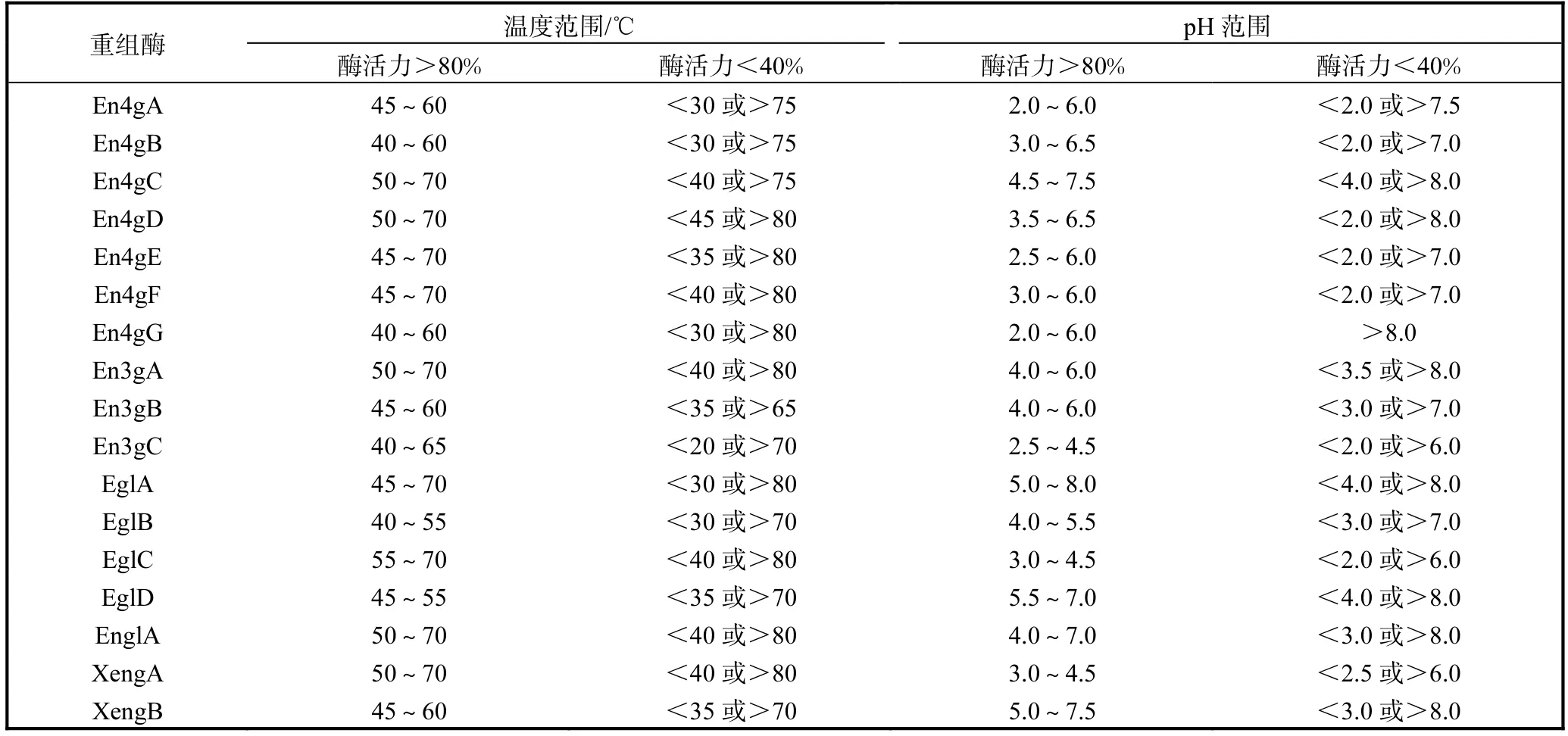
表4 溫度和pH對重組內切葡聚糖酶酶活力的影響Tab. 4 Effects of temperature and pH on the activities of recombinant endoglucanases
2.2.2 熱穩定性和pH穩定性
熱穩定性和 pH穩定性的研究表明,這 17種內切葡聚糖酶的殘留酶活力60%以上的熱穩定性和pH穩定性也存在較大的差異性(表5).

表5 重組內切葡聚糖酶的熱穩定性和pH穩定性Tab. 5 Thermo-stability and pH stability of recombinant endoglucanases
所有的重組酶內切葡聚糖酶在 40~80℃范圍內均具有較好的熱穩定性.其中,En4gG、EglC和XengA的熱穩定性最好,在 80℃孵育 1h后仍能保留 60%以上的酶活力.大部分重組酶均在中性偏酸的pH范圍內具有較好穩定性(25℃孵育1h,殘留酶活力大于 60%),XengB是個例外.而且,除了En3gC和EglC,其他重組酶在65~80℃和pH 5.0~5.5內都具有較好的穩定性.
2.2.3 底物水解特征分析
17種內切葡聚糖酶對不同底物的水解特征見表6.由表6可知:這17種內切葡聚糖酶對CMC-Na都具有水解作用,說明它們均具有水解 β-1,4糖苷鍵的能力.其中,En4gA和 En4gG的水解能力較強.3gA、En3gB、En3gC、En4gA和En4gB對茯苓多糖也有水解作用,表明它們具有水解 β-1,3糖苷鍵的活性,與文獻報道一致[10,23].
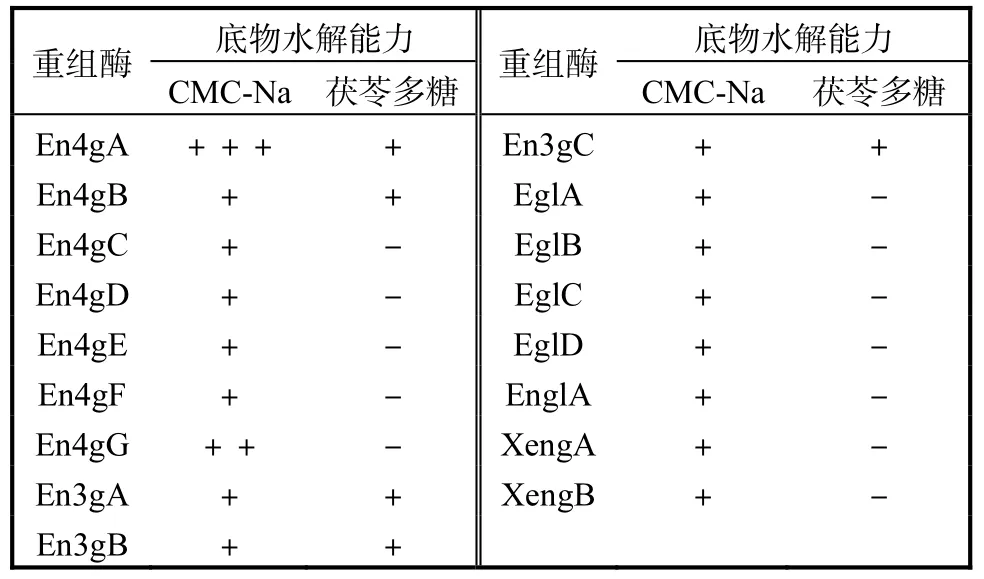
表6 黑曲霉內切葡聚糖酶的底物水解特征Tab. 6 Substrate specificities of endoglucanases from A.niger
2.2.4 內切葡聚糖酶的分類
采用Clustal X2和MEGA 4.0等生物信息學的軟件對這 17種重組酶的親緣關系進行分析,結果如圖2所示.
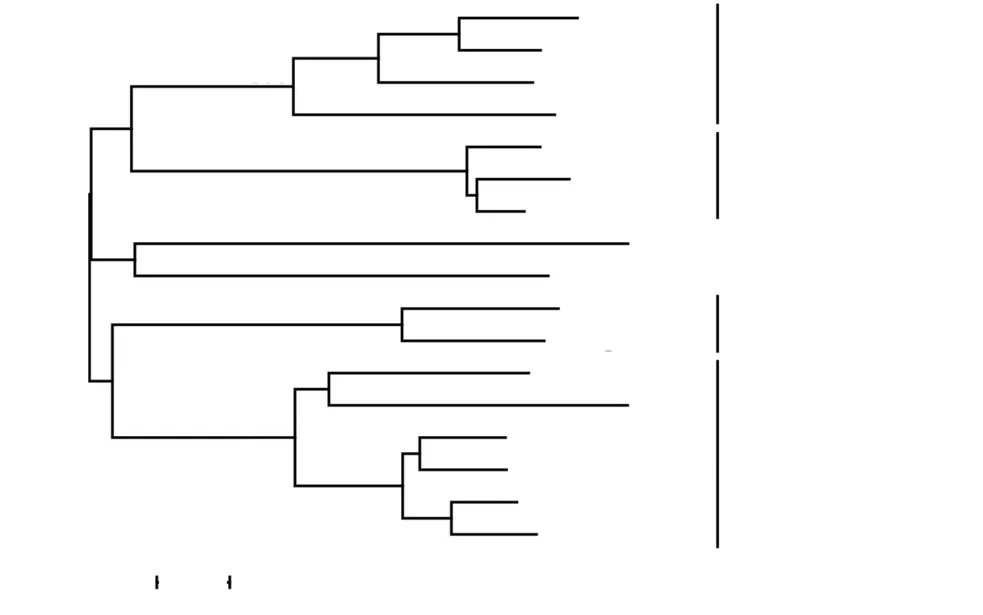
圖2 進化樹描述黑曲霉 CICIM F0510內切葡聚糖酶的遺傳距離Fig. 2 Phylogenetic tree describing the genetic distances among endoglucanases from A.nigerCICIM F0510
有文獻報道且功能已經確認的內切葡聚糖酶用粗體表示;線段的長度表示的是MEGA 4.0計算的距離;分支節點上的數字代表的是bootstrap百分比.結合底物水解特征、進化樹以及碳水化合物活性酶(CAZy)分類系統(http://www.cazy.org/),可以將這17種內切葡聚糖酶分為 4類:(1)XengA、XengB、En4gG和 En4gE是木葡聚糖特異性(xyloglucan-specific)的內切 β-1,4-葡聚糖酶(EC 3.2.1.151)[18-19,21],它們屬于糖苷水解酶第5家族(GH5),而Rawat等[19]和Master等[21]認為XengA和En4gG屬于糖苷水解酶12家族(GH12).(2)En3gA、En3gB、En3gC[23]、En4gA 和En4gB[10]是內切 β-1,3(4)-葡聚糖酶(EC 3.2.1.6),可以水解葡聚糖中的 β-1,3和 β-1,4糖苷鍵,屬于糖苷水解酶16家族(GH16).但這5種重組酶分別屬于2個不同的亞類(圖 2),它們之間的區別還有待進一步研究.(3)EglA、EglB、EglC、EglD 和 En4gF 只具有水解 β-1,4糖苷鍵的能力,是內切 β-1,4葡聚糖酶(EC 3.2.1.4),屬于糖苷水解酶第 5家族(GH5).(4)En4gC和 EnglA屬于一類,其中 En4gC是內切 β-1,4葡聚糖酶[27],但它們的具體功能還有待進一步的研究確認.
3 討 論
本研究成功將黑曲霉CICIM F0510來源的全部17種內切 β-葡聚糖酶基因在畢赤酵母 GS115中進行了克隆表達,獲得的17種重組酶均對CMC-Na具有水解作用.測序的結果表明,它們的核苷酸和氨基酸序列與菌株 CBS 513.88來源的相應序列的相似度,從完全一致到有較大差異不等(表 2).其中,基因 en4gC、en3gC、eglC和 eglD 的氨基酸序列與NCBI上公布的序列差異很大,這可能是由于來源菌株不同造成的.由氨基酸序列比對可知,這 17種內切葡聚糖酶之間的氨基酸序列差異性較大,序列相似度為7.49%~62.5%.其中,en4gC和en4gG的氨基酸序列相似度為7.49%,而en4gA和en4gB的氨基酸序列相似度為 62.5%.根據底物水解特征、進化樹以及CAZy分類系統,重新將這17種內切葡聚糖酶分為4類(圖 2):(1)木葡聚糖特異性的內切 β-1,4-葡聚糖酶(GH5,EC 3.2.1.151);(2)非特異性的內切 β-1,3(4)-葡聚糖酶(GH16,EC 3.2.1.6);(3)內切 β-1,4-葡聚糖酶(GH5,EC 3.2.1.4);(4)En4gC和EnglA,它們的具體功能還有待進一步確認.
內切葡聚糖酶是一種重要的工業酶制劑,在啤酒釀造和飼料等工業應用廣泛.在啤酒釀造過程中,麥芽糖化的溫度和 pH 分別為 65~70℃、pH 5.0~5.6[4].因此,啤酒釀造行業所用的內切葡聚糖酶需同時具有良好的耐熱性和耐酸性.本研究中的 En4gC、En4gD、En4gE、En4gF、En3gA、EglA 和 EnglA 的最適反應溫度、熱穩定性、最適反應 pH和 pH穩定性分別在此溫度和 pH范圍內,可用于啤酒釀造工程.在飼料微丸包衣過程中,也需要較高的溫度(65~90℃,90s),而且飼料的消化是在畜禽胃腸酸性環境中(pH 2.6~6.5)進行的[28].除了上述 7種重組酶,En3gC、EglC和 XengA 也適用于飼料顆粒化過程.本研究獲得的EglA、EglB、EglC、EglD、En4gD和En4gF等內切β-1,4-葡聚糖酶在纖維素乙醇的生產工藝中(50℃、pH 4.8)[29]具有潛在的應用價值.4種木葡聚糖特異性的內切 β-1,4-葡聚糖酶(En4gE、En4gG、XengA 和 XengB)不僅可以對植物纖維進行改性[30],還可以將經過化學修飾的低聚木糖與木葡聚糖進行連接,從而賦予纖維素微纖絲(cellulose microfibrils)新的功能[31].此外,該酶在食品、紡織和醫藥行業也有廣泛應用[32].
綜上所述,本研究將黑曲霉來源的 17種內切葡聚糖酶在畢赤酵母中進行了克隆表達,并系統解析了它們生化特征的異同點,為同一來源的同類酶(同工酶)超家族的相關研究以及相關酶在實際應用中協同作用的研究提供了研究基礎.同時,良好的生化特征使得這些內切葡聚糖酶在麥芽糖化、飼料顆粒化、纖維素乙醇、食品、紡織以及醫藥等行業有著潛在的應用價值.

