針刺對變應性鼻炎模型大鼠血清IL-4、IL-12、GATA-3 mRNA水平的影響
郭清華 王 旭 劉 玉
(南京市中西醫結合醫院,江蘇南京210014)
變應性鼻炎(Allergic Rhinitis,AR)是機體暴露于變應原后由IgE介導的鼻黏膜非感染性慢性炎性疾病,典型癥狀為陣發性噴嚏、清水樣涕、鼻癢和鼻塞[1]。目前,變應性鼻炎流行率有全球逐年增加的趨勢。2015年,美國變應性鼻炎臨床指南首次將針刺療法作為可選擇的方案之一進行推薦[2]。針刺治療變應性鼻炎不但能取得較好的療效,而且有副作用小、復發率低、成本較低等優點。孫氏等[3]通過分析近10年的臨床報道發現針刺治療過敏性鼻炎療效可靠,操作簡單,同時也提出應加強針刺治療過敏性鼻炎的實驗和作用機理研究,尤其是從免疫學角度。本研究制作變應性鼻炎大鼠模型,觀察針刺療法對AR模型大鼠的療效及其對大鼠血清白介素-4(IL-4)、IL-12、GATA-3 mRNA水平的影響。
1 實驗材料
1.1 實驗動物 健康wistar大鼠,雌雄各半,清潔級,體重(200±20)g,由揚州大學比較醫學中心提供,動物合格證號:SCXK2012-004,適應性喂養1周。
1.2 主要試劑與藥物 IL-12試劑盒、IL-4試劑盒,上海酶聯生物科技有限公司;氫氧化鋁干粉,上海凌峰化學試劑有限公司;卵白蛋白,sigma公司;氯雷他定糖漿,MSD Belgium BVBA/SPRL(比利時);一次性針灸針,環球牌,0.18mm×13mm;氯仿(三氯甲烷)、異丙醇、無水乙醇,分析純,南京化學試劑股份有限公司;焦碳酸二乙酯(DEPC),Sigma公司;Trizol、M-MLV反轉錄酶等逆轉錄試劑、DNA marker、Taq DNA聚合酶反應體系,TaKaRa公司;引物:生工生物工程(上海)股份有限公司合成。內參引物序列見表1。
1.3 主要儀器 全自動熒光PCR分析儀,美國Branchburg公司;臺式高速離心機,上海安亭科學儀器廠;核酸蛋白檢測儀,Thermo公司。
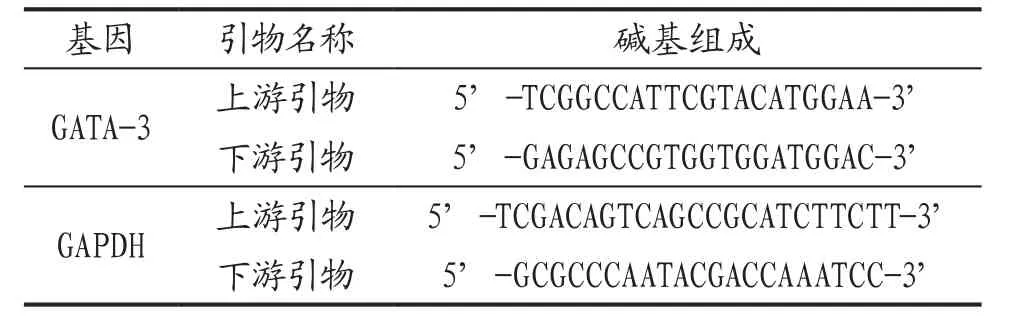
表1 內參引物序列
2 實驗方法
2.1 造模與分組 將wistar大鼠適應性喂養1周后,按照安云芳等[4]報道的方法造模。(1)基礎致敏:每只大鼠予用卵清蛋白(OVA)0.3mg+氫氧化鋁30mg+生理鹽水1mL制成的混懸液,腹腔注射,隔日1次,共7次。(2)激發階段:腹腔注射OVA結束后第2天即開始激發,每只大鼠予5%OVA 50μL滴鼻,每日1次,連續7d。另取10只大鼠為空白組,用生理鹽水代替OVA,其余方法不變。采用疊加量化記分法評價造模是否成功,總分>5分表示造模成功。記分方法:(1)鼻癢。輕搔鼻1~2次為1分,劇烈搔抓鼻四周2分。(2)噴嚏。1~3個為1分,4~10個2分,11個以上3分。(3)清涕。流至鼻孔為1分,超出前鼻孔2分,涕流滿面3分。將造模成功的大鼠隨機分為模型組、針刺組、西藥組。
2.2 干預方法 從實驗第21天開始,用針刺和氯雷他定糖漿對實驗鼠進行干預。
2.2.1 針刺組 選擇大椎、肺俞(雙)、腎俞(雙)。穴位定位參考《常用實驗動物穴位定位》。大椎位于第7頸椎與第1胸椎間,背部正中;肺俞位于第3胸椎下兩旁肋間;腎俞位于第2腰椎下兩旁肋間。安撫大鼠后,左手按壓大鼠,食指和中指置于穴位兩側,繃緊穴位處皮膚,右手持針,快速垂直進針,針身進入后約10min捻轉1次,采用提插捻轉平補平瀉針法,行針1min,共留針30min,每日1次,連用14d。
2.2.2 西藥組 根據人與動物等效劑量換算方法,按人與各種動物以及各種動物之間用藥劑量換算公式:B種動物的劑量(mg/kg)=W×A種動物的劑量(mg/kg),W為折算系數(大鼠折算系數為0.018),計算大鼠氯雷他定糖漿用藥量,予每次0.9mg/kg灌胃方式給藥,每日灌胃1次,連用14d。
2.2.3 模型組和空白組 模型組予生理鹽水灌胃,2mL/d,每日1次,連用14d。空白組不予任何干預。
2.3 標本采集 (1)血清采集:各組大鼠末次處理后,以10%水合氯酸,3mL/kg進行麻醉,采用摘眼球采血方式,將所采血液緩慢置入采血管,搖勻,離心,取血清。分取血清至凍存管中,-80℃冰箱保存備用,測定前置室溫復融。(2)鼻黏膜采集:大鼠采血完畢后,行斷頭處死,迅速剝除上頜骨部皮膚,將上頜骨從項骨中分離出來,分離鼻中隔與鼻黏膜,取雙側鼻黏膜。部分鼻黏膜在10%甲醛溶液中固定,用于鼻黏膜觀察;其余黏膜用液氮速凍后放置于-80℃冰箱保存,用于qPCR檢測。
2.4 指標檢測
2.4.1 癥狀比較 根據癥狀評分法用疊加量化記分法記分比較各組大鼠用藥前后癥狀積分。
2.4.2 鼻黏膜觀察 將10%甲醛溶液中固定的大鼠鼻黏膜,經組織脫水、石臘包埋、切片、脫臘、蘇木精-伊紅染色、脫水、透明、封固等操作后,在顯微鏡下觀測實驗大鼠鼻黏膜組織學改變及嗜酸性粒細胞計數。
2.4.3 血清IL-4、IL-12水平檢測 根據酶標儀檢測得到大鼠血清的吸光值,利用標準曲線的方程式計算得出待檢樣品中IL-4、IL-12的濃度(pg/mL)。根據試劑盒說明書,各試劑在使用前平衡至室溫。對比各組大鼠血清IL-4、IL-12水平。
2.4.4 大鼠鼻黏膜GATA-3 mRNA檢測 將-80℃冰箱中保存的大鼠鼻黏膜采用TRIzol試劑提取總RNA,確定總RNA濃度及純度后進行逆轉錄合成cDNA,進行實時熒光定量分析。以每個標準拷貝數的對數為橫坐標,以熒光信號達到設定閉值時所經過的循環數值(Ct值)為縱坐標,繪制標準曲線,得出GATA-3 mRNA的擴增曲線良好,融解曲線峰形單一。以精密度和回收率考證方法根據被檢測樣品的Ct值,通過標準曲線計算出樣本的模板拷貝數。同時,引入內參基因GAPDH以減少樣品間差異,并記錄兩者Ct值。
2.5 統計學方法 在SPSS 21.0建庫并進行統計學分析,數據以(±s)表示,符合正態分布且方差齊的組間資料采用方差分析,非正態分布或方差不齊的采用多個樣本非參數檢驗,當P<0.05時為差異有統計學意義。
3 實驗結果
3.1 各組大鼠干預后變應性鼻炎癥狀評分比較 干預后各組大鼠變應性鼻炎癥狀評分分別為:空白組(2.4±1.35)分,模型組(6.7±1.57)分,針刺組(3.0±0.82)分,西藥組(2.9±0.99)分。模型組大鼠評分明顯高于空白組(P<0.01);針刺組和西藥組評分明顯低于模型組(P<0.05);針刺組與西藥組比較,差異無統計學意義(P=0.855)。
3.2 各組大鼠鼻黏膜組織學比較 空白組大鼠鼻黏膜組織幾乎無嗜酸性粒細胞浸潤;模型組鼻黏膜組織水腫,血管擴張,大量嗜酸性粒細胞浸潤,表明嗜酸性粒細胞在變應性鼻炎致敏中起重要作用;針刺組和西藥組鼻黏膜少量嗜酸性粒細胞聚集,無明顯充血水腫、血管擴張的改變。見圖1。
3.3 各組大鼠血清IL-4、IL-12及鼻黏膜GATA-3 mRNA水平比較 結果見表2。針刺組與西藥組各指標比較,差異均無統計學意義(P>0.05)。大鼠鼻黏膜GATA-3 mRNA的表達,通過計算△Ct=Ct(目的基因)-Ct(內參基因),以△Ct進行組間差異性比較。△△Ct=△Ct(治療組)-△Ct(模型組),計算出GATA-3 mRNA的 相 對 表 達 量2-△△ct,2-△△ct的大小表示各組原始數值的關系,值越大表達量越高,值越小表達量越小。
4 討論
變應性鼻炎屬中醫學“鼻鼽”范疇,其發病機制主要是由于肺、腎虛損,水濕犯鼻而致病。現代醫學認為,變應性鼻炎是環境因素作用于機體導致異常免疫反應,大量研究表明Th1和Th2細胞間免疫反應失衡是導致變應性鼻炎發生的免疫學基礎之一[5],輔助性T淋巴細胞亞群可以分為Th1和Th2兩種類型,它們通過所分泌的細胞因子相互調節,以維持機體免疫功能的平衡。正常情況下,Th按一定比例向Th1、Th2分化,兩者處于相對平衡狀態,維持著機體正常的細胞免疫和體液免疫功能。當機體受到異常抗原刺激時,上述平衡被打破,Th1、Th2細胞中Th2亞群表達升高,而Th1亞群表達降低。其中,Th2細胞起重要的作用,因為它能夠釋放關鍵的細胞因子,例如IL-4、IL-5、IL-6、IL-10及IL-13,特別是IL-4能夠促進IgE的產生,IL-5能引起嗜酸性粒細胞的匯聚和活化,由此產生了“變態反應中的Th2假說”。這個假說已得到實驗研究和基礎研究的支持[6]。現已知道,變應性鼻炎Th1類細胞顯著降低,而Th2類細胞顯著升高,即發生明顯的Th細胞向Th2偏移,多條信號通路參與了Th2偏移的發生,而GATA-3是Th2偏移的核心信號分子[7]。
本研究結果表明,變應性鼻炎模型大鼠血清存在IL-4水平升高、GATA-3 mRNA的高表達及IL-12水平的降低。針刺能改善大鼠鼻部過敏的癥狀,以及鼻黏膜過敏狀態;能顯著升高變應性鼻炎大鼠血清IL-12含量,同時降低其血清IL-4含量,降低大鼠鼻黏膜GATA-3 mRNA的表達。GATA-3是Th類細胞因子的上游基因,因此,降低大鼠鼻黏膜GATA-3 mRNA的表達,調節變應性鼻炎大鼠血清中IL-4和IL-12水平,可能是針刺治療變應性鼻炎的機制之一。
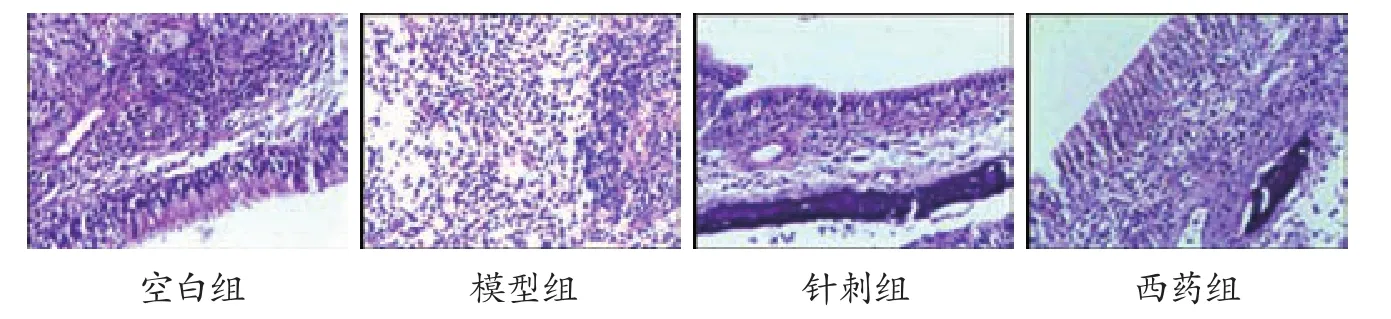
圖1 各組大鼠鼻黏膜組織形態比較(20×10)
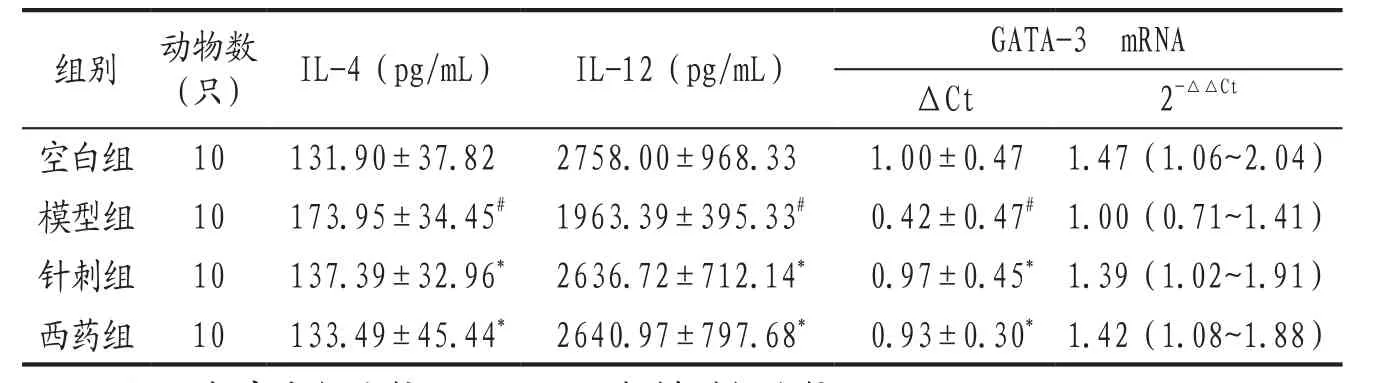
表2 各組大鼠血清IL-4、IL-12及鼻黏膜GATA-3 mRNA表達比較
本研究為中醫藥治療變應性鼻炎提供科學依據,然針刺組與西藥組比較無明顯統計學差異,可能是本實驗樣本量不足,且本實驗模型大鼠需要短時期內處理,因此無法觀察長期療效,組間長期療效是否存在差異有待于進一步研究。

