腫瘤壞死因子-α誘導(dǎo)脂肪細(xì)胞胰島素抵抗模型的建立及評(píng)價(jià)指標(biāo)*
劉 璐 ,曹世杰 ,程麗娜 ,邱 峰 ,3,康 寧
(1.天津中醫(yī)藥大學(xué)中西醫(yī)結(jié)合學(xué)院生物化學(xué)教研室,天津 300193;2.天津市現(xiàn)代中藥重點(diǎn)實(shí)驗(yàn)室,天津 300193;3.天津中醫(yī)藥大學(xué)中藥學(xué)院中藥化學(xué)教研室,天津 300193)
肥胖和2型糖尿病均與胰島素抵抗關(guān)系密切[1]。在糖尿病的發(fā)展中,脂肪組織發(fā)揮著重要的調(diào)節(jié)作用,炎癥因子與脂肪組織內(nèi)分泌、免疫系統(tǒng)相互作用,引起胰島素抵抗,最終導(dǎo)致2型糖尿病發(fā)生[2]。研究表明,促炎細(xì)胞因子腫瘤壞死因子-α(TNF-α)可導(dǎo)致脂肪組織或系統(tǒng)性炎癥的產(chǎn)生,最終可能引起胰島素抵抗[3-4],可用于建立體外胰島素抵抗模型。然而,縱觀已發(fā)表的有關(guān)TNF-α誘導(dǎo)的胰島素抵抗造模文獻(xiàn)[5-8],有關(guān)TNF-α劑量及作用時(shí)間對(duì)造模結(jié)果的影響以及模型建成的評(píng)價(jià)指標(biāo)尚不完全清楚。
據(jù)報(bào)道,在胰島素刺激下,脂肪細(xì)胞中的葡萄糖轉(zhuǎn)運(yùn)體4(GLUT4)會(huì)從細(xì)胞內(nèi)轉(zhuǎn)位至細(xì)胞膜上,而在2型糖尿病中這種轉(zhuǎn)位功能會(huì)減弱[9],因此,本研究采用TNF-α體外誘導(dǎo)法建立3T3-L1脂肪細(xì)胞胰島素抵抗模型,考察TNF-α造模用藥劑量及作用時(shí)間,并以GLUT4蛋白表達(dá)結(jié)合膜轉(zhuǎn)位的變化作為胰島素抵抗模型是否建立的指標(biāo)。
1 材料
1.1 細(xì)胞 小鼠前脂肪細(xì)胞3T3-L1購于北京醫(yī)學(xué)科學(xué)院基礎(chǔ)醫(yī)學(xué)研究所。
1.2 試劑 DMEM培養(yǎng)基(Gibco);胰蛋白酶(BIOSHARP);胎牛血清(TBD);胰島素(丹麥諾和諾德公司);地塞米松(Sigma);1-甲基-3-異丁基-黃嘌呤(Sigma);羅格列酮(Sigma);TNF-α(Pepro Tech);葡萄糖檢測(cè)試劑盒(北京普利萊公司);BCA試劑盒(Solarbio);抗體:GLUT4(SAB),辣根過氧化酶標(biāo)記的二抗(中杉金橋公司)。
1.3 儀器 二氧化碳培養(yǎng)箱(上海力申有限公司);酶聯(lián)免疫分析儀(美國(guó)BioTek);倒置顯微鏡(Nikon);Operetta高內(nèi)涵篩選系統(tǒng)(Perkin Elmer)。
2 方法
2.1 3T3-L1前脂肪細(xì)胞的培養(yǎng)和誘導(dǎo)分化 當(dāng)3T3-L1前脂肪細(xì)胞貼壁生長(zhǎng)至鋪滿培養(yǎng)瓶瓶底時(shí),使細(xì)胞接觸抑制48 h,然后進(jìn)行誘導(dǎo)分化,將細(xì)胞培養(yǎng)液換成含有0.5 mmol/L的3-異丁基-1-甲基黃嘌呤、1μmol/L的地塞米松、10μg/mL的胰島素、3μmol/L的羅格列酮和10%胎牛血清的DMEM高糖培養(yǎng)基。孵育48h后將培養(yǎng)液換成含有10μg/mL的Insulin、3μmol/L的羅格列酮和10%胎牛血清的DMEM高糖培養(yǎng)基再孵育48 h后換液,換成含有10%胎牛血清的DMEM高糖培養(yǎng)基,每48 h換液1次,直至80%以上的細(xì)胞分化成熟。
2.2 油紅O染色法鑒定脂肪細(xì)胞 將誘導(dǎo)分化成熟的脂肪細(xì)胞用磷酸緩沖鹽溶液(PBS)洗3次,然后用10%的甲醛溶液室溫固定1 h,移去固定液后用PBS洗3次,晾干細(xì)胞。加入3 mg/mL用異丙醇溶解的油紅O染液,室溫染色10 min,然后用水洗至少3次,每次5 mL,洗去殘?jiān)图?xì)胞縫隙中的染料,在倒置顯微鏡下觀察并拍照。
2.3 TNF-α誘導(dǎo)脂肪細(xì)胞胰島素抵抗 取誘導(dǎo)分化成熟的3T3-L1脂肪細(xì)胞接種于96孔培養(yǎng)板中,設(shè)立4個(gè)組,分別是:空白對(duì)照組、空白對(duì)照加胰島素組、模型組和模型加胰島素組。細(xì)胞貼壁后,將培養(yǎng)液換為含有0.5%牛血清白蛋白的無血清DMEM高糖培養(yǎng)基,于5%CO2培養(yǎng)箱37℃孵育8 h,然后將空白對(duì)照組的培養(yǎng)液換為含有10%胎牛血清的DMEM高糖培養(yǎng)基,模型組換為加入5、10、15、20、25 ng/mL TNF-α并含有10%胎牛血清的DMEM高糖培養(yǎng)基,分別作用48、72、96 h,期間空白對(duì)照組和模型組的培養(yǎng)基每24 h更換1次。最后,棄去原有培養(yǎng)基,用PBS洗1次,將空白對(duì)照組和模型組換為無血清低糖DMEM培養(yǎng)基,空白對(duì)照加胰島素組和模型加胰島素組換為加入含有100 nmol/L胰島素的無血清低糖DMEM培養(yǎng)基,30 min后吸取上清液,用葡萄糖氧化酶法試劑盒檢測(cè)上清液中葡萄糖含量。
2.4 TNF-α對(duì)3T3-L1脂肪細(xì)胞的毒性 取已建立好胰島素抵抗模型的3T3-L1脂肪細(xì)胞,吸棄上清液后,PBS清洗1次,然后每孔加入100μL 5 mg/mL的MTT溶液,在 5%CO2培養(yǎng)箱37℃孵育 2.5 h后,加入150μL二甲基亞砜溶解,震蕩10 min,于490 nm處測(cè)定吸光值。
2.5 蛋白免疫印跡法(Western blot)檢測(cè)GLUT4蛋白在膜上的表達(dá)情況 細(xì)胞造模結(jié)束后,空白對(duì)照加胰島素組和模型加胰島素組分別加100 nmol/L的胰島素刺激30 min,去除培養(yǎng)液,收取細(xì)胞于1.5 mL的離心管中,按照膜蛋白提取試劑盒提取膜蛋白,用BCA試劑盒測(cè)定蛋白濃度。依據(jù)蛋白濃度取10μg總蛋白質(zhì),以10%的SDS-PAGE膠分離蛋白,然后濕轉(zhuǎn)法(100 V,3 h)將蛋白質(zhì)轉(zhuǎn)移至PVDF膜上,再用含5%脫脂奶粉的TBST(含0.1%Tween20)室溫下封閉2 h后加入GLUT4的一抗,4℃過夜,洗膜后加辣根過氧化物酶標(biāo)記的二抗,室溫2 h,充分洗滌后用ECL顯影曝光,洗片后用激光掃描儀掃描,使用Image J軟件進(jìn)行灰度分析,目的蛋白的相對(duì)含量為樣品組灰度/對(duì)照組灰度的值。
2.6 高內(nèi)涵技術(shù)檢測(cè)GLUT4的膜轉(zhuǎn)位 取誘導(dǎo)分化好的3T3-L1脂肪細(xì)胞,以1×104細(xì)胞/孔接種于96孔細(xì)胞培養(yǎng)黑板中,TNF-α按照10 ng/mL作用96 h,同時(shí)設(shè)置空白對(duì)照。4%多聚甲醛室溫固定30 min,PBS洗3次,5%胎牛血清封閉2 h,加入一抗孵育過夜。PBS洗3次,加入Dylight 550標(biāo)記的二抗工作液,37℃孵育1 h,含0.05%Tween20的PBS洗3次,再用PBS洗3次,加入Hoechst 33342孵育15 min,PBS洗滌細(xì)胞3次后,用Operetta高內(nèi)涵篩選系統(tǒng)進(jìn)行檢測(cè),再通過Perkin Elmer公司提供的Columbus對(duì)視野中細(xì)胞熒光強(qiáng)度分布結(jié)構(gòu)等信息進(jìn)行量化統(tǒng)計(jì)。
2.7 統(tǒng)計(jì)學(xué)分析 所有實(shí)驗(yàn)獨(dú)立重復(fù)操作至少3次,實(shí)驗(yàn)結(jié)果表示為均數(shù)±標(biāo)準(zhǔn)差(x±s)。實(shí)驗(yàn)結(jié)果采用SPSS 21.0統(tǒng)計(jì)學(xué)軟件進(jìn)行單因素方差分析。P<0.05認(rèn)為差異具有統(tǒng)計(jì)學(xué)意義。
3 結(jié)果
3.1 脂肪細(xì)胞形態(tài)學(xué)變化 油紅O作為脂肪特異性染色劑,能與中性脂肪結(jié)合使成熟脂肪細(xì)胞中的脂滴著色,從而觀察脂肪細(xì)胞中脂肪的含量。從油紅O染色的結(jié)果可看出80%以上的細(xì)胞出現(xiàn)較大脂滴,呈現(xiàn)脂肪細(xì)胞表型,證明本研究采用的誘導(dǎo)分化方法切實(shí)可行。見圖1。
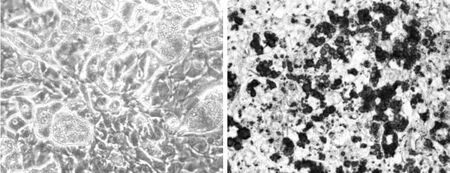
圖1 3T3-L1脂肪細(xì)胞油紅O染色圖(×200)Fig.1 Oil red O stained 3T3-L1 adipocytes(×200)
3.2 TNF-α作用時(shí)間和濃度變化對(duì)3T3-L1前脂肪細(xì)胞存活率及葡萄糖消耗的影響 5、10、15、20、25 ng/mL的TNF-α分別作用于3T3-L1脂肪細(xì)胞48、72、96 h 后,采用噻唑藍(lán)(MTT)法測(cè)定細(xì)胞的存活率。5、10、15、20 和 25 ng/mL 的 TNF-α 作用 48、72 h及5、10 ng/mL作用96 h時(shí)細(xì)胞存活率均大于80%。進(jìn)一步,選擇存活率大于80%的劑量和時(shí)間,再用100 nmol/L的胰島素刺激細(xì)胞30 min,采用葡萄糖氧化酶法試劑盒檢測(cè)其對(duì)細(xì)胞葡萄糖消耗量,見表1。與未加胰島素的正常對(duì)照組相比,胰島素刺激能夠顯著增加細(xì)胞對(duì)葡萄糖的消耗。然而與加胰島素的正常對(duì)照組相比,胰島素刺激TNF-α作用96 h組細(xì)胞葡萄糖消耗顯著降低,并且呈劑量依賴。加胰島素與未加胰島素的TNF-α模型組間葡萄糖消耗沒有顯著差異,以上結(jié)果表明,10 ng/mL TNF-α誘導(dǎo)3T3-L1細(xì)胞96 h產(chǎn)生明顯的胰島素抵抗。見表2。
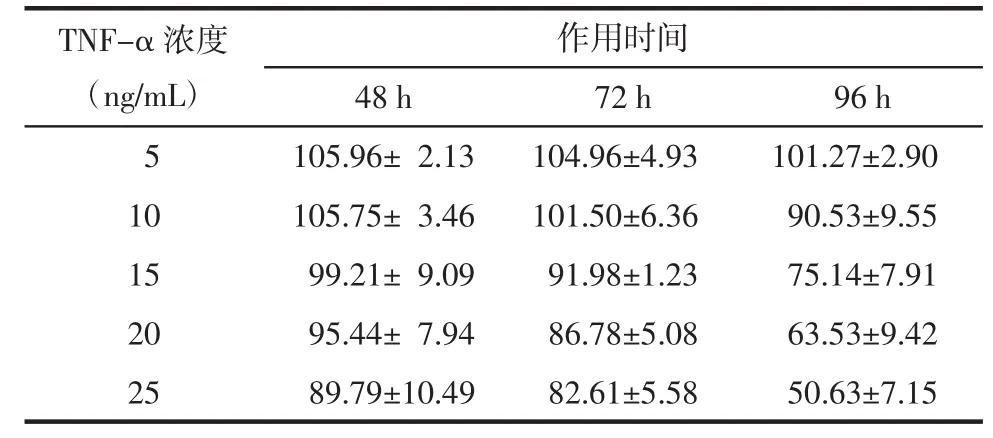
表1 3T3-L1脂肪細(xì)胞的存活率(x±s)Tab.1 Survival rate of 3T3-L1 adipocytes(x±s)%
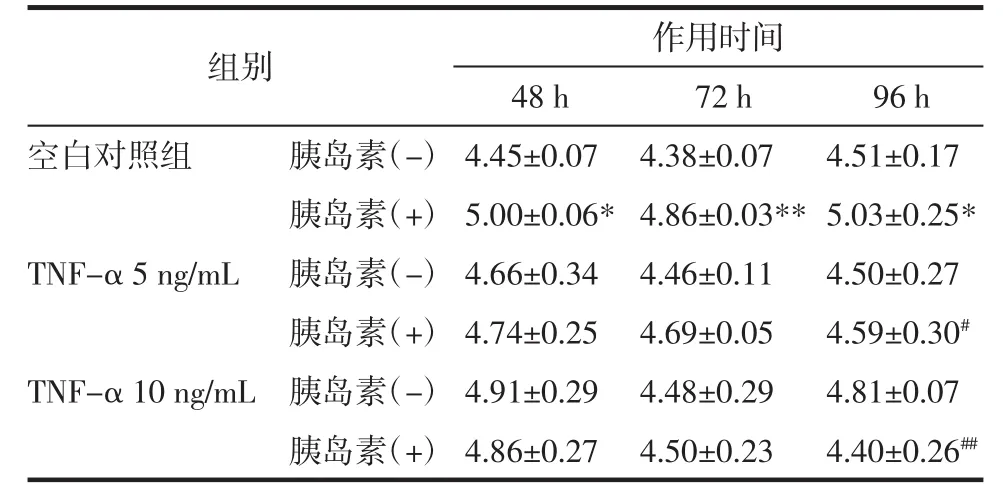
表2 3T3-L1脂肪細(xì)胞的葡萄糖消耗(x±s)Tab.2 Effect of TNF-αon glucose consumption in 3T3-L1 adipocytes(x±s)mmol/L
3.3 TNF-α對(duì)3T3-L1脂肪細(xì)胞膜上GLUT4蛋白表達(dá)的影響 研究表明,GLUT4參與脂肪細(xì)胞對(duì)葡萄糖攝取,其可能是胰島素抵抗的重要分子機(jī)制[9]。利用Western blot考察TNF-α誘導(dǎo)的3T3-L1脂肪細(xì)胞胰島素抵抗模型中細(xì)胞膜GLUT4的表達(dá)。由圖2可以看出,以Caveolin為內(nèi)參,無胰島素刺激時(shí),與未造模組相比,加TNF-α組細(xì)胞膜上GLUT4顯著降低;在胰島素的刺激下,TNF-α組與只加胰島素組細(xì)胞膜GLUT4的表達(dá)有顯著減少,只加胰島素組與空白對(duì)照組相比細(xì)胞膜GLUT4有明顯的增加,蛋白定量結(jié)果與Western blot結(jié)果一致,見表3。可見,GLUT4膜蛋白表達(dá)下調(diào)與胰島素抵抗模型建立相關(guān)。
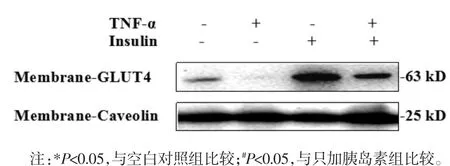
圖2 TNF-α對(duì)3T3-L1脂肪細(xì)胞膜上GLUT4表達(dá)的影響Fig.2 Effectsof TNF-αon GLUT4 expression in 3T3-L1 adipocyte membrane

表3 3T3-L1脂肪細(xì)胞膜上GLUT4的蛋白定量(x±s)Tab.3 Protein quantification of GLUT4 on 3T3-L1 adipocyte membrane(x±s)
3.4 高內(nèi)涵分析GLUT4的膜轉(zhuǎn)位 為了進(jìn)一步檢測(cè)TNF-α引起的胰島素抵抗是否導(dǎo)致GLUT4從胞漿轉(zhuǎn)位至細(xì)胞膜,利用高內(nèi)涵成像系統(tǒng)考察了GLUT4在細(xì)胞中的分布情況,并進(jìn)行定量分析。結(jié)果如圖3所示,空白對(duì)照組C中,GLUT4蛋白均勻分布在胞漿(黃色熒光),給予胰島素(100 nmol/L)作用15 min后,GLUT4一部分轉(zhuǎn)移到膜上(C+I)。模型組(M)細(xì)胞膜上GLUT4的表達(dá)較空白對(duì)照組(C)顯著減少,模型加胰島素組(M+I)與空白對(duì)照加胰島素組(C+I)相比,模型加胰島素組(M+I)的 GLUT4在膜上的表達(dá)量相對(duì)較少,與定量分析結(jié)果一致,見表4,由此可以看出TNF-α誘導(dǎo)的胰島素抵抗可以減少GLUT4的膜轉(zhuǎn)位。
4 討論
糖尿病是一種進(jìn)行性發(fā)展的慢性、終身性疾病。近年來,隨著人民生活水平的提高,糖尿病的患病率逐年上升。據(jù)國(guó)際糖尿病聯(lián)盟發(fā)布的數(shù)據(jù),2015年全球糖尿病的患病率為8.8%,患病人數(shù)達(dá)4.15億,死亡人數(shù)達(dá)到500萬,糖尿病已成為嚴(yán)重影響人類健康的主要慢性非傳染性疾病之一[10]。現(xiàn)代醫(yī)學(xué)認(rèn)為其發(fā)病主要與遺傳、環(huán)境因素等相關(guān),胰島素抵抗在2型糖尿病發(fā)病、發(fā)展過程中起到至關(guān)重要的作用。
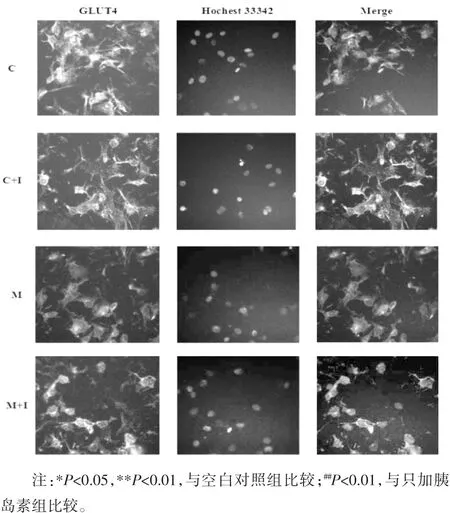
圖3 TNF-α誘導(dǎo)的胰島素抵抗對(duì)GLUT4的膜轉(zhuǎn)位的影響(×200)Fig.3 Effect of TNF-α-induced insulin resistanceon translocation of GLUT4 to theplasma membrane(×200)

表4 3T3-L1脂肪細(xì)胞膜上GLUT4蛋白的平均光密度值(x±s)Tab.4 Mean optical density of GLUT4 protein on 3T3-L1 adipocyte membrane(x±s)
胰島素抵抗既是2型糖尿病的特征又是導(dǎo)致2型糖尿病的主要原因[11]。遺傳因素、胰島素信號(hào)通路障礙、血清游離脂肪酸濃度增高或細(xì)胞內(nèi)脂肪含量增多、炎癥和氧化應(yīng)激等諸多因素均可引起胰島素抵抗[12]。
王春等[13]考察了111例2型糖尿病住院患者空腹血清TNF-α的水平后認(rèn)為糖尿病患者體內(nèi)的TNF-α與胰島素抵抗輕重程度呈正相關(guān),進(jìn)一步說明TNF-α在胰島素抵抗的發(fā)生、發(fā)展中具有重要的作用,并且肥胖是影響炎癥因子水平與胰島素抵抗的重要因素。其中,TNF-α主要由脂肪組織分泌產(chǎn)生,與慢性胰島素抵抗的發(fā)生關(guān)系密切。TNF-α可通過多途徑影響胰島素信號(hào)傳導(dǎo)通路來參與胰島素抵抗的發(fā)生[14]。在早期的研究中發(fā)現(xiàn),對(duì)TNF-α基因進(jìn)行剔除后,能夠增加體內(nèi)胰島素敏感性,從而改善糖脂代謝,間接說明TNF-α可能引起胰島素抵抗[15]。
據(jù)此,本研究采用TNF-α作用于3T3-L1脂肪細(xì)胞,從慢性低度的炎癥角度出發(fā)建立胰島素抵抗模型。Li等[16]與 Palaci-Osortega 等[17]采用了 10 ng/mL的TNF-α分別持續(xù)刺激分化成熟的3T3-L1脂肪細(xì)胞24 h和48 h建立胰島素抵抗模型;還有一些研究人員[18]采用2 ng/mL的TNF-α孵育96 h建立3T3-L1脂肪細(xì)胞胰島素抵抗模型。相反,有研究[19]表明,在TNF-α作用時(shí)間相對(duì)較短(24 h)時(shí),脂肪細(xì)胞的胰島素依賴性信號(hào)轉(zhuǎn)導(dǎo)不受影響,胰島素刺激的葡萄糖轉(zhuǎn)運(yùn)無顯著變化,據(jù)此,本研究中造模作用時(shí)間分別是48、72、96 h,發(fā)現(xiàn)不同的作用時(shí)間下高劑量的TNF-α均會(huì)使細(xì)胞存活率顯著降低;而TNF-α使用劑量過低均不能引起胰島素依賴性葡萄糖攝取的變化,也因此不能引起胰島素抵抗。同時(shí),TNF-α作用超過96 h后也不會(huì)引起胰島素敏感性葡萄糖攝取下降。研究結(jié)果表明TNF-α誘發(fā)3T3-L1細(xì)胞胰島素抵抗模型的最佳方案為10ng/mL的TNF-α作用細(xì)胞96 h。鑒于上述文獻(xiàn)只是用葡萄糖攝取的方法檢測(cè)模型是否成立,并沒有考察TNF-α對(duì)細(xì)胞存活率的影響,胰島素抵抗模型在考察了造模藥TNF-α的作用時(shí)間及使用劑量的同時(shí),考察TNF-α對(duì)細(xì)胞存活率的影響,以保證TNF-α的劑量不影響細(xì)胞活力,從而造成重現(xiàn)性好的胰島素抵抗模型。
有文獻(xiàn)報(bào)導(dǎo),TNF-α與其他細(xì)胞因子在脂肪組織中直接或間接地影響著體內(nèi)葡萄糖代謝,TNF-α可直接抑制脂肪細(xì)胞中主要葡萄糖轉(zhuǎn)運(yùn)蛋白GLUT4,使其表達(dá)下降而降低胰島素刺激的葡萄糖轉(zhuǎn)運(yùn),誘發(fā)胰島素抵抗[20]。而且,胰島素抵抗的肥胖病人脂肪細(xì)胞中GLUT4表達(dá)水平明顯下降。此外,TNF-α刺激下,GLUT4在2型糖尿病大鼠脂肪和肌肉細(xì)胞中的表達(dá)明顯降低[21]。另一方面研究發(fā)現(xiàn),Ishibashi等[22]通過elaidate誘導(dǎo)的3T3-L1脂肪細(xì)胞胰島素抵抗模型中,細(xì)胞內(nèi)轉(zhuǎn)移到細(xì)胞膜上的GLUT4明顯下降,從而引起葡萄糖的消耗減少。這與以往Prasad等[23]的研究結(jié)果一致。Zierath等[24]研究發(fā)現(xiàn),骨骼肌細(xì)胞長(zhǎng)期暴露于高濃度胰島素誘導(dǎo)的胰島素抵抗模型中GLUT4活性降低或轉(zhuǎn)位障礙,且對(duì)生理濃度的胰島素刺激無反應(yīng)。近年研究發(fā)現(xiàn),胰島素抵抗細(xì)胞模型中細(xì)胞膜上GLUT4蛋白表達(dá)量均會(huì)顯著減少[23-28],GLUT4介導(dǎo)的葡萄糖轉(zhuǎn)運(yùn)是外周組織葡萄糖利用的限速步驟[29]。因此,推測(cè)GLUT4膜蛋白表達(dá)及膜轉(zhuǎn)位可以作為判定TNF-α胰島素模型是否建立的標(biāo)準(zhǔn)。本研究中對(duì)3個(gè)批次細(xì)胞樣品進(jìn)行分析,TNF-α刺激的3T3-L1脂肪細(xì)胞胰島素抵抗模型中有或無胰島素刺激時(shí),GLUT4在細(xì)胞膜上的表達(dá)均明顯下降,說明GLUT4的下調(diào)作用可能與胰島素抵抗相關(guān)。與此同時(shí)實(shí)驗(yàn)中采用了高內(nèi)涵篩選的方法定性定量地進(jìn)行GLUT4膜轉(zhuǎn)位檢測(cè)。
高內(nèi)涵篩選分析作為系統(tǒng)生物學(xué)時(shí)代的一項(xiàng)領(lǐng)先技術(shù),能夠快速高效獲得細(xì)胞所產(chǎn)生的實(shí)時(shí)和多維立體的生物效應(yīng)信息[30]。在保持細(xì)胞結(jié)構(gòu)和功能完整性的前提下,高內(nèi)涵篩選設(shè)備具有的高分辨率熒光數(shù)碼成像系統(tǒng)可以通過多維立體的方式進(jìn)行實(shí)時(shí)監(jiān)控某待測(cè)樣品對(duì)細(xì)胞產(chǎn)生的效應(yīng)信號(hào),可以在實(shí)驗(yàn)中同步檢測(cè)被篩樣品對(duì)于細(xì)胞生理狀態(tài)(如細(xì)胞形態(tài)、生長(zhǎng)分化狀態(tài)、信號(hào)通路以及細(xì)胞代謝途徑的各個(gè)環(huán)節(jié))的改變[31],并且可以從多角度觀察被篩樣品對(duì)細(xì)胞內(nèi)蛋白表達(dá)及轉(zhuǎn)移的影響[32]。穆蕊等[33]應(yīng)用HCS平臺(tái)對(duì)TNF-α刺激前后的核因子-κB(NF-κB)的熒光信號(hào)進(jìn)行量化,通過計(jì)算細(xì)胞核/細(xì)胞漿熒光強(qiáng)度的比值來表示NF-κB的細(xì)胞定位。本實(shí)驗(yàn)通過高內(nèi)涵篩選探究了胰島素抵抗模型細(xì)胞中GLUT4分布,結(jié)果顯示TNF-α誘導(dǎo)的胰島素抵抗可以明顯減少GLUT4的膜轉(zhuǎn)位,在證明胰島素抵抗模型成立的同時(shí),也可以更加形象直觀地觀察到GLUT4蛋白的分布變化情況。既然脂肪細(xì)胞中GLUT4與胰島素抵抗直接相關(guān),那么通過高內(nèi)涵定量分析的方法考察GLUT4的膜轉(zhuǎn)位就有可能為驗(yàn)證脂肪細(xì)胞胰島素抵抗提供借鑒。幾次造模結(jié)果均顯示TNF-α誘導(dǎo)的胰島素抵抗模型中GLUT4膜蛋白表達(dá)顯著減少,與葡萄糖攝取結(jié)果保持一致。鑒于胰島素抵抗模型成立的鑒定方法多采用檢測(cè)葡萄糖消耗量這一種形式[16-18],因而本實(shí)驗(yàn)建立起來的GLUT4膜蛋白表達(dá)及膜轉(zhuǎn)位測(cè)定可以作為鑒定模型是否成功及是否穩(wěn)定的指標(biāo)。
綜上所述,本研究運(yùn)用TNF-α孵育3T3-L1細(xì)胞建立胰島素抵抗模型,并且建立起模型鑒定的新指標(biāo),可進(jìn)一步用于研究炎癥引起的胰島素抵抗機(jī)制及篩選具有抗糖尿病活性的藥物。

