銀杏葉提取物對放射性損傷耳蝸毛細胞株HEI-OC1增殖、凋亡及Survivin、Bax表達的影響
馬 敬,郭金寶,錢俊勇,仇繼兵
(江蘇省常州市第三人民醫院,江蘇 常州 213001)
放射性治療所致聽力神經損傷是頭頸部腫瘤放射性治療后最常見的不良反應之一[1],其發病率高,且目前臨床尚無特效治療藥,嚴重影響患者生活質量。銀杏葉提取物(EGB)主要有效成分為銀杏萜內酯類化合物和銀杏黃酮類[2],因其具有生物利用度高、毒性弱、治療多靶點、療效顯著、代謝完全等優點,現已廣泛應用于惡性腫瘤的預防及治療方面[3]。研究表明,EGB可明顯減輕鼻咽癌患者放射性治療期間內耳損傷程度,推測EGB具有防護放射線對中耳損傷的作用,但其作用機制尚未闡明[4]。目前,國內外尚少見EGB對放射性損傷耳蝸毛細胞株HEI-OC1影響的研究。基于此,本研究探討了EGB761對放射性損傷耳蝸毛細胞株HEI-OC1增殖、凋亡及細胞存活素(Survivin)、Bcl-2家族前凋亡蛋白(Bax)表達的影響,旨在為EGB應用于臨床放射性聽力神經損傷治療提供一定理論參考。
1 實驗資料
1.1材料
1.1.1細胞株 耳蝸毛細胞株HEI-OC1,由美國豪斯耳研究所提供。
1.1.2主要試劑與儀器 EGB761,購于德國威瑪舒培博士藥廠,生產批號1710711;高糖DMEM培養基,購于杭州吉諾生物醫藥技術有限公司;胎牛血清,購自杭州四季青公司;二甲基亞砜(DMSO)、噻唑藍(MTT),購于美國Sigma公司;細胞周期及凋亡檢測試劑盒,購于碧云天生物研究所;瓊脂糖,購于法國Biowest公司;Trizol、反轉錄試劑盒、SYBR PrimeScript RT-PCR Kit,購于日本TaKaRa公司;CO2培養箱,購于美國Thermo Fisher公司;FACSCalibur流式細胞儀,購于美國BD公司;紫外分光光度計,購于美國Beckman公司;qRT-PCR儀ABI7700,購于美國ABI公司。
1.2方法
1.2.1細胞培養 將耳蝸毛細胞株HEI-OC1細胞接種于含體積百分數10%胎牛血清高糖DMEM培養基中,置于10% CO2培養箱中33 ℃傳代培養,整個過程中均未添加任何抗生素,以免影響耳蝸毛細胞株HEI-OC1細胞生物學特性。
1.2.2細胞照射與分組處理 取對數生長期HEI-OC1細胞進行試驗研究,分別設置正常對照組、放射性損傷組及10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組。除正常對照組為正常未經照射處理細胞,其他各組對數生長期細胞均進行照射處理,放射源VARIAN 2300EX直線加速器6 MV X線,100 cm源皮距,照射劑量率4 Gy/min,照射劑量20 Gy。干預組分別加入含有相應濃度EGB761的培養基,正常對照組、放射性損傷組給予等體積DMSO作為對照。
1.2.3HEI-OC1細胞增殖能力檢測 采用MTT實驗檢測HEI-OC1細胞增殖能力,消化計數,調整細胞濃度,按1.0×105個/mL接種于96孔板,分別于24 h、48 h、72 h、96 h加入20 μL濃度為5 g/L的MTT,繼續孵育4 h,離心去上清,每孔加入200 μL DMSO終止反應,震蕩10 min后,采用酶聯免疫分析儀,于波長570 nm處測定樣本吸光度,以時間為橫坐標,吸光度為縱坐標,繪制生長曲線。
1.2.4HEI-OC1細胞凋亡率檢測 采用胰酶消化制成HEI-OC1細胞懸浮液,離心并收集細胞,采用PBS洗滌液洗滌HEI-OC1細胞,利用流式細胞儀(FCM),按照標準程序檢測HEI-OC1細胞凋亡率,具體操作嚴格按照儀器及試劑盒使用說明書進行。
1.2.5Survivin、Bax表達水平檢測 收集各組細胞,經PBS液洗滌后,采用Trizol法分別提取HEI-OC1細胞總RNA,所提RNA無DNA、蛋白質殘留,純度較高。利用反轉錄試劑盒進行反轉錄操作,所得cDNA用以作為qRT-PCR反應模板。qRT-PCR反應選用SYBR PrimeScript RT-PCR Kit定量擴增體系,反應總體積10 μL:cDNA 0.8 μL,SYBR Primix Ex Taq 5 μL,引物1.2 μL,RNase H2O 1.8 μL。反應條件為:94 ℃預變性5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,擴增30個循環。以β-action為內參,每個樣品設置3個復孔,結果采用2-ΔΔCT方法處理,其中ΔΔCT=(CT目的基因-CTβ-action)觀察組-(CT目的基因-CTβ-action)對照組。引物見表1。

表1 qRT-PCR 擴增引物序列
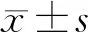
2 結 果
2.1各組HEI-OC1細胞增殖比較 與正常對照組比較,放射性損傷組HEI-OC1細胞增殖能力明顯下降(P<0.05);與放射性損傷組比較,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組HEI-OC1細胞增殖能力明顯上升(P均<0.05),且呈一定劑量依賴性。見圖1。

圖1 各組HEI-OC1細胞增殖能力比較
2.2各組HEI-OC1細胞凋亡率比較 正常對照組、放射性損傷組以及10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組HEI-OC1細胞凋亡率分別為(2.62±0.23)%,(9.06±0.37)%,(7.45±0.32)%,(5.29±0.28)%,(4.17±0.33)%和(2.93±0.24)%。與正常對照組比較,放射性損傷組HEI-OC1細胞凋亡率明顯增加(P<0.05);與放射性損傷組比較,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組HEI-OC1細胞凋亡率均明顯降低(P均<0.05),且呈一定劑量依賴性。
2.3各組HEI-OC1細胞中Survivin、Bax表達水平比較 與正常對照組比較,放射性損傷組HEI-OC1細胞中Survivin表達水平明顯下降(P<0.05),Bax表達水平明顯升高(P<0.05);與放射性損傷組比較,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組HEI-OC1細胞中Survivin表達水平明顯升高(P均<0.05),Bax表達水平明顯下降(P均<0.05),且呈一定劑量依賴性。見圖2及圖3。

注:A、B、C、D、E、F分別代表正常對照組、放射性損傷組和10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組;①與A組比較,P<0.05;②與B組比較,P<0.05;③與C組比較,P<0.05;④與D組比較,P<0.05;⑤與E組比較,P<0.05。
圖2 各組HEI-OC1細胞中Survivin表達水平比較

注:A、B、C、D、E、F分別代表正常對照組、放射性損傷組和10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干預組;①與A組比較,P<0.05;②與B比較,P<0.05;③與C組比較,P<0.05;④與D組比較,P<0.05;⑤與E組比較,P<0.05。
圖3 各組HEI-OC1細胞中Bax表達水平比較
3 討 論
放射性治療是臨床上治療頭頸部腫瘤的常用手段,尤其是鼻咽癌患者,放射性治療是其根治性治療的唯一手段[5]。放射物理學技術及放射生物學等技術的不斷發展,使得頭頸部腫瘤患者生存率有了明顯提高,但在鼻咽癌放射治療過程中,耳部各個部分幾乎全部暴露于放射視野內,導致耳道炎、慢性化膿性中耳炎、分泌性中耳炎、顳骨壞死等多種耳部并發癥發生[6-8]。因此,放射性治療后腫瘤患者生存質量受到廣泛關注,在放療過程中如何防護放射線對耳部正常部位損傷,是目前臨床亟待解決的關鍵性問題。
近年來,中藥以其安全性高、治療多靶點、毒性小的優點在抗癌臨床上得到了廣泛應用[9],發掘新的有效中藥活性成分是目前疾病治療的潛在策略。EGB761是目前我國臨床上使用最為廣泛的中藥材提取物之一,其主要有效成分為銀杏萜內酯類化合物和銀杏黃酮類[10],國內外學者對其化學成分及其藥理作用進行廣泛研究,證實其具有抗炎、保護缺血損傷、調血脂、擴張血管、抗腫瘤以及拮抗血小板活化因子等重要藥理作用[11-13],在臨床心腦血管、腫瘤等多種疾病治療方面療效確切。施雨露等[14]研究結果顯示,EGB可明顯降低X射線照射小鼠骨髓細胞染色體畸變率,發揮抗輻射作用。姜梁等[15]研究結果表明,EGB可通過擴張耳部血管,中和及清除機體自由基,減少脂質過氧化作用,從而減少豚鼠中耳早期放射性損傷,且EGB不良反應少,性質穩定,推薦臨床鼻咽癌等頭頸部腫瘤患者放療時使用。基于此,本研究探討了EGB761對放射性損傷耳蝸毛細胞株HEI-OC1增殖、凋亡及Survivin、Bax表達的影響,旨在為EGB應用于臨床放射性聽力神經損傷治療提供更為可靠的理論參考依據。
本研究MTT實驗結果顯示,與正常對照組比較,放射性損傷組HEI-OC1細胞增殖能力明顯下降;與放射性損傷組比較,EGB761干預組HEI-OC1細胞增殖能力明顯上升,且呈一定劑量依賴性。說明20 Gy照射劑量明顯降低HEI-OC1細胞增殖能力,經不同劑量EGB761干預后HEI-OC1細胞增殖能力明顯上升,提示EGB761可明顯逆轉照射所致HEI-OC1細胞增殖能力下降,發揮防輻射作用。FCM實驗結果顯示,與正常對照組比較,放射性損傷組HEI-OC1細胞凋亡率明顯增加;與放射性損傷組比較,EGB761干預組HEI-OC1細胞凋亡率明顯降低。提示EGB761可逆轉輻射損傷所致HEI-OC1細胞凋亡,提高HEI-OC1細胞存活率。宋媛媛等[16]研究結果顯示,EGB可明顯拮抗輻射所致大鼠骨髓間充質干細胞存活率降低,減少細胞凋亡,進而減輕大鼠骨髓間充質干細胞輻射損傷,支持本研究觀點。Survivin是近年來新發現的凋亡抑制基因[17],在細胞周期中可呈現周期依賴性表達,可在G2/M周期明顯高表達,抑制細胞下游執行細胞凋亡相關基因Caspase-3及Caspase-7活化[18],從而有利于細胞增殖及分化。Bax為凋亡活化基因[19-20],是Bcl-2凋亡調節基因家族重要成員之一,可與Bcl-2基因共同調節線粒體凋亡過程[21-22]。qRT-PCR結果顯示,與正常對照組比較,放射性損傷組HEI-OC1細胞中Survivin水平明顯下降,Bax水平明顯升高,經EGB761干預HEI-OC1細胞中Survivin水平明顯升高,Bax水平明顯下降,推測EGB761可通過上調Survivin基因表達,從而促進Survivin對Caspase-3活化,促進細胞增殖,另一方面下調Bax基因的表達,進一步抑制HEI-OC1細胞凋亡,從而發揮逆轉HEI-OC1細胞放射性損傷作用。
綜上所述,EGB761可明顯促進HEI-OC1細胞增殖,抑制HEI-OC1細胞凋亡,推測其作用機制可能為上調凋亡抑制基因Survivin表達及下調凋亡促進基因Bax表達。本研究仍存在研究指標較少等不足之處,僅在細胞增殖及凋亡方面進行了實驗研究,EGB761在逆轉放射性損傷領域的臨床應用價值,仍需進一步實驗及臨床研究充分驗證。

