陽荷乙醇提取物及其硬膠囊制備工藝研究
蔡 依,徐津林,郭百臻,阮金蘭
(1.武昌理工學院生命科學學院,湖北武漢 430223;2.武漢工程大學化工與制藥學院,湖北武漢 430073)
陽荷[1](Zingiber striolatum Diels) 系姜科姜屬多年生草本植物,其新鮮根莖的嫩芽是主要藥用部位,廣泛分布于貴州、四川、廣西、江西、湖北、湖南、廣東等地;生于海拔300~1 900 m的林蔭下、溪邊。陽荷是野生蔬菜,一年種植多年生長,能經受環境的惡劣磨煉,生命力極頑強,基本上無病蟲害,無需使用農藥,且多地均有栽培。陽荷[1]是食藥同源植物,嫩芽、莖、果味道香甜,可直接烹飪食用,富含有豐富的膳食纖維、必需氨基酸、蛋白質,具有活血、化瘀、降血糖[2]、治療痛經[3]等作用,藥用價值非常高。黃酮類[4]化合物廣泛存在于高等植物中的莖、花、果實、葉、根中,大量研究表明黃酮類化合物具有降脂、抑菌、抗氧化、抗突變、抗癌[6]等活性,為其在食品、醫藥領域的開發應用提供了理論基礎,加快了黃酮類化合物的開發利用[7]。試驗以提取物浸膏得率和總黃酮含量為指標,綜合評價陽荷乙醇提取物的最佳制備工藝,并通過輔料篩選、休止角測定與質量檢測研究,將陽荷乙醇提取物制成硬膠囊,以期為陽荷的深入研究與開發,充分發掘陽荷的藥用價值和資源利用提供參考。
1 材料與方法
1.1 材料與儀器
陽荷,湖北省利川市現代農業公司提供,經課題組鑒定為姜科姜屬植物陽荷(Zingiber striolatum Diels) 的幼嫩芽苞。
儀器:紫外分光光度計、電子天平、恒溫鼓風干燥箱、旋轉蒸發儀、pH計、真空干燥器、高速粉碎機。
材料:乙醇、硝酸鋁、稀鹽酸、亞硝酸鈉氫氧化鈉、蘆丁對照品、氫氧化鈉、淀粉、糊精、胰蛋白酶、3號膠囊殼。
1.2 試驗方法
1.2.1 陽荷粉末的制備
將陽荷洗凈,于60℃烘箱中烘干,用高速粉碎機打成粉末,過40目篩,于4℃條件下保存。
1.2.2 蘆丁標準曲線的繪制[8]
稱取10 mg蘆丁標準品,用60%乙醇溶解并定容至100 mL,配制成質量濃度為0.1 mg/mL的蘆丁標準溶液。精密量取上述標準溶液0,2.5,5.0,7.5,10.0,12.5 mL分別置于25 mL容量瓶中,加入60%乙醇使成12.5 mL,精密量取5%亞硝酸鈉溶液0.75 mL,搖勻,靜置5 min,再加入10%硝酸鋁溶液0.75 mL,搖勻,靜置6 min,加4%氫氧化鈉溶液11 mL,于波長506 nm處測定吸光度,60%乙醇溶液作為空白對照。
以樣品質量濃度為橫坐標,吸光度為縱坐標,繪制標準曲線,得回歸方程:
Y=9.197 1X+0.001 9,R2=0.999 3.
蘆丁標準曲線見圖1。
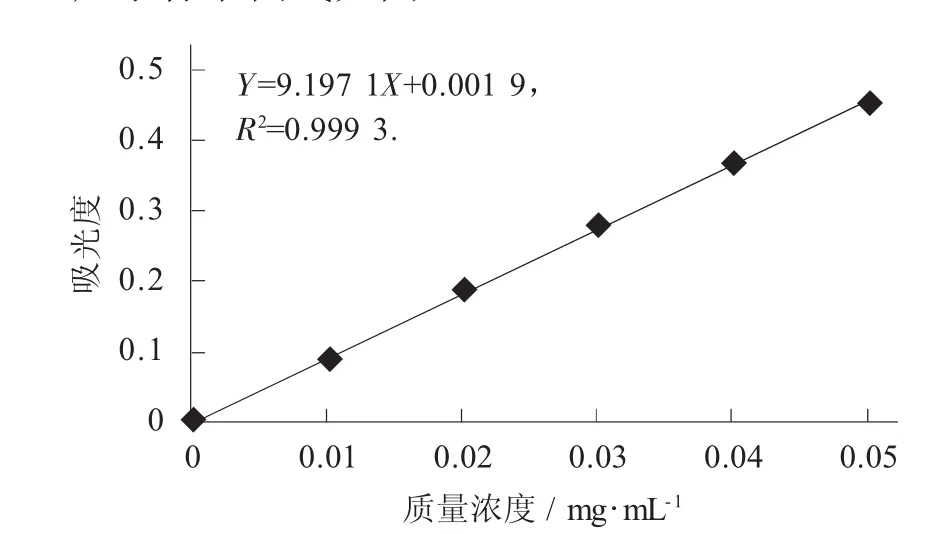
圖1 蘆丁標準曲線
1.2.3 單因素試驗
(1)乙醇體積分數對陽荷提取物總黃酮含量的考查。稱取陽荷粉末各5份,每份50 g,分別用50%,60%,70%,80%,90%乙醇,料液比1∶12,回流提取2 h,減壓回收部分溶劑至1/3體積,加適量水沉淀,純化后的溶液于506 nm處測量吸光度,測定陽荷乙醇提取物的總黃酮含量。
(2)料液比對陽荷乙醇提取物總黃酮含量的考查[9]。稱取陽荷粉末各5份,每份50 g,用1.2.3(1)中的最佳乙醇體積分數提取,分別以1∶6,1∶8,1∶10,1∶12,1∶14的料液比回流提取2 h,減壓回收部分溶劑至1/3體積,加適量水沉淀,純化后的溶液于波長506 nm處測定吸光度,測定陽荷乙醇提取物總黃酮的含量。
(3)提取時間對陽荷乙醇提取物總黃酮含量的考查。稱取陽荷粉末各5份,每份50 g,用1.2.3(2) 項中的最佳料液比為提取料液比,1.2.3(1) 中的最佳乙醇體積分數為提取溶劑,分別以1,2,3,4,5 h回流提取,減壓回收部分溶劑至1/3體積,加適量水沉淀,用純化后的溶液于波長506 nm處測定吸光度,測定陽荷乙醇提取物的總黃酮的含量。
1.2.4 陽乙醇提取物總黃酮含量的計算
精密吸取上述各單因素試驗中的樣品溶液1.0 mL,按1.2.2中的試驗步驟測定樣品溶液吸光度,按下列公式計算得各樣品溶液的總黃酮含量。
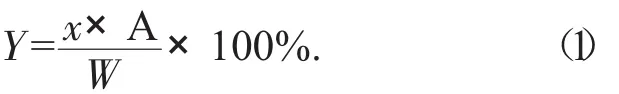
式中:Y——陽荷乙醇提取物總黃酮含量,mg/g;
x——由標準曲線算出的質量濃度,mg/mL;
A——稀釋倍數;
W——陽荷粉末質量,g。
1.2.5 陽荷總浸膏得率的計算
將醇提水沉后的水溶液置干燥箱中105℃干燥至恒質量,稱質量,按下列公式計算陽荷總浸膏得率。
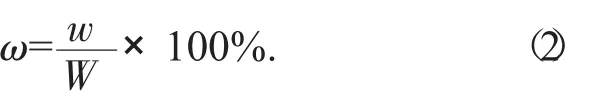
式中:ω——陽荷總浸膏得率,%;
w——干燥至恒質量的浸膏質量,g;
W——陽荷粉末質量,g。
1.2.6 正交試驗
正交因素水平表的設計[10]:根據單因素試驗結果,設計L9(33)表,以陽荷乙醇提取物的總黃酮含量和陽荷總浸膏得率為綜合評價指標。
因素與水平設計見表1。

表1 因素與水平設計
2 結果與分析
2.1 單因素試驗結果
2.1.1 乙醇體積分數對提取物總黃酮含量的影響
乙醇體積分數對陽荷乙醇提取物總黃酮含量的影響見圖2。

圖2 乙醇體積分數對陽荷乙醇提取物總黃酮含量的影響
由圖2可知,隨著乙醇體積分數的提高,陽荷乙醇提取物的總黃酮含量逐漸升高,當乙醇體積分數達到70%時,總黃酮含量最高,達到1.288 5 mg/g,進一步提高乙醇體積分數時,總黃酮含量下降,50%~70%乙醇適用于提取生物堿、蒽醌類類物質,高于70%的乙醇適用于提取有機酸、揮發油等物質,70%乙醇能較多提取出黃酮苷、苷元類物質。分析可見乙醇體積分數過低時,部分游離黃酮提取不完全,過高部分黃酮苷類成分提取不完全,而70%乙醇則兼顧了陽荷中存在的2種形式的黃酮類化合物。因此,確定乙醇最佳體積分數為70%。
2.1.2 料液比對陽荷乙醇提取物總黃酮含量的影響
料液比對陽荷乙醇提取物總黃酮含量的影響見圖3。
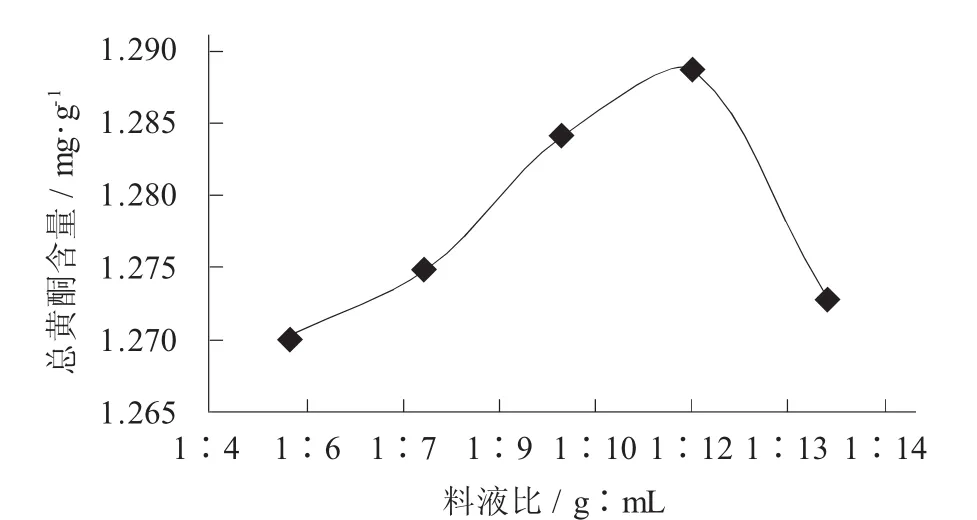
圖3 料液比對陽荷乙醇提取物總黃酮含量的影響
由圖3可知,隨著料液比的增加,陽荷乙醇提取物總黃酮的含量逐漸升高,當料液比為1∶12時,總黃酮含量最高,達到1.455 8 mg/g,料液比達到1∶14時,總黃酮的含量開始下降,增大乙醇溶液體積,傳質速率增大,更多黃酮類物質溶出,總黃酮含量增大,料液比過大時,多余的乙醇溶液稀釋了提取液,傳質速率減小,總黃酮含量降低。分析可見料液比1∶12時陽荷中主要化學成分黃酮類化合物提取較完全,而提取溶劑體積過小,主要成分溶出不完全,過大將帶來成本增加。因此,確定最佳料液比為1∶12。
2.1.3 提取時間對陽荷提取物總黃酮含量的影響
提取時間對陽荷乙醇提取物總黃酮含量的影響見圖4。
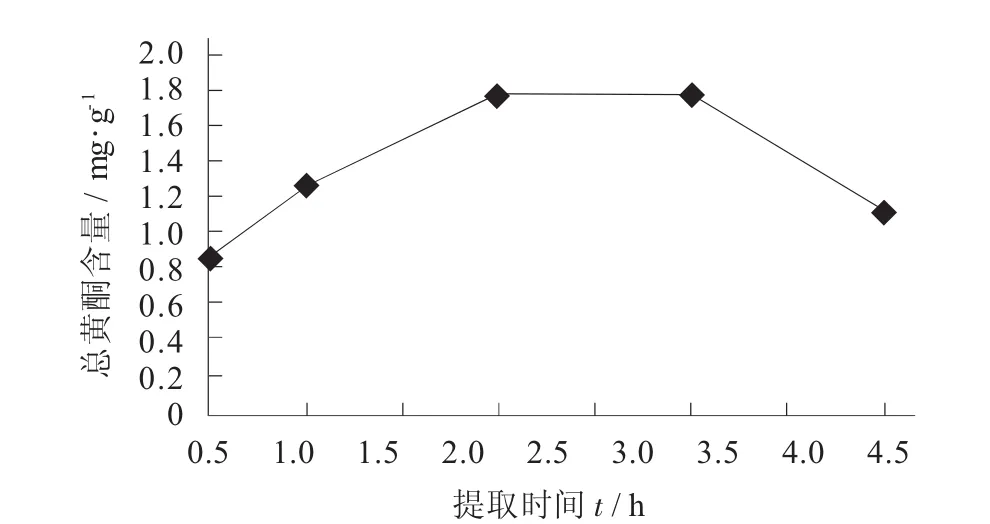
圖4 提取時間對陽荷乙醇提取物總黃酮含量的影響
由圖4可知,隨著提取時間的增加,陽荷乙醇提取物的總黃酮含量逐漸升高,2 h時,總黃酮含量達到峰值為1.775 9 mg/g,提取時間超過2 h時,總黃酮含量開始下降,分析可見提取時間過短,主要化學成分提取不完全,過長則無疑會帶來成本的增加。因此,確定最佳提取時間為2 h。
2.2 正交試驗結果與分析
2.2.1 總黃酮含量測定結果分析
L9(33)直觀分析見表2,方差分析見表3。
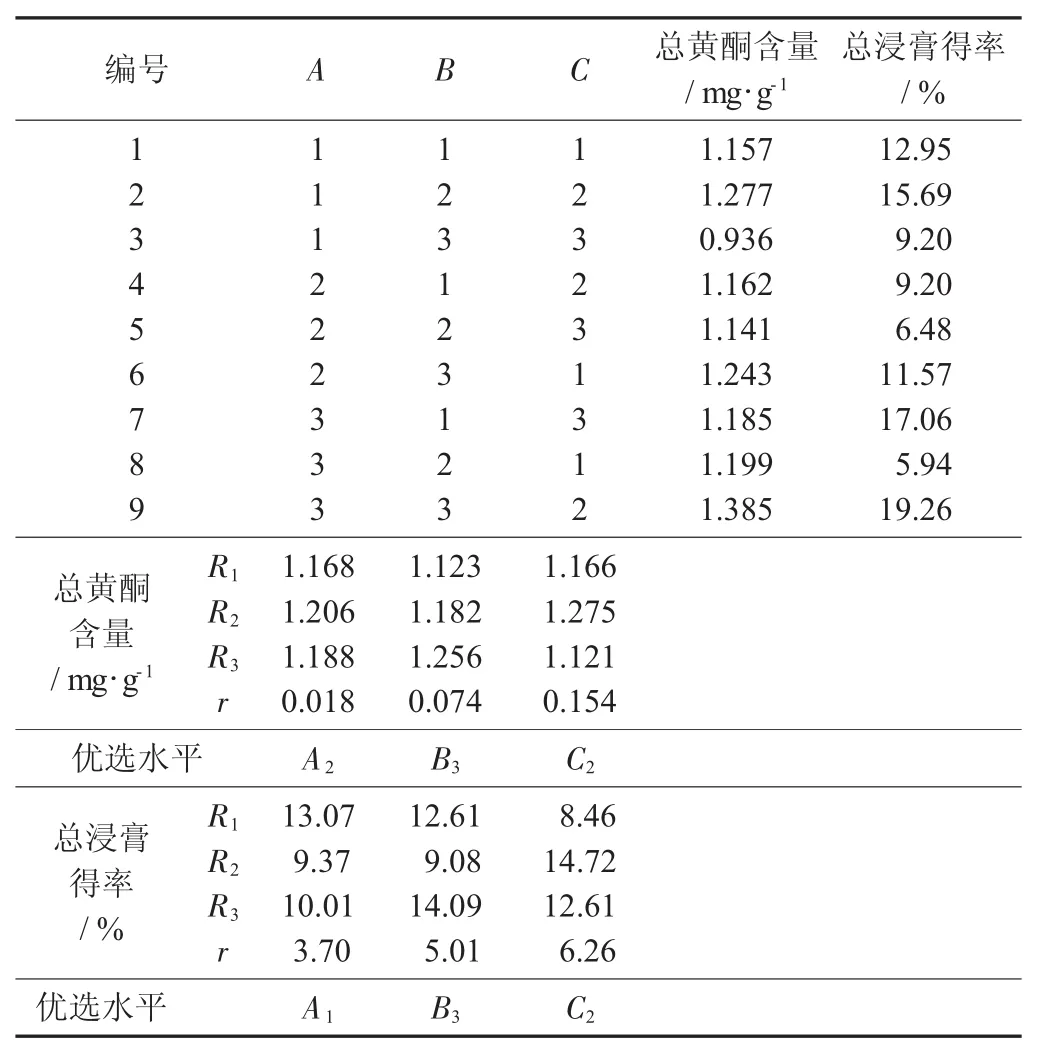
表2 L9(33)直觀分析
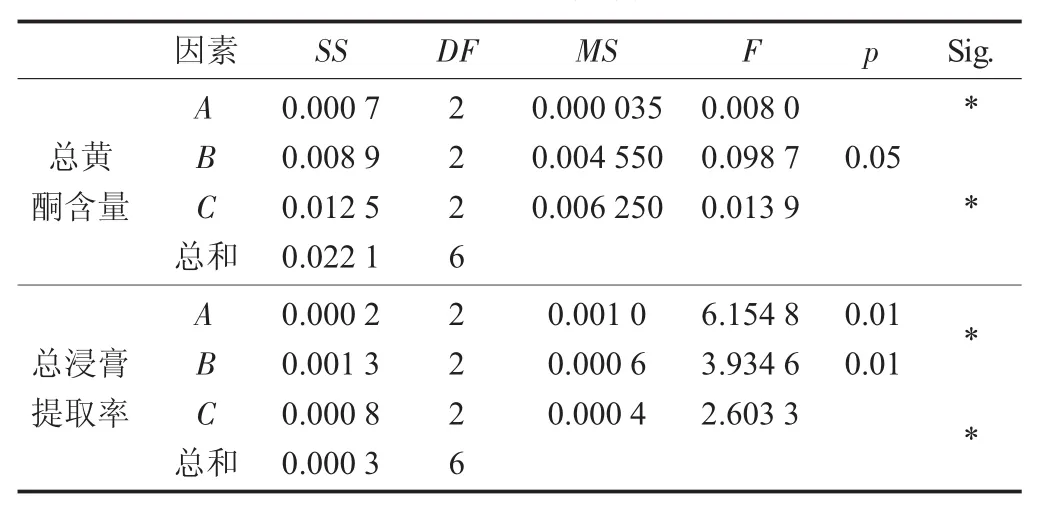
表3 方差分析
由表2和表3可知,影響陽荷乙醇提取物總黃酮含量的主次因素為C>B>A,即提取時間>乙醇體積分數>料液比,確定最佳提取工藝為A2B3C2,即乙醇體積分數70%,料液比1∶12,回流提取2 h。
2.2.2 浸膏得率的結果分析
如表2直觀分析表和表3方差分析所示,影響陽荷乙醇提取物浸膏得率的主次因素為C>B>A,即提取時間>乙醇體積分數>料液比,確定最佳提取工藝為A1B3C2,即乙醇體積分數60%,料液比1∶12,提取時間2 h。
綜合單因素考查結果和正交試驗結果,本著主要成分含量優先原則,最終確定陽荷乙醇提取物的最佳制備方案為乙醇體積分數70%,料液比1∶12,回流提取2 h。
2.3 驗證試驗
按上述正交試驗結果,用最佳提取工藝條件對陽荷進行3次提取。
陽荷乙醇提取物總黃酮含量分析見表4,陽荷乙醇提取物浸膏得率分析見表5。

表4 陽荷乙醇提取物總黃酮含量分析

表5 陽荷乙醇提取物浸膏得率分析
3 膠囊制備
根據前期研究獲得的陽荷乙醇提取物的最佳制備工藝制得陽荷乙醇提取物,按照膠囊劑制劑學要求,制備陽荷乙醇提取物硬膠囊[11]。
3.1 輔料的篩選
3.1.1 膠囊填充量的設計
根據前期研究確定的提取物最佳制備工藝結果顯示,陽荷乙醇提取物總黃酮含量為3.484 mg/g,浸膏得率19%左右,按3號膠囊每粒填充0.2 g計算,填充藥粉0.18 g,輔料0.02 g。
3.1.2 輔料的配置[12]
選用淀粉和糊精2種常用輔料,設計4個處方,按表5中的參數稱取提取物浸膏粉和輔料,均勻混合,過40目篩,置于真空干燥箱內恒質量48 h。
不同處方組成見表5。
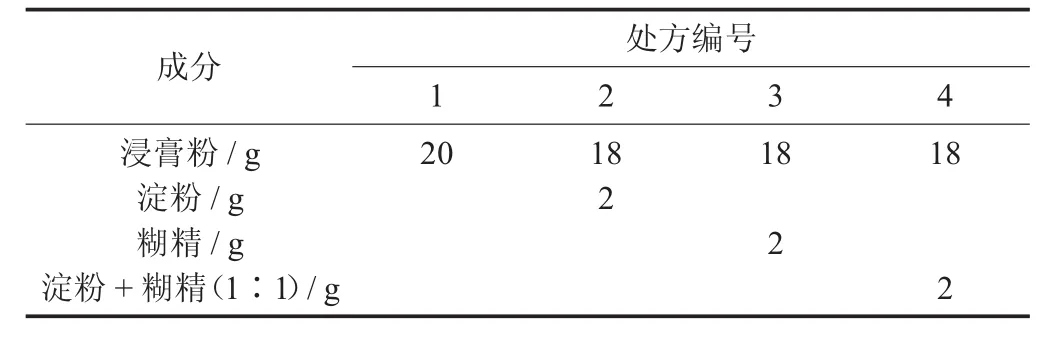
表5 不同處方組成
3.1.3 不同處方內容物的吸濕百分率
配置NaCl過飽和溶液,于玻璃干燥器中,置于25℃恒溫培養箱內,將干燥器內的相對濕度控制在75%,精密稱取內容物,放置于上述玻璃干燥器內,分別間隔12,24,48,72 h稱質量,計算吸濕百分率。
不同處方吸濕率見表6,不同處方吸濕率見圖5。
由圖5與表6可知,處方4即淀粉+糊精(1∶1)在各個時間點的吸濕百分率相對較小,擬選用淀粉和糊精1∶1混合作為輔料,可以有效降低浸膏粉的吸濕性。
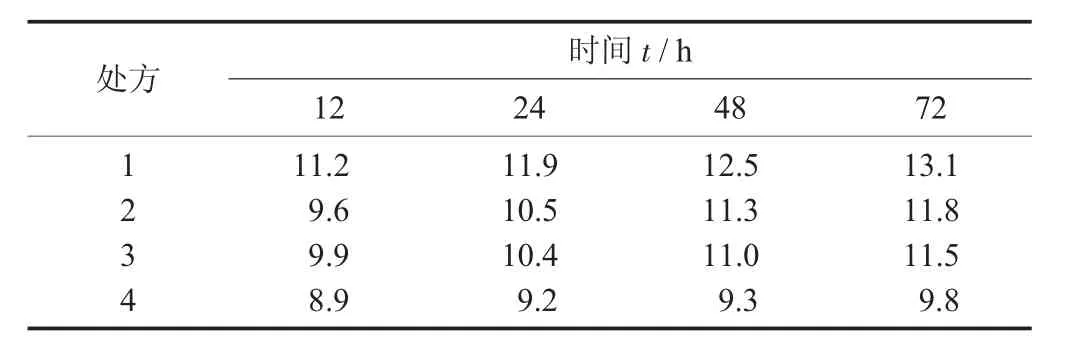
表6 不同處方吸濕率/%
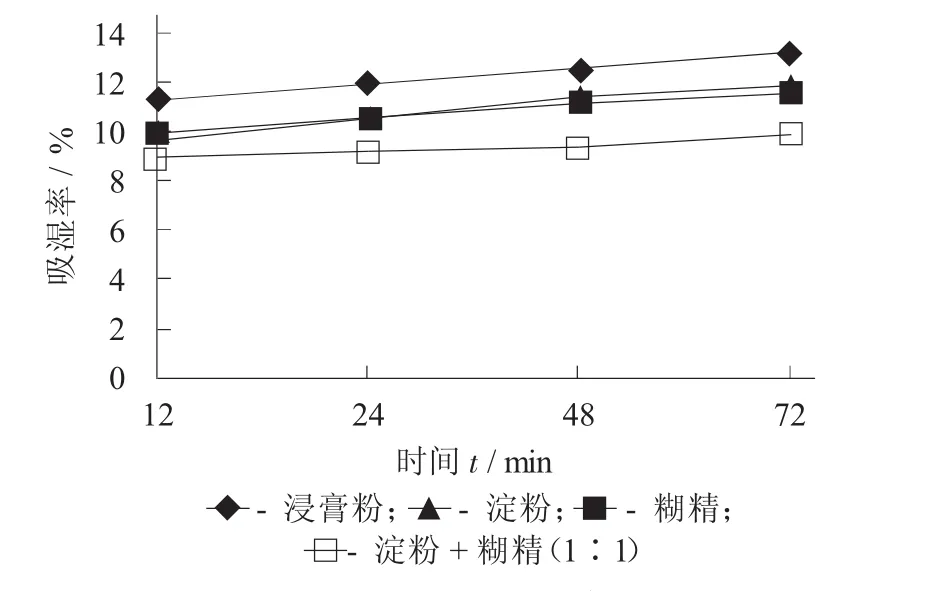
圖5 不同處方吸濕率
3.2 制粒及干燥
試驗采用濕法制粒,以顆粒成型性為考查指標,選用乙醇作為濕潤劑,對濕潤劑乙醇體積分數進行考查,可見濕潤劑用90%乙醇最好,將制得的濕粒于60℃下真空干燥,整粒,過40目篩。
乙醇體積分數的考查結果見表7。

表7 乙醇體積分數的考查結果
3.3 休止角的測定
采用固定漏斗法進行測定,將漏斗固定在水平放置的繪圖紙上方一定距離,漏斗下口距離繪圖紙的高度為H,將顆粒倒入漏斗中,直到漏斗下形成的圓錐體間斷接觸到漏斗的下口為止,圓錐體的直徑為2R,由tanα=H/R求得α。
休止角的測定見表8。

表8 休止角的測定
由表8可知,膠囊填充物的休止角為38.0°,表明該產品流動性較好,易于分裝。
3.4 陽荷乙醇提取物膠囊的質量檢測
膠囊劑的質量應符合藥典“制劑通則”項下對膠囊劑的要求,分別從外觀、水分、裝量差異、崩解時限4個方面評價膠囊質量[13]。
3.4.1 外觀
膠囊外觀整潔,沒有黏結、變形或破裂現象,并無異臭。硬膠囊劑的內容物干燥、松緊適度、混合均勻。
3.4.2 水分
采用真空干燥法測定硬膠囊內容物水分,準確稱取2.00~5.00 g樣品,烘干至恒質量的稱量皿,置真空烘箱,70℃、真空度93.3~98.6 kPa(700~740 mmHg),烘干5 h,待干燥皿冷卻,稱至恒質量,平行測試3組,含水量均低于9.0%,符合2015年版中國藥典的膠囊劑水分標準。
3.4.3 裝量差異
取供試膠囊20粒,分別精密稱定質量,脫帽,傾出內容物,用小刷搽拭干凈,分別精密稱量膠囊殼的質量,從而計算得出內容物的質量與平均質量,裝量差異限度為9%,符合2015年版中國藥典的膠囊劑裝量差異標準。
3.4.4 崩解時限
按2015年版中國藥典配置人工胃液,按2015年版中國藥典中的膠囊劑項下方法進行崩解時限檢查,硬膠囊在30 min內全部崩解,符合要求。
4 結論
試驗以陽荷浸膏得率和總黃酮含量為評價指標,通過單因素考查、正交試驗與方差分析,本著主要化學成分含量優先原則,優選得出陽荷乙醇提取物制備的最佳工藝為料液比1∶12,乙醇體積分數70%,回流提取2 h,得到陽荷乙醇提取物總黃酮的含量為3.484 mg/g。為進一步開展陽荷的深入研究與開發利用,將陽荷乙醇提取物制成硬膠囊,選用3號硬膠囊,由輔料吸濕率測定確定選用淀粉∶糊精=1∶1作為輔料,每粒膠囊填充0.2 g內容物,其中陽荷乙醇提取物0.18 g,0.02 g輔料,90%乙醇作為潤濕劑,濕法制粒,于60℃條件下真空干燥,整粒。經測定其顆粒休止角38.0°,流動性好,易于分裝。制備的膠囊質量檢測其外觀、水分、裝量差異、崩解時限均符合2015年版中國藥典對硬膠囊劑的要求。課題組前期研究發現陽荷乙醇提取物能明顯降低糖尿病試驗動物血糖,極具深入研究價值,試驗研究結果將為陽荷的深入研究與開發、充分發掘陽荷的藥用價值和資源利用提供參考依據。

