鹽酸川芎嗪對人肝癌細胞及外泌體蛋白GPC3的影響
劉振華,王 寧,李克躍,湯可立,石承先,丁 杰,王飛清
(1.貴州省人民醫院肝膽外科,貴陽 550002 ;2.貴州省骨科醫院藥劑科,貴陽 550004; 3.貴州省人民醫院胃腸外科,貴陽 550002;4.貴陽中醫學院附屬第一醫院檢驗科,貴陽 550001)
肝細胞癌(hepatocellular carcinoma,HCC)是肝癌最常見的類型,占80%~90%,是導致全球癌癥相關死亡的主要原因之一[1]。盡管在預防、篩查、診斷和治療手段等方面已經取得了一定進步,但是肝癌的發病率和病死率仍持續上升,且患者的5年生存率仍低于20%[2-3]。外泌體作為生物信息交換的物質運載體并通過遞送一系列生物分子(包括蛋白質,脂質和核酸)在調節細胞微環境中起重要作用。腫瘤細胞來源的外泌體參與了細胞間的信息溝通、腫瘤血管生成、腫瘤轉移及放化療抵抗的形成[4-6]。研究發現,外泌體蛋白磷脂酰肌醇蛋白聚糖-3(GPC3)是磷脂酰肌醇蛋白聚糖家族中的一員,通過磷脂酰肌醇錨定連接于細胞表面,與細胞的增殖、分化、黏附和遷移關系密切,與肝癌的侵襲、轉移相關,在肝癌組織及肝癌患者血清中異常表達[7-8]。川芎嗪(TMPH)是從中藥川芎中分離得到的有效單體成分,因其不良反應小等特點,臨床應用較為廣泛,具有一定的抗肝癌作用[9-11],然而其作用機制不完全清楚。本文探索川芎嗪對肝癌細胞外泌體中GPC3及肝癌細胞侵襲、遷移能力的影響,為臨床使用川芎嗪治療HCC提供依據。
1 材料與方法
1.1材料 人肝癌細胞系MHCC97-H、HepG2購于中國科學院上海生命科學院細胞庫,注射用鹽酸川芎嗪(TMPH,北京四環科寶制藥有限公司,批號14032015)用DMEM培養液溶解為1.0 mg/mL質量濃度,0.22 μm濾器除菌,臨用時配制。兔抗GPC3 (379-393aa)抗體為美國Bioworld Technology公司產品。
1.2方法
1.2.1細胞培養
1.2.1.1MHCC97-H、HepG2細胞的常規培養 肝癌細胞用高糖 DMEM 培養基+10%胎牛血清(FBS);置于 37 ℃,5% CO2培養箱中培養,2 d換培養液一次,待細胞密度達到 80%左右,即可進行后續實驗的處理。
1.2.1.2細胞間接共培養MHCC97-H、HepG2 高糖 DMEM 無血清培養基,上室接種5×104個/mL MHCC97-H,下室接種2.5×105個/mL HepG2,共培養72 h后,下室HepG2細胞用于后續的遷移、侵襲實驗。
1.2.2細胞劃痕實驗 待MHCC97-H、共培養細胞和HepG2細胞生長至最佳,1×105個/孔細胞接種于24孔板,次日長滿后,用20 μL的加樣槍頭輕輕劃一痕,新鮮不含血清培養基饑餓4 h后加入TMPH(1.0 mg/mL)處理各細胞系24 h。0、24 h測量劃痕寬度算出細胞遷移距離,并計算遷移率。
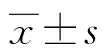
1.2.4Western blot檢測外泌體GPC3表達 制備各組細胞懸液, 以 2×107個/mL細胞數接種于 T75 培養瓶中,于 37 ℃、5% CO2培養箱中培養過夜;棄舊培養基,用磷酸鹽緩沖液(PBS)清洗2遍。加新鮮不含血清培養基,細胞饑餓4 h后加入TMPH處理各細胞系,放入37 ℃、5% CO2培養箱孵養24 h后收集細胞上清液,利用超速離心法提取上清液中的外泌體蛋白。二喹啉甲酸(BCA)蛋白樣品定量各組后,用上樣緩沖液進行樣品制備,上樣行12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,濕轉法轉印到PVDF膜上,甲醇浸泡后,室溫干燥固化膜上蛋白,再水化后用5%脫脂奶粉封閉,一抗4 ℃孵育過夜,TBST洗后用二抗室溫孵育2 h,進行化學發光顯色,化學發光及凝膠成像儀成像觀察GPC3水平。
1.3統計學處理 實驗數據采用SPSS 16.0統計軟件進行處理,多組間比較采用單因素方差分析,兩組間比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1GPC3蛋白在MHCC97-H、HepG2上清液中的表達 在兩種肝癌細胞培養上清液中均可檢測到GPC3,且與HepG2相比,MHCC97-H上清液中GPC3水平明顯較高(圖1A),差異有統計學意義(P<0.01,圖1B)。

A:Western blot檢測GPC3蛋白;B:GPC3半定量統計圖;C:Western blot檢測3組細胞GPC3蛋白量;D:3組細胞GPC3蛋白半定量統計圖;E:3組細胞劃痕比較;F:3組細胞遷移率統計圖;G:3組細胞侵襲能力比較;H:3線細胞侵襲A值統計圖;a:P<0.01,與HepG2比較;b:P<0.01,與對照組比較;“-”為對照組,“+” 為TMPH組
2.2TMPH處理各組細胞后上清液外泌體中GPC3的變化 共培養細胞HepG2上清液中外泌體蛋白GPC3較常規培養的HepG2明顯增高;3組細胞經TMPH處理24 h后(TMPH組),除HepG2組外,上清液中的外泌體蛋白GPC3均較未處理組(對照組)有明顯下降,差異均有統計意義(P<0.01,圖1C、D)。
2.3TMPH對常規培養肝癌細胞、共培養肝癌細胞遷移侵襲能力的影響 經TMPH處理24 h的MHCC97-H、HepG2-coculture遷移、侵襲能力明顯下降,其遷移率(圖1E、F)、穿膜細胞數A值(圖1G、H)與對照組比較,差異有統計學意義(P<0.01)。
3 討 論
HCC是一種高度惡性的腫瘤,其轉移與所處微環境關系密切。外泌體攜帶來源于腫瘤細胞的特異性生物標志物,其水平與腫瘤細胞侵襲能力和腫瘤微環境相關。由于外泌體的保護性脂質膜,其DNA、RNA和蛋白質不易降解,且外泌體可以從許多體液中獲得,使外泌體的檢測可能是“液體活檢”的理想方法[12]。研究發現,GPC3通過糖基-磷脂酰肌醇錨定與細胞膜結合,在培養肝癌細胞的培養基中可以檢測到GPC3蛋白[13]。本研究發現,與HepG2相比,MHCC97-H上清液外泌體中GPC3蛋白水平明顯增高,差異有統計學意義(P<0.05),經TMPH處理24 h后,GPC3水平明顯下降。
外泌體通過囊泡內容物傳遞信息,被認為是細胞間的第3種信號傳導機制[14]。在生理條件下,外泌體的內容物被供體細胞精確地調節并反映供體細胞的功能。為了在細胞之間交換和傳遞生物信息,供體細胞通過外泌體的“運輸”功能將遺傳物質轉移到靶細胞[15]。在病理條件下,病變細胞也可以將病毒、miRNA等內容轉移到正常細胞,使正常細胞感染導致細胞病變[16],或將癌基因轉移至正常細胞,導致腫瘤侵襲轉移[17]。本實驗發現,與高轉移能力肝癌細胞系MHCC97-H共培養的HepG2細胞,其侵襲、遷移能力明顯增強,經TMPH處理后明顯下降,差異有統計學意義。CAPURRO等[18]使用免疫組織化學和酶聯免疫吸附試驗(ELISA)檢測了HCC患者的GPC3蛋白表達和血清中GPC3水平,以及健康肝臟、肝炎和肝硬化患者血清中GPC3的水平,結果顯示HCC患者肝臟組織中GPC3表達水平增加,但在正常肝細胞中不表達。HCC患者血清中GPC3水平顯著升高,而在健康體檢者和肝炎患者血清中檢測不到[18]。表明肝癌細胞能夠自分泌相關信號物質進入血液循環,這可能是肝癌細胞發生血液轉移的前提。研究發現,GPC3通過增加自分泌/旁分泌激活經典Wnt信號刺激HCC細胞的體外和體內生長。免疫共沉淀實驗顯示,GPC3能夠與Wnt形成復合物,表明GPC3通過促進該多肽與其信號受體的相互作用來刺激Wnt活性[18]。這可能也是MHCC97-H細胞通過分泌GPC3促進HepG2侵襲、遷移能力增強的原因。
川芎中提取的純化學物質TMPH具有抗氧化、抗纖維化作用,能改變血液流變學、免疫抗腫瘤等功效。研究發現其通過誘導肝癌細胞的凋亡及自噬等發揮抑癌作用[9];也有研究表明TMPH直接殺傷腫瘤細胞、抑制血管生成[19],與調控TGF-β1/Smads通路[11]、調控Bax、Bcl-2基因的表達從而調控細胞的凋亡及增殖周期有關[20]。本研究結果表明,TMPH可通過下調外泌體中GPC3蛋白的表達水平,抑制肝癌細胞的侵襲遷移能力,表明其抑制肝癌的機制可能與改變腫瘤的微環境、降低外泌體中GPC3表達有關。
綜上所述,下調外泌體中GPC3蛋白改變腫瘤的微環境可能是TMPH抗肝癌機制之一。

