細胞微絲骨架在玉米抗紋枯病菌Rhizoctonia solani侵染中的作用
王偉 裴艷剛 王宇霜 孫霞 戴浩 龔國淑 常小麗
摘要
為探究細胞微絲骨架在玉米抗紋枯病侵染過程中的作用,采用微絲骨架解聚劑LatB預處理玉米離體葉片后接種立枯絲核菌Rhizoctonia solani AG1-IA,顯微觀察病原菌的侵染過程,并檢測活性氧(ROS)、細胞壞死及抗病基因(PR1、ZmDREB2A)表達等抗病反應情況。結果顯示,與未經LatB預處理相比,LatB預處理加快了R.solani侵染后玉米病斑的形成,并影響了侵染結構的發育;在侵染后期,LatB促進了R.solani誘導的玉米葉片中ROS積累、細胞壞死反應和PR1基因表達;溶劑DMSO預處理與未經LatB預處理的結果類似,表明DMSO對本試驗的影響較小。研究表明,細胞微絲骨架不僅參與玉米抗R.solani的侵入,而且通過調控ROS、PR1基因表達,細胞死亡等抗病信號提高玉米抗病防御能力。本研究為進一步研究細胞微絲骨架在玉米對紋枯病的抗病機理中的作用提供了重要參考。
關鍵詞
玉米; 立枯絲核菌; 細胞微絲骨架; 活性氧; 抗病基因
中圖分類號:
S 435.4
文獻標識碼: A
DOI: 10.16688/j.zwbh.2016252
Roles of actin filaments in defense against Rhizoctonia solani
causing banded leaf and sheath blight of maize
WANG Wei, PEI Yangang, WANG Yushuang, SUN Xia, DAI Hao, GONG Guoshu, CHANG Xiaoli
(College of Agriculture, Sichuan Agricultural University, Chengdu 611130, China)
Abstract
In order to find out the role of cellular actin filaments in maize resistance to Rhizoctonia solani causing banded leaf and sheath blight, detached maize leaves were pretreated with the actin filament depolarization, latrunculin B (LatB), before inoculation with R.solani AG1-IA, and then collected at different time points in this study. Disease development and pathogen infectious structures were observed through the microscope, and meanwhile, defense responses including ROS accumulation, cell death and defense gene expression (PR1 and ZmDREB2A) were also examined. The results showed that, compared to inoculation with R.solani alone, pretreatment with LatB led to an earlier disease lesions and development of infectious structures. Additionally, ROS accumulation, cell death and defense gene expression were much higher than that without LatB pretreatment. In addition, pretreatment with the solvent DMSO showed similar results to the control without LatB treatment, indicating that DMSO had little effect on the LatB treatment. These data demonstrated that cellular cytoskeletal actin filaments not only functioned on pathogen invasion, but also regulated ROS accumulation, PR1 expression and cell death, all of which worked together to suppress pathogen spread on maize leaves and enhance maize resistance. This study provides important information for further studies on the role of actin filaments in maize resistance.
Key words
maize; Rhizoctonia solani; cellular actin filaments; ROS; defense-related gene
玉米Zea mays L.是世界三大谷類作物之一,既作為主要的食、飼兼用作物,也是重要的工業及能源原料,對國家的糧食安全起著舉足輕重的作用[1]。玉米紋枯病(banded leaf and sheath blight,BLSB)是國內外玉米產區廣泛發生、且危害嚴重的土傳病害之一[2]。在我國,玉米紋枯病菌以立枯絲核菌Rhizoctonia solani Kühn融合菌群AG1-IA為優勢病原菌,其具有土傳性、寄主范圍廣、適應性強和高致病性等特點[3-4]。近年來,由于我國高投入、單一化大面積的玉米種植模式,導致玉米紋枯病發生日趨嚴重,成為我國各玉米產區的主要病害之一[1],嚴重影響玉米產量。選育和利用抗病玉米品種是防治玉米紋枯病最經濟、有效的途徑[2],然而,國內外關于玉米抗紋枯病機制有待深入研究。細胞微絲骨架(actin filaments)是植物細胞骨架的重要組成結構,其在生物體內行使多種生理功能,同時也參與植物抗病防御過程[5-6]。研究表明,細胞微絲骨架的動態變化參與了病原菌侵染點細胞壁乳突形成相關物質的運輸[6]、保衛細胞中K+離子通道的開閉[7]、NO誘導的氣孔關閉[8]、活性氧積累(ROS)、細胞壞死反應及抗病相關基因的表達等抗病防御相關反應[6]。目前,關于細胞微絲骨架在玉米抗紋枯病侵染過程中的作用機制研究較少。
本研究通過細胞微絲骨架解聚劑LatB預處理后接種玉米紋枯病致病菌立枯絲核菌R.solani AG1-IA,觀察玉米葉片病斑擴展及R.solani侵染結構發育情況,檢測葉片中活性氧(ROS)積累、細胞壞死及抗病基因(PR1、ZmDREB2A)表達等抗病防御反應情況,旨在初步探明細胞微絲骨架在玉米對紋枯病抗病過程中的作用,為玉米抗病育種及紋枯病防治提供一定的理論依據。
1 材料與方法
1.1 供試品種及菌株
供試玉米品種為‘登海605,購自山東登海種業股份有限公司,為常規品種,經抗性鑒定對紋枯病表現為中抗;立枯絲核菌Rhizoctonia solani Kühn融合群菌株AG1-IA由四川農業大學植物病理系實驗室提供。
1.2 試劑及儀器
主要試劑:微絲骨架解聚劑latrunculin B (LatB),購自Sigma-Aldrich公司;反轉錄試劑盒PrimeScriptTM RT Reagent Kit with gDNA Eraser購自寶生物工程(大連)有限公司;TRIzol總RNA提取試劑盒、Taq PCR Master Mix、DNA Marker、核酸染料等均購自天根生化科技有限公司;二氨基聯苯胺DAB(3,3-diaminobenzidine)、臺盼藍(Trypan Blue)、DMSO(二甲基亞砜)、瓊脂糖、考馬斯亮藍、甲醇、三氯乙醇、甘油及其余常規試劑購自成都博大泰克生物公司。引物合成由上海生工生物工程技術服務有限公司完成。
主要儀器:5424R型臺式高速冷凍離心機、Universal Hood II凝膠成像儀、C1000 PCR擴增儀,購自美國Bio-Rad公司;Nanodrop 2 000超微量分光光度計,購自美國Thermo Scientific公司;DYY-6C型凝膠電泳儀,購自北京六一儀器廠;Nikon Eclipse 80i顯微鏡購自日本Nikon公司;GXM型智能光照培養箱,購自寧波江南儀器廠,以上儀器均由四川農業大學植物病理實驗室提供。
1.3 試驗方法
1.3.1 玉米盆栽苗培育
將玉米種子用75%乙醇處理1 min,然后用0.1%的次氯酸鈉處理20 s,蒸餾水沖洗3~5 次,將消毒好的玉米種子置于培養皿中經無菌水浸潤滅菌濾紙上,于生長溫度22~28℃、相對濕度75%的恒溫箱中培養催芽,1 d后取出移栽于裝有滅菌基質土的直徑10 cm的花盆中,當玉米長至5~6片葉時進行接種處理。
1.3.2 病原菌活化及接種
將AG1-IA菌株接入馬鈴薯葡萄糖瓊脂平板培養基(PDA,馬鈴薯200 g,葡萄糖10 g,瓊脂10 g,水1 000 mL),置于25~28℃恒溫下擴大培養3 d,至長滿整個培養皿待用。
將玉米葉片剪成長4 cm、寬2 cm的葉段,置于墊有滅菌濾紙的培養皿中保濕。參照Henty-Ridilla等[9]的使用濃度,將微絲骨架解聚劑latrunculin B(LatB)先用DMSO(二甲基亞砜)配制成2 mol/L的母液,再用蒸餾水稀釋至2 mmol/L作為工作濃度,以確保DMSO濃度小于0.1%,不影響LatB的作用效果。采用無針頭注射器將20 μL LatB (2 mmol/L)注入玉米葉肉細胞中,30 min后接種AG1-IA菌餅于注射部位作為處理樣品,以注射等體積DMSO和滅菌蒸餾水后接種AG1-IA的葉片為對照,每個處理重復3次,試驗進行3次。接種后置于25℃保濕培養過夜,并于接種后不同時間點(0、6、12、24、48 h和72 h)收集材料,用于病原菌侵染結構觀察及抗病相關反應檢測。
1.3.3 玉米紋枯病菌侵染結構的觀察
于接種后不同時間點(0、6、12、24、48 h和72 h)取接種葉段材料,用脫色液(無水乙醇∶甘油∶無菌水,體積比為15∶1∶4)沸水浴脫色1 h至透明,然后用考馬斯亮藍染色液(0.15%三氯乙酸水溶液∶0.6%考馬斯亮藍R-250甲醇溶液,體積比1∶1)染色10 min,最后用自來水漂洗3~5次至染液洗凈。制片,并在顯微鏡(Nikon Eclipse 80i)下觀察病原菌侵染結構發育。
1.3.4 活性氧測定
活性氧(ROS)的檢測采用二氨基聯苯胺DAB(3,3-diaminobenzidine)染色法 [10]。取接種后不同時間段的玉米葉片,蒸餾水洗凈后置于15 mL離心管中,加入適量DAB染液(1 mg/mL,pH 5.8)至完全浸沒葉片,用真空抽濾泵抽濾5 min 后置于28℃避光保存8 h,隨后取出離心管光照1 h至紅棕色斑點顯現。棄掉各管染液,用無菌水漂洗3次洗去浮色,加入脫色液(無水乙醇∶甘油∶水,體積比15∶1∶4),沸水浴直至葉片綠色完全褪去,重復1次,重新加入脫色液,置于4℃冰箱內保存。拍照后,采用Image J軟件統計染色面積占總葉片面積的百分比,并在顯微鏡下觀察細胞ROS產生情況。
1.3.5 細胞壞死觀察
葉片細胞壞死采用臺盼藍染色法[10]進行檢測。取接種后不同時間段的玉米葉片,蒸餾水洗凈后置于培養皿中,加入適量臺盼藍染液(乳酸∶水飽和酚∶甘油∶1 mg/mL臺盼藍,體積比1∶1∶1∶1)至完全浸沒葉片,28℃下放置4 h。隨后取出葉片, 用無菌水漂洗3次,洗去浮色后放入15 mL離心管中,加入脫色液(無水乙醇∶甘油∶水,體積比15∶1∶4),并沸水浴直至葉片綠色完全褪去,棄掉各管液體重新加入脫色液,置于4℃冰箱內保存并拍照記錄,計算染色面積占葉片總面積的百分比,用以評價細胞壞死情況。
1.3.6 抗病相關基因表達檢測
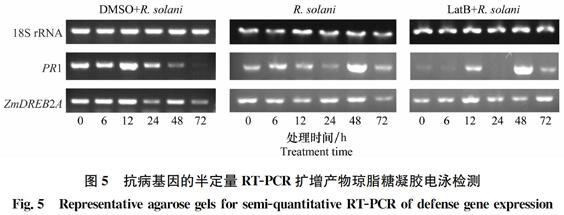
在接種后0、6、12、24、48和72 h后分別取處理葉片200 mg,無菌水洗凈,滅菌紙擦干后加入液氮進行研磨,參照TRIzol試劑盒操作手冊提取總RNA。用NanoDrop 2 000超微量分光光度計檢測RNA的質量。采用反轉錄試劑盒獲得cDNA,反應體系包括:1 μL Oligo dT18 Primer、10 μL 2×TS Reaction Mix、1 μL Fracs Script RT/RI Enzyme Mix、gRNA Remover,用RNase-free Water補足至20 μL,反應條件為:42℃,30 min;85℃,5 min;4℃,保存。反轉錄獲得的cDNA用ddH2O按1∶20(V/V)稀釋后待用。PCR擴增體系為:12.5 μL 2×Taq PCR Master Mix、9.5 μL 滅菌ddH2O、1 μL Primer F、1 μL Primer R、1 μL cDNA。引物序列分別為:18S rRNA (F: 5′-TCCTGAGTAACGAACGAGACC-3′和R:5′-CACGATGAAATTTCCCAAGAT-3′)[8],PR1 (F:5′-AGGCTCGCGTGCCTCCTAGCTCTGG-3′和R: 5′-GGAGTCGCGCCACACACCTGCGTG-3′)[8],ZmDREB2A (F: 5′-GTATCTTGATGAGCTGGGATTCGAG-3′和R:5′-GTGAAGCAAACCCAGTTCCC-3′)[11]。擴增條件為:94℃ 變性5 min;94℃變性30 s,58℃ 退火20 s,72℃延伸20 s,循環40次,72℃延伸5 min,4℃保持。PCR擴增產物通過2%瓊脂糖凝膠進行電泳檢測,并采用凝膠成像儀進行拍照。
1.3.7 統計分析
用SPSS 22.0進行數據分析,采用t測驗對經兩種不同接種處理的玉米葉片中ROS、細胞壞死反應、菌絲體量進行差異顯著性分析,顯著水平為5%,并使用Excel 2010軟件制圖。
2 結果與分析
2.1 LatB預處理對玉米葉片發病情況的影響
采用R.solani AG1-IA接種玉米離體葉片后觀察病斑擴展情況。結果如圖1所示,在接種后0~6 h,LatB預處理、DMSO溶劑處理以及未經預處理的玉米葉片均未出現病斑。LatB預處理30 min后接種的玉米葉片在接種菌后12 h開始出現水漬狀小病斑,且病斑處褪綠變黃;24~48 h時,病斑擴大且出現明顯壞死;72 h時,葉片上出現典型的紋枯病危害后的云紋狀壞死病斑。未預處理的玉米葉片在接種后24 h開始出現水漬狀小病斑;接菌后48 h時,出現不同程度的、較多的病斑;隨著病斑的擴展,72 h時玉米葉片均出現較為明顯的紋枯病水漬狀云紋病斑。與未預處理葉片相似,DMSO預處理后接種的玉米葉片在24 h開始出現零星水漬狀褪綠變黃斑,到48 h后病斑面積開始快速擴散,到72 h時葉片表面均勻出現云紋狀紋枯病典型癥狀。結果表明LatB預處理加快了玉米離體葉片上病斑的出現,加速了玉米對R.solani的抗性反應。
2.2 LatB預處理對紋枯病菌侵染結構的影響
采用考馬斯亮藍對接種后不同時間點病原菌侵染結構進行染色,結果如圖2所示。未經LatB預處理的葉片(圖2,1a~1f),在接種后6 h時,菌絲伸長,并出現初級分枝(圖2,1a);接種12 h時,在初級分枝上出現許多短粗狀的側枝(圖2,1b);隨后的24~48 h,側枝頂端膨大形成裂瓣狀的附著胞(圖2,1c),且附著胞下形成侵染釘可直接侵入寄主表皮細胞(圖2,1d),也可通過氣孔侵入(圖2,1e);接種72 h時,大量側枝及附著胞相互聚集在一起(圖2,1f)。溶劑DMSO預處理后接種病菌結果顯示,菌絲在接種后6 h不斷伸長(圖2,2a);12 h時菌絲產生初級分枝,并且從氣孔侵入玉米葉片(圖2,2b);接種24 h時,菌絲側枝頂端開始形成瓣狀附著胞(圖2,2c);接種48 h時,附著胞下產生侵入釘(圖2,2e),菌絲變粗變短,分枝間距縮短(圖2,2d);接種72 h時,大量附著胞開始串生或簇生在一起,形成巨大的瓣狀復合體(圖2,2f)。經LatB預處理30 min后接種病原菌6 h時,菌絲頂端開始膨大(圖2,3a);12 h時,出現初級分枝,且初級分枝頂端膨大呈球形(圖2,3b);接種24 h時,初級分枝上出現馬蹄型侵染墊,且能觀察到侵入釘侵染玉米表皮細胞(圖2,3c);接種48 h,菌絲體繼續分枝,大量馬蹄形侵染墊形成(圖2,3d),且在氣孔處聚集大量菌絲體(圖2,3e);72 h時,墊狀侵染結構及病原菌菌絲體均大量增加且聚集在一起(圖2,3f)。結果表明LatB預處理對R.solani AG1-IA侵染結構在玉米葉片上的發育有影響,有利于病原菌的迅速入侵。
圖1 不同接種處理后玉米葉片病斑擴展情況
Fig.1 Disease lesion development after inoculated by Rhizoctonia solani AG1-IA with or
without LatB pre-treatment on maize leaves
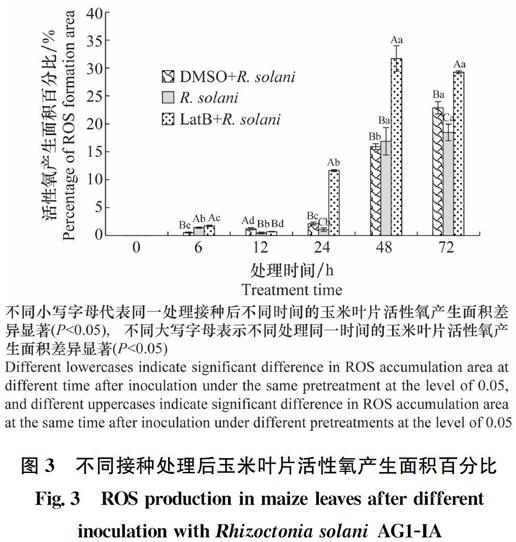
2.3 LatB預處理對接種后玉米葉片細胞內活性氧積累的影響
經LatB預處理,接種R.solani后不同時間點取玉米葉片用DAB染色,以DMSO預處理及未預處理作為對照,對ROS積累面積百分比進行統計,如圖3所示,接種后6 ~12 h ROS開始積累,LatB預處理與未處理的葉片ROS積累量相當;接種后24 h,ROS積累量開始逐漸增加,經LatB預處理的葉片中ROS積累量顯著高于未處理的葉片;接種后48 h,ROS積累量達到峰值,且經LatB預處理的葉片中的ROS積累量是未經LatB處理的2倍,隨后接種72 h后ROS積累量有所降低。隨著病原菌侵入,在24~72 h,在相同時間點經LatB預處理的葉片中ROS積累量始終顯著高于未經LatB處理的葉片;其中,在使用溶劑DMSO處理后,在0~24 h時,活性氧的積累量都很低,當處理48 h后,活性氧的積累量顯著快速增加,基本與未用LatB預處理的活性氧的積累量相同,但遠低于經過LatB預處理組(圖3)。結果表明細胞微絲骨架解聚劑LatB預處理可提高R.solani AG1-IA誘導的玉米葉片中ROS的積累量。
圖2 不同預處理后Rhizoctonia solani AG1-IA侵染結構顯微觀察
Fig.2 Microscopy observation of Rhizoctonia solani AG1-IA infectious structure after different pretreatments on maize leaves
圖3 不同接種處理后玉米葉片活性氧產生面積百分比
Fig.3 ROS production in maize leaves after different
inoculation with Rhizoctonia solani AG1-IA
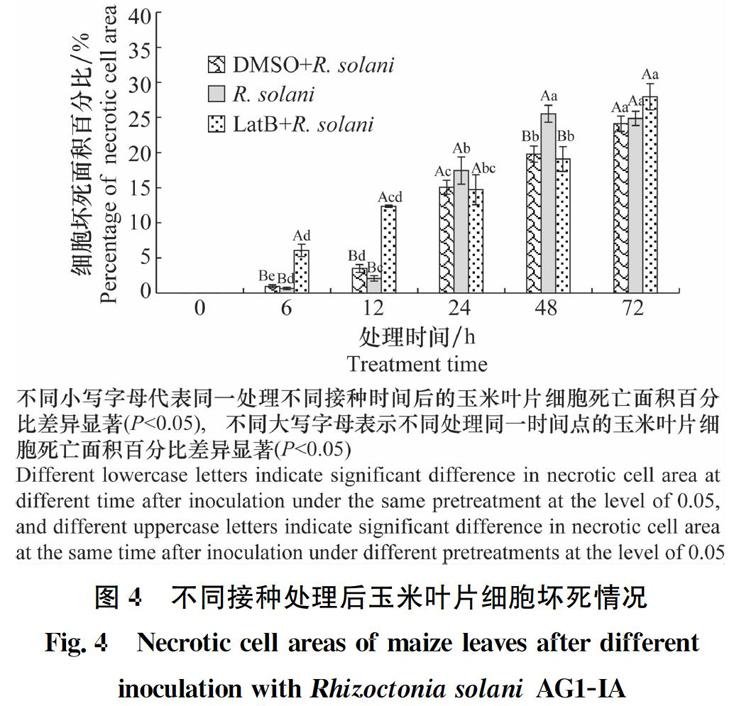
2.4 LatB預處理對接種后玉米葉片細胞壞死情況的影響
經LatB預處理,接種R.solani后不同時間點玉米葉片的細胞死亡情況采用臺盼藍染色法進行檢測,以DMSO預處理及未預處理作為對照,統計葉片壞死斑面積百分比,結果如圖4所示。在接種0 h時,各處理均無明顯細胞死亡出現;接種后6~12 h,三種處理均有細胞死亡產生,未處理與DMSO預處理細胞死亡差異不顯著,但LatB預處理的葉片細胞死亡面積顯著增加;接種后24~48 h,未處理和DMSO預處理玉米葉片藍色壞死斑開始大量出現,但在相同時間內其壞死斑面積較經LatB預處理略高;接種后72 h,各處理葉片經LatB預處理的葉片和未處理的葉片中細胞壞死面積相當。結果表明細胞微絲骨架解聚劑LatB處理后導致玉米葉片細胞微絲骨架解聚,在R.solani AG1-IA侵染前期,玉米葉片細胞大量死亡,以提高寄主的防御功能,減少自身受到損害。
2.5 LatB預處理對接種后玉米葉片抗病相關基因表達的影響
為了檢測LatB預處理對病原菌R.solani AG1-IA接種后玉米葉片抗病相關基因的表達情況,本試驗選擇了病程相關蛋白PR1和玉米轉錄因子ZmDREB2A兩個基因,以18S rRNA作為內參持家基因,采用半定量RT-PCR,在接種后不同時間點檢測其表達水平,結果如圖5所示:DMSO預處理、LatB預處理以及未經LatB預處理的玉米葉片中持家基因18S rRNA在接種后不同時間點的表達量基本相同,說明提取獲得的玉米葉片總RNA穩定。在LatB預處理30 min后接種R.solani的玉米葉片中,PR1在接種12 h被誘導表達,24 h被抑制,隨后48 h表達量最大,72 h表達量明顯降低;而在未經LatB預處理的玉米葉片中,PR1在接種后48 h表達量顯著增加,其他時間與0 h相比,變化不明顯。ZmDREB2A基因在兩種處理中的表達量在LatB預處理的玉米葉片中于接種后12 h有所升高,其他時間點變化不明顯,而在未經LatB預處理的玉米葉片以及使用溶劑DMSO預處理的玉米葉片中各時間點均無特別顯著變化。結果表明,細胞骨架解聚劑LatB預處理對轉錄因子ZmDREB2A的影響較小,但可強烈誘導水楊酸(SA)途徑相關的PR1基因表達,可能與SA參與到玉米抗紋枯病防御機制有關。
圖4 不同接種處理后玉米葉片細胞壞死情況
Fig.4 Necrotic cell areas of maize leaves after different
inoculation with Rhizoctonia solani AG1-IA
3 討論
植物在與病原菌長期共進化互作過程中形成了一套十分復雜、精密的防御機制,細胞微絲骨架作為細胞骨架的重要組成結構,在植物抵御病原菌侵染過程時常發生解聚與聚合,在病原菌侵入及擴展過程中均發揮了重要作用[6,12]。本試驗通過微絲骨架解聚劑預處理玉米葉片后接種紋枯病菌R.solani AG1-IA,對病原菌侵染結構發育情況及玉米抗病相關反應檢測,初步明確了細胞微絲骨架在玉米抗紋枯病菌侵染中的作用。
圖5 抗病基因的半定量RT-PCR擴增產物瓊脂糖凝膠電泳檢測
Fig.5 Representative agarose gels for semi-quantitative RT-PCR of defense gene expression
大量研究表明,細胞微絲骨架是植物抵御病原菌侵入的重要方式[12]。病原菌侵染后微絲骨架可在侵染點附近聚集,呈放射狀排列,參與寄主細胞質內抗病相關物質及蛋白運輸到病原菌侵染位點的過程[6]。Henty-Ridilla及其團隊研究表明,受丁香假單胞桿菌Pseudomonas syringae pv. tomato DC3000、農桿菌Agrobacterium tumefaciens和稻瘟病菌Magnaporthe grisea侵染1 h后均能觀察到細胞微絲骨架聚集。采用細胞松弛素或者微絲骨架解聚劑LatB處理則病原菌成功侵染[9,14-15]。最近研究發現,細胞微絲骨架參與了大豆對病毒病的抗性,微絲骨架解聚有利于大豆花葉病毒病的發生[16]。本試驗中,立枯絲核菌R.solani為兼性寄生菌,該菌常以侵染墊或裂片狀附著胞侵染寄主,或者不產生專門的侵染結構,而由菌絲頂端直接穿透植物表面或從自然孔口(主要是氣孔)及傷口侵入。本試驗采用細胞微絲骨架解聚劑LatB處理離體玉米葉片30 min后接種R.solani,觀察到病原菌菌絲分枝后迅速形成馬蹄狀侵染墊,并發育成侵入釘直接穿透表皮細胞完成侵入(圖2,3c),在接種后6~12 h迅速出現病斑;而在未經LatB預處理的玉米葉片上,R.solani菌絲則出現較多側枝后才形成短粗分瓣狀的附著胞及侵入釘,或者延伸至氣孔處進行侵入(圖2,1c),在接種后24 h出現病斑(圖4),表明細胞微絲骨架參與了寄主抵抗病原菌侵入的過程,LatB預處理導致微絲骨架解聚,破壞了依賴于微絲骨架的玉米葉片抗侵入結構,而有利于病原菌的菌絲快速發育成馬蹄狀侵染墊,其與多分支的裂瓣狀附著胞相比能更迅速侵入寄主,并建立寄生關系。這一結果從Marshall等[17]的試驗也得到證實,即紋枯病菌在水稻感病品種葉鞘表面形成大量的侵染墊,而抗病品種上則不形成侵染墊,只形成裂瓣狀的附著胞。
已有研究發現,細胞微絲骨架不僅對侵染點附近原生質凝集和乳突積累有影響,還參與調控植物的抗病防御反應,如活性氧(ROS)積累、細胞死亡及抗病基因的表達[18-20]。采用微絲骨架解聚劑cytochalasin A處理后發現,白粉菌誘導的黃瓜葉片中過敏性細胞壞死、H2O2的產生及乳突的形成均明顯受抑,表明微絲骨架解聚可促進小麥白粉菌的侵染[14,21]。采用細胞松弛素D處理,能夠顯著降低小麥-白粉菌互作[22]、小麥-葉銹病菌互作[23]、馬鈴薯-晚疫病菌互作[24]中寄主葉片細胞壞死的產生。與前人研究結果不同,本試驗中,LatB預處理后接種病原菌,ROS在接種后24 h大量積累,推測可能與微絲骨架解聚能夠誘導寄主抗病信號有關,從而抑制病原菌的擴展。此外,本試驗還發現,LatB預處理提高R.solani 誘導的水楊酸抗病信號相關的PR1基因大量表達,表明在玉米紋枯病抗病反應中,細胞微絲骨架的作用與水楊酸途徑有關,這一結果與Matouková等[25]的研究結果相似。
此外,本試驗為排除溶劑DMSO對細胞微絲骨架解聚劑LatB效果的影響,補充設置了溶劑DMSO預處理對照,結果表明,DMSO預處理后接種R.solani 的玉米葉片上菌絲及其他侵染結構發育、葉片活性氧的積累量、細胞壞死以及抗病相關基因與未經LatB預處理組結果相似,表明溶劑DMSO在本次試驗中對試驗結果的影響可以忽略。
綜上,本試驗通過組織細胞染色法及抗病基因表達檢測,初步明確了細胞微絲骨架可影響病原菌在玉米葉片上的發育及侵入過程,也參與了玉米抗病防御相關的ROS、細胞死亡及抗病基因表達水平,這為深入研究玉米對紋枯病抗病機理奠定了一定基礎。然而,玉米紋枯病作為一種世界性的玉米病害難題,由于R.solani在室內人工培養條件下很難產孢,因此試驗采用菌餅接種法,可能導致對病原菌侵染結構發育的觀察較實際情況晚。此外,本研究采用細胞微絲骨架解聚劑間接研究了其在玉米紋枯病抗病機制中的作用。為了更清楚直觀地觀察R.solani接種后玉米葉片微絲骨架結構的動態變化,目前本課題組正嘗試通過免疫熒光蛋白標記紋枯病菌和細胞微絲骨架,從而實現激光共聚焦顯微鏡實時觀察紋枯病菌與玉米互作過程中微絲骨架的動態變化。
參考文獻
[1] 鄒軍順, 李新果, 馬文峰. 中國玉米種植產業發展現狀分析及政策建議[J]. 糧食科技與經濟, 2014, 39 (1): 13-15.
[2] 唐海濤, 榮廷昭, 楊俊品, 等. 玉米紋枯病研究進展[J]. 玉米科學, 2004, 12(1): 93-96.
[3] 陳文生. 玉米紋枯病抗性資源篩選及抗性QTL元分析[D]. 成都: 四川農業大學, 2013.
[4] 肖炎農, 李建生, 鄭用連, 等. 湖北省玉米紋枯病病原絲核菌的種類和致病性[J]. 菌物系統, 2002, 21(3): 419-424.
[5] SCHMIDT S M, PANSTRUGA R.Cytoskeleton functions in plant-microbe interactions [J]. Physiological and Molecular Plant Pathology, 2007, 71: 135-148.
[6] PORTER K, DAY B. From filaments to function: the role of the plant actin cytoskeleton in pathogen perception, signalling and immunity [J]. Journal of Integrative Plant Biology, 2016, 58(4):299-311.
[7] 張永梅,吳忠義,王學臣,等.擬南芥保衛細胞微管骨架的重排參與NO誘導的氣孔關閉[J].科學通報,2008,53(3):293-298.
[8] CHIMTAMANANI S, HULBERT S H, JOHAL G S, et al. Identification of a maize locus that modulates the hypersensitive defense response, using mutant-assisted gene identification and characterization [J]. Genetics, 2010, 184: 813-825.
[9] HENTY-RIDILLA J L, LI J, DAY B, et al. The plant actin cytoskeleton responds to signals from microbe-associated molecular patterns [J/OL]. PLoS Pathogens, 2013, 9(4): e1003290.
[10] 龍書生, 曹遠林, 李亞玲, 等. 小麥抗條銹病過敏性壞死反應中的活性氧代謝[J]. 西北農林科技大學學報(自然科學版), 2009, 37(11) : 125-130.
[11] NGUYEN H T, LEIPNER J, STAMP P, et al. Low temperature stress in maize (Zea mays L.) induces genes involved in photosynthesis and signal transduction as studied by suppression subtractive hybridization [J]. Plant Physiology and Biochemistry, 2009, 47: 116-122.
[12] SCHMELZER E. Cell polarization, a crucial process in fungal defence [J]. Trends in Plant Science, 2002, 7(9): 411-415.
[13] HENTY-RIDILLA J L, LI J, DAY B, et al. ACTIN DEPOLYMERIZING FACTOR4 regulates actin dynamics during innate immune signaling in Arabidopsis [J]. Plant Cell, 2014, 26: 340-352.
[14] 郝心愿,李紅莉,禹坷,等.微絲骨架解聚劑在小麥-黃瓜白粉菌非寄主互作中的作用[J].中國農業科學,2011,44(2):291-298.
[15] JAROSCH B, COLLINS N C, ZELLERHOFF N, et al. RAR1, ROR1, and the actin cytoskeleton contribute to basal resistance to Magnaporthe grisea in barley [J]. Molecular Plant-Microbe Interactions, 2005, 18 (5): 397-404.
[16] LU Lu, WU Guanwei, XU Xiaoming, et al. Soybean actin-depolymerizing factor 2 interacts with soybean mosaic virus encoded P3 protein [J]. Virus Genes, 2015,50(2): 333-339.
[17] MARSHALL D S, RUSHM C. Infection cushion formation on rice sheaths by Rhizoctonia solani [J].Phytopathology, 1980, 70: 947-950.
[18] KOBAYASHI Y, KOBAYASHI I. Depolymerization of the actin cytoskeleton induces defense responses in tobacco plants [J]. Journal of General Plant Pathology, 2007, 73(5): 360-364.
[19] CHANG Xiaoli, RIEMANN M, LIU Qiong, et al. Actin as deathly switch? How auxin can suppress cell-death related defence [J/OL]. PLoS ONE, 2015, 10(5): e0125498.
[20] THORDAL-CHRISTENSEN H, ZHANG Ziguo, WEI Yangdou, et al. Subcellular localization of H2O2 in plants. H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction [J]. The Plant Journal, 1997, 11(6): 1187-1194.
[21] 郝重朝. 微絲骨架在黃瓜對小麥白粉菌非寄主抗性中作用的組織化學研究[D].楊凌: 西北農林科技大學, 2013.
[22] KOBAYASHI I, KOBAYASHI Y, YAMAOKA N, et al. Recognition of a pathogen and a nonpathogen by barley coleoptile cells. III. Responses of microtubules and actin filaments in barley coleoptile cells to penetration attempts [J]. Canadian Journal of Botany,1992, 70(9): 1815-1823.
[23] 侯春燕, 王冬梅, 李小娟, 等. 細胞骨架解聚藥物對小麥與葉銹菌互作誘發的細胞過敏性反應的影響[J]. 植物病理學報, 2002, 32 (2): 147-152.
[24] TOMIYAMA K, SATO K, DOKE N, et al. Effect of cytochalasin B and colchicine on hypersensitive death of potato cells infected by incompatible race of Phytophthora infestans[J]. Annals of the Phytopathological Society of Japan, 1982, 48 (2): 228-230.
[25] MATOUKOV J, JANDA M, FIER R, et al. Changes in actin dynamics are involved in salicylic acid signaling pathway [J]. Plant Disease, 2014, 223: 36-44.
(責任編輯: 楊明麗)

