川芎平喘合劑對(duì)COPD相關(guān)肺動(dòng)脈高壓大鼠NO、ET-1的影響*
郭曉燕,錢家驊,徐向前,范春香,張惠勇
上海中醫(yī)藥大學(xué)附屬龍華醫(yī)院肺病科,上海 200032
肺動(dòng)脈高壓(pulmonary artery hypertension,PAH)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的重要并發(fā)癥,是COPD發(fā)展至慢性肺源性心臟病的重要病理生理過(guò)程,肺動(dòng)脈壓(PAP)持續(xù)升高,可致右心負(fù)荷增加,最終發(fā)生右心衰竭,是影響COPD患者疾病進(jìn)程的獨(dú)立危險(xiǎn)因素[1]。近年研究顯示,COPD肺組織缺氧,肺血管功能受損,在內(nèi)皮細(xì)胞合成、分泌的一氧化氮(NO)、內(nèi)皮素1(ET-1)失衡,導(dǎo)致肺血管收縮增強(qiáng)、舒張減弱,引起PAH。本研究擬通過(guò)建立COPD相關(guān)肺動(dòng)脈高壓模型,探討川芎平喘合劑對(duì)大鼠肺動(dòng)脈壓的作用及對(duì)NO、ET-1的影響,揭示川芎平喘合劑的作用機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物 健康SD大鼠60只,清潔級(jí),體質(zhì)量(200±20)g,購(gòu)自上海斯萊克動(dòng)物實(shí)驗(yàn)中心,飼養(yǎng)于上海中醫(yī)藥大學(xué)動(dòng)物實(shí)驗(yàn)中心,實(shí)驗(yàn)動(dòng)物合格證號(hào):SCXK(滬)2014-008。所有大鼠在同一動(dòng)物房中飼養(yǎng),溫度(25±l)℃,濕度28%的環(huán)境中適應(yīng)性飼養(yǎng)1周后進(jìn)行實(shí)驗(yàn)。
1.2 實(shí)驗(yàn)藥物 川芎平喘合劑,藥物組成:川芎12 g,赤芍18 g,白芍 18 g,當(dāng)歸 9 g,丹參 9 g,黃荊子9 g,胡頹葉 18 g,細(xì)辛 5 g,辛夷 5 g,生甘草6 g,取上述藥物制成液體制劑,其終濃度為每毫升含生藥量為1.526 g(1.526 g/mL),由上海中醫(yī)藥大學(xué)附屬龍華醫(yī)院制劑室提供。將川芎平喘合劑根據(jù)成人日服劑量,通過(guò)公式 D1∶D2=R1∶R2,按動(dòng)物體表面積比率換算等效劑量,其中D:劑量,R:體表面積。計(jì)算出大鼠日服量:9.81 g/(kg·d)。鹽酸法舒地爾注射液(天津紅日藥業(yè)有限公司規(guī)格,2 mL∶30 mg)。
1.3 主要試劑與儀器 自制有機(jī)玻璃煙薰箱(60cm×40 cm×80 cm);中南海牌香煙(焦油含量10 mg/支);氣體濃度檢測(cè)儀(河南中安電子探測(cè)技術(shù)有限公司);RM6240型多道生理信號(hào)采集系統(tǒng)(成都儀器廠);酶標(biāo)儀(DENLEY DRAGON Wellscan MK 3,Thermo);電熱恒溫培養(yǎng)箱(上海躍進(jìn)醫(yī)療器械廠);離心機(jī)型號(hào)(上海安亭科學(xué)儀器廠);電熱恒溫鼓風(fēng)干燥箱(上海精宏實(shí)驗(yàn)設(shè)備有限公司);ET-1 ELISA試劑盒(美國(guó)Phoenix);NO酶法試劑盒(北京四正柏生物科技有限公司)。
1.4 模型制備 參照許滸、蔣明等[2-3]復(fù)制COPD相關(guān)肺動(dòng)脈高壓動(dòng)物模型。采用煙熏聯(lián)合脂多糖復(fù)制COPD模型,將大鼠放入自制有機(jī)玻璃艙,第1、14 天氣道內(nèi)注入脂多糖(LPS)200 μg,每天艙內(nèi)煙熏4次共2小時(shí)(15支/次,30 min/次,第1、14天除外),連續(xù)6周,從第5周開(kāi)始,艙內(nèi)煙熏同時(shí)疊加每天吸入18%低氧8小時(shí),每周6天,連續(xù)2周。
1.5 分組與給藥 將SD大鼠按隨機(jī)數(shù)字表法隨機(jī)分為4組,分別為:對(duì)照組、模型組、川芎平喘合劑組、法舒地爾組,每組15只。各組均從第7周即造模成功后給予藥物治療,川芎平喘合劑組給予川芎平喘合劑9.81 g/(kg·d)灌胃,法舒地爾30 mg/(kg·d)腹腔注射,對(duì)照組和模型組給予等量生理鹽水灌胃,1次/d,持續(xù)2周。
1.6 觀察指標(biāo)
1.6.1 肺動(dòng)脈壓 參照孫波等[4]檢測(cè)方法,行
右心導(dǎo)管術(shù)測(cè)大鼠肺動(dòng)脈壓。用3%戊巴比妥鈉麻醉大鼠,頸部正中作長(zhǎng)約1.5 cm的縱行切口,并游離右頸外靜脈約1 cm,結(jié)扎,剪口,用一充盈肝素溶液的聚乙烯管經(jīng)頸靜脈緩慢插管至右心房、右心室及肺動(dòng)脈,導(dǎo)管另一端連接壓力傳感器至Medlab生物信號(hào)采集系統(tǒng),根據(jù)壓力波形確定導(dǎo)管位置,記錄平均肺動(dòng)脈壓力(mPAP)。
1.6.2 右心指數(shù) 測(cè)定肺動(dòng)脈壓力結(jié)束后,立即完整取出心臟和肺臟,分離右心室(RV)、左心室加室間隔(LV+S),并依次稱重,計(jì)算右心肥大指數(shù)(RVHI)=RV/(LV+S)。
1.6.3 NO、ET-1 各組大鼠肺動(dòng)脈壓力測(cè)定結(jié)束,腹主動(dòng)脈取血5 mL,3 000 r/min離心15分鐘,取上清液-80℃保存。采用硝酸還原酶法測(cè)定NO,酶聯(lián)免疫吸附法測(cè)定ET-1。
1.7 統(tǒng)計(jì)學(xué)方法 采用SPSS 17.0軟件分析數(shù)據(jù),計(jì)量資料以(±s)表示,符合正態(tài)分布采用單因素方差分析,不符合正態(tài)分布則采用非參數(shù)檢驗(yàn),檢驗(yàn)水準(zhǔn)為α=0.05。
2 結(jié)果
2.1 平均肺動(dòng)脈壓 模型組mPAP高于對(duì)照組(P<0.05),法舒地爾、川芎平喘合劑組mPAP均較模型組下降(P<0.05),川芎平喘合劑組與法舒地爾組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見(jiàn)表1。
表1 各組大鼠平均肺動(dòng)脈壓比較(±s) mmHg

表1 各組大鼠平均肺動(dòng)脈壓比較(±s) mmHg
注:與對(duì)照組相比*表示P<0.05,**表示P<0.01;與模型組相比,#表示P<0.05
組別 只數(shù) 平均肺動(dòng)脈壓對(duì)照組 15 25.05±2.74模型組 15 33.08±3.32**川芎平喘合劑組 15 29.67±2.42*#法舒地爾組 15 29.18±2.37*#
2.2 右心指數(shù) 模型組、川芎平喘合劑組大鼠RVHI高于對(duì)照組,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),川芎平喘合劑組、法舒地爾組大鼠右心指數(shù)與模型組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),川芎平喘合劑組與法舒地爾組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見(jiàn)表 2。
表2 各組大鼠右心指數(shù)比較(±s)
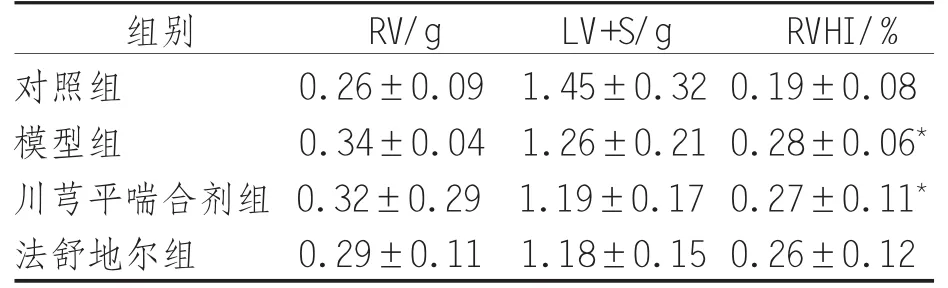
表2 各組大鼠右心指數(shù)比較(±s)
注:與對(duì)照組比較,*P<0.05,** 表示 P<0.01
RV/g LV+S/g RVHI組別/%對(duì)照組 0.26±0.09 1.45±0.32 0.19±0.08模型組 0.34±0.04 1.26±0.21 0.28±0.06*川芎平喘合劑組 0.32±0.29 1.19±0.17 0.27±0.11*法舒地爾組 0.29±0.11 1.18±0.15 0.26±0.12
2.3 NO、ET-1水平 與對(duì)照組比較,模型組大鼠NO水平降低,ET-1水平升高(P<0.05)。川芎平喘合劑組、法舒地爾組均較模型組NO升高,ET-1水平降低,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),川芎平喘合劑組與法舒地爾組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見(jiàn)表 3。
表3 各組大鼠NO、ET-1水平比較(±s)

表3 各組大鼠NO、ET-1水平比較(±s)
組別 NO/(μmol·mL-1) ET-1/(pg·mL-1)對(duì)照組 66.65±8.25 132.62±26.00模型組 33.89±5.57** 251.06±41.25**川芎平喘合劑組 47.56±10.08## 216.04±24.00##法舒地爾組 43.67±9.33# 214.70±28.64#
注:與對(duì)照組比較,**P<0.05,** 表示P<0.01;與模型組比較,#表示P<0.05,##P<0.01
3 討論
根據(jù)COPD相關(guān)PAH、肺心病的臨床表現(xiàn),多將其歸于“咳嗽”“肺脹”“喘證”等范疇。早期病變首先在肺,因肺臟反復(fù)受邪,外邪侵襲,肺失宣降,宣降失司,氣機(jī)阻閉,痰濁內(nèi)蘊(yùn),壅阻氣道,肺氣上逆而致咳嗽、咯痰、喘息、胸悶等不適,后期久咳久喘致喘悸不寧,心氣、心陽(yáng)虛衰,心脈瘀阻,則肺病及心。早期以痰濁為主,漸而痰瘀互見(jiàn),終至痰濁、血瘀錯(cuò)雜為患,痰瘀阻肺是發(fā)病的主要病理機(jī)制。
川芎平喘合劑由全國(guó)名老中醫(yī)邵長(zhǎng)榮教授結(jié)合多年臨床經(jīng)驗(yàn)研制,具有活血化瘀、止咳平喘等作用。本研究結(jié)果表明,模型組大鼠肺動(dòng)脈壓升高,右心指數(shù)升高,川芎平喘合劑組、法舒地爾組肺動(dòng)脈壓較模型組下降,右心指數(shù)有下降趨勢(shì),表明川芎平喘合劑能降低COPD相關(guān)PAH大鼠肺動(dòng)脈壓力。現(xiàn)代研究顯示,川芎有效成分川芎嗪能夠恢復(fù)動(dòng)態(tài)平衡,并將血管的通透性降低,改善缺氧狀態(tài),保護(hù)肺血管[5];赤、白芍成分芍藥苷具有抗凝血、擴(kuò)血管作用[6];胡頹子葉乙酸乙酯、正丁醇提取物有鎮(zhèn)咳、平喘、祛痰作用[7];當(dāng)歸對(duì)PAH有作用,并可降低右室肥厚[8]。NO是體內(nèi)發(fā)現(xiàn)的第一個(gè)氣體信號(hào)分子,是由內(nèi)皮細(xì)胞產(chǎn)生、分泌的血管舒張因子,與可溶性鳥(niǎo)苷酸環(huán)化酶結(jié)合,提高cGMP水平,舒張肺血管,抑制平滑肌收縮,降低肺動(dòng)脈壓力,維持肺循環(huán)穩(wěn)定[9]。適量的NO能舒張血管,抑制平滑肌細(xì)胞增殖,當(dāng)過(guò)量表達(dá)時(shí),可與Hb結(jié)合形成亞硝酸巰基醇化合物,損傷肺組織細(xì)胞,導(dǎo)致PAH升高[10]。合并PAH的COPD患者肺動(dòng)脈內(nèi)源性NO產(chǎn)生減少,NO水平降低,使生長(zhǎng)因子表達(dá)增加,促進(jìn)肺血管細(xì)胞增生,表現(xiàn)為肺動(dòng)脈內(nèi)膜增厚、中層肥厚,肺血管收縮[11],是PAH產(chǎn)生的重要因素。Mealy MA等[12]研究證實(shí),NO吸入療法能迅速降低PAH,但是對(duì)于NO吸入治療濃度尚缺乏統(tǒng)一標(biāo)準(zhǔn)。適量濃度吸入NO可降低新生兒PAH,對(duì)患者凝血機(jī)制無(wú)明顯影響。ET-1由血管內(nèi)皮細(xì)胞合成、分泌,分泌增加可持續(xù)收縮血管,促進(jìn)肺血管平滑肌增殖,是PAH發(fā)病的關(guān)鍵物質(zhì)[13]。COPD合并PAH的患者呼出氣中冷凝液和(或)血循環(huán)中ET-1水平升高,而且呼出氣冷凝液或動(dòng)脈中ET-1濃度與肺動(dòng)脈收縮壓或平均壓顯著相關(guān)[14]。陳建麗等[15]研究顯示,COPD合并PAH患者血清ET-1高于正常組及無(wú)PAH的COPD患者,且ET-1與肺動(dòng)脈壓呈正相關(guān),提示ET-1在COPD繼發(fā)性PAH形成機(jī)制中起重要作用。同時(shí),PAH刺激ET-1生成增多,清除減少,ET-1促進(jìn)PAH的形成和發(fā)展,二者相互影響,互為因果。本研究結(jié)果表明NO與ET-1在COPD相關(guān)PAH發(fā)病中具有顯著作用,川芎平喘合劑組可降低COPD相關(guān)PAH中ET-1水平,升高NO水平,調(diào)節(jié)肺動(dòng)脈血管的舒張與收縮,降低肺動(dòng)脈壓力。

