聯合檢測AML1-ETO及其9a異構體在微小殘留白血病監測中的意義
何飛 ,潘曉芬 ,陳永昌 ,梁昌達 ,易麗君 ,李紅
(1、江西省兒童醫院,江西 南昌 330000;2、江西省兒科研究所中心實驗室,江西 南昌 330000;3、江西省全南縣人民醫院,江西全南341800)
急性 髓系 白 血 病 (acute myeloid leukemia,AML)是造血系統的髓系原始細胞克隆性惡性增殖性疾病,是一個具有高度異質性的疾病群,它由正常髓系細胞分化發育過程中不同階段的造血祖細胞惡性變轉化[1]。白血病的病因和發病機制非常復雜,盡管目前研究已經明確部分可能因素,但其病因仍未被完全闡明。多數研究表明白血病是環境因素與細胞遺傳物質相互作用形成各種染色體易位或融合基因所致。t(8;21)(q22;q22)是急性髓系白血病最常見的非隨機染色體易位,約40%~50%的AML1-M2(FAB分型)存在此種染色體易位[2]。染色體易位(8;21)合成的融合蛋白AML-ETO作為白血病發展的起始致癌基因,在白血病的發生發展中起了重要的作用,并且AE融合蛋白存在多個轉錄本[3],其中AE9a的致白血病作用最明顯[4]。隨著長期存活率的提高,如何提前預測復發成為白血病治療策略改變的一個發展方向,微小殘留病的監測是最常用的方法之一,研究表明[5]約87%伴有t(8;21)的AML-M2患者中AE融合基因與AE9a異構體共表達,據此,本文通過建立相對定量的方法,監測46例患者多次隨訪標本中AE及AE9a相對量的變化,探討聯合監測AE及AE9a在微小殘留白血病(MRD)監測中可能存在的臨床意義。
1 資料與方法
1.1 病例來源 46份ETO基因陽性骨髓標本采自2010年6月至2014年6月江西省兒童醫院血液科住院及門診患者,發病時一般情況:87%患兒(40例)有反復發熱;12例患兒初診時外周血白細胞數大于50×109/l;36例患兒骨髓幼稚細胞比例大于50%,10 例患兒比例為 20%~50%。診斷標準[6]:1.臨床癥狀、體征:發熱、蒼白、乏力、出血、骨關節疼痛及肝脾淋巴結腫大等浸潤灶表現;2.血象改變:血紅蛋白及紅細胞降低,血小板減少,白細胞增高、正常或減低,分類可發現數量不等的原、幼粒(或幼單)細胞或未見原、幼粒(或幼單)細胞;3.骨髓形態學改變:是確診的主要依據,骨髓涂片中有核細胞大多呈明顯增生或極度增生,僅少數呈增生低下,均以髓細胞增生為主,原粒+早幼粒(或原單+幼單)細胞必須≥20%才能確診為AML;4.ETO融合基因陽性。化療方案采用2006化療方案[6],39例第一療程獲得緩解,7例第二療程獲得緩解。46例患兒隨訪3年未復發25例,3年內復發21例。標本檢測時間為初診時、誘導化療結束時、隨訪每6個月檢測1次以及復發時,隨訪時間為3年。
1.2 試劑與儀器 RT-PCR擴增試劑為大連寶生物工程公司產品;實時定量PCR擴增試劑為ABI公司產品;RT-PCR及實時定量PCR引物和TaqMan探針均由金瑞斯生物科技有限公司合成;RT-PCR擴增儀為美國ABI公司ABI7500;實時定量PCR擴增儀為MJ Research公司產品;電泳儀為Bio-Bad公司產品;紫外透視分析儀為Bio-CAPTver鄄sion99(VLIBERLOURMAT)。
1.3 RT-PCR 收集46例患兒各個監測點的骨髓標本,用Ficoll液分離骨髓MNC,用Trizol一步法及氯仿.異丙醇提取總 RNA,調濃度至 0.5ug/ul,取4ul并逆轉成cDNA40u1
1.4 定性PCR及實時定量PCR檢測AE9a和AE表達水平 擴增 (包括9a外顯子)的AMLl-ETO(1530bp)長片段,將定性RT-PCR擴增AE長片段所獲得的PCR產物作為模板進行實時定量PCR檢測,并在此基礎上設計特異性引物和TaqMan探針。PCR體系和擴增條件按說明書執行。
1.5 內參基因為 Abl,其中 Abl引物及探針、AML1-ETO和9a異構體的引物及探針序列選擇歐洲公布的抗癌項目序列。每例標本的每個基因均做復孔檢測,通過標本Ct值依據標準曲線計算出標準中Abl、AE及AE9a拷貝數。計算AE和AE9a表達水平(%)=拷貝數/Abl拷貝數×100%。
1.7 統計學處理 采用SPSS 13.0統計分析軟件進行統計學分析,采用配對t檢驗及四格表χ2檢驗。
2 結果
2.1 AML1-ET09a異構體檢測結果 在46例確診伴有t(8;21)的AML-M2患者的骨髓標本中有 41例檢測到AE9a異構體,占89.13%。21例復發患者均檢測到AE9a異構體。
2.2 初診時 AE、AE9a的表達 41例 AE及 AE9a均陽性患者,21例復發,20例未復發,兩組患者AE及AE9a表達水平差異較大,但復發組平均表達水平高于未復發組,并且兩組對比AE9a比AE高的更明顯(P<0.01),見表 1、圖 1。
2.3 初治后AE、AE9a的表達 46例患者經首次標準方案化療后AE表達水平較初診時明顯下降,但復發組下降的百分比低于未復發組,差異有統計學意義 (P<0.05);41例AE9a陽性患者化療后表達水平也明顯下降,同樣復發組下降的百分比低于未復發組,差異有統計學意義(P<0.05);比較復發組AE、AE9a化療前后的變化發現,AE下降的水平明顯高于 AE9a(P<0.01)。 見圖 2。

表1 41例AE、AE9a表達陽性患者誘導化療前后表達水平(拷貝數/Abl拷貝數×100%)的變化
2.4 復發患者AE、AE9a表達水平的變化 21例復發患者復發時AE與AE9a表達水平均上升。66.7%(21例中14例)的患者在AE融合基因表達水平升高以及最終的形態學復發之前,AE9a已開始出現升高,甚至異常升高,而此時AE融合基因的表達處于較低水平。其余7例患者中5例AE9a表達水平升高與AE融合基因升高同步,并未提前;2例患者自發病至復發AE9a表達持續在較高水平,AE表達亦持續在較高水平,并且這2例在鞏固治療期間即復發。復發組AE及AE9a基因轉陰時間似乎比未復發組更晚,是不是提示轉陰時間與復發相關,但由于隨訪監測為6個月1次,對比無統計學意義。

圖1 復發組與未復發組治療前比較
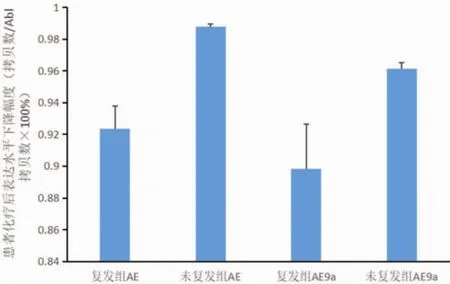
圖2 化療后復發及未復發組AE和AE9a下降幅度比較
3 討論
急性髓系白血病常常伴有多種類型的基因突變或融合基因[7],AML1-ETO 作為 t(8;21)AML 典型的融合基因,既往用于微小殘留白血病的監測[8],但近期研究發現AE融合基因存在于部分正常人和非白血病細胞系及伴有t(8;21)AML獲得緩解的患者骨髓細胞中可持續低表達,因而單獨檢測AE并不能很好的預測白血病復發[9];表明AE融合基因單獨并不能引起白血病的發生,需獲得額外的突變才能轉化為白血病[10]。Wolford[3]通過對t(8;21)患者骨髓樣本進行RT-PCR檢測,證明存在多種AMLl-ETO轉錄本,AE9a是其中一種最常見的;Yan等[11]通過建立動物模型研究AE及其異構體AE9a的致白血病作用,發現AE9a與白血病發生的關系較AE更緊密,這就讓我們思考是否可利用監測AE和AE9a來達到監測微小殘留病的目的。
本研究中,89.13%(41/46)確診伴有 t(8;21)的AML-M2患者中檢測到AE9a異構體的表達,證實了AE9a異構體與AE融合基因具有高度相關性,提示作為MRD監測指標的可行性。初診患者經1個療程標準方案化療后,AE與AE9a的表達水平均有所下降,特別在未復發組患者中兩者的表達水平下降較明顯,但在復發組AE下降的水平明顯高于 AE9a(P<0.01),表明 AE9a 表達水平下降幅度較AE低,至此我們推測高表達AE9a異構體的白血病細胞對化療的敏感性較低表達AE9a的白血病細胞差,可能在疾病的發生及進展中占更加重要的地位。這與李林萌[12]研究結果一致,AE9a異構體可能在疾病發生及進展中發揮比AE更重要的作用。
是否可以單獨監測AE9a來預測白血病復發呢?DeKelver RC[13]以及 Wang Z[14]報道中指出,AE9a基因總的表達水平較低,拷貝數與內參基因對比,常常低于10-4,在目前實驗方法不能精確到10-6或更低級別情況下不宜單獨作為監測指標。Link KA[15]發現AE可使長期培養的人臍帶血CD34+細胞不出現凋亡現象,但如果僅僅有9a轉錄本似乎存在缺陷,AE和AE9a的共轉導導致了表達細胞的選擇性生長。本實驗中,緩解期間66.7%(14/21)確診伴有 t(8;21)的 AML-M2 患者在AE水平升高以及最終的形態學復發之前,AE9a表達水平已開始出現升高,而此時AE融合基因拷貝數處于較低水平。其余7例患者中4例AE9a百分比升高與AE融合基因升高同步,并未提前,可能與隨訪時間點比較少有關;2例自發病至復發,AE融合基因及AE9a百分比持續在較高水平。另外緩解期間,AE9a在復發組中表達水平高于非復發患者,說明AE9a在白血病中長期存在很可能是AML復發的重要影響因素,在白血病復發中發揮重要作用。本研究由于復發病例數較少,并且隨訪時間點為6個月,所以并不能說明AE9a比AE更好的作為MRD的監測指標,增加入組病例以及增加隨訪時間點,應該能得到更好的答案。
總之,在緩解期聯合檢測AE及AE9a表達水平的變化,作為微小殘留病的監測,可能比單獨監測AE融合基因能更早預測疾病的發展,從而可提前進行臨床干預,降低患者的復發率,提高患者的長期生存率。

