醬香型白酒耐乳酸酵母的篩選及特性研究
王 莉,陳良強,楊 帆,陳宗校,王和玉
(貴州茅臺酒股份有限公司 技術中心,貴州 仁懷 564500)
酵母菌是白酒釀造過程中重要的一類微生物,不僅是推動發酵進程的主導力量之一,同時代謝產生的揮發性風味化合物也是影響白酒風格和品質的重要因素[1-4]。在醬香型白酒釀造過程中,酵母菌經堆積發酵過程得到大量的富集與繁殖,然后進入窖內參與厭氧發酵過程[5-6]。
由于醬香型白酒釀造工藝輪次多、周期長,在窖內厭氧發酵過程中,乳酸菌等產酸微生物代謝產生大量的酸類物質,使酒醅中難揮發性酸類物質不斷積累。乳酸作為酒醅中主要的酸類物質,在中后期輪次酒醅中乳酸含量達到20~40 g/kg酒醅[7]。一般情況下,過高的乳酸會使微生物細胞內外質子和陰離子對細胞膜、核糖體核糖核酸(ribonucleic acid,RNA)和脫氧核糖核酸(deoxyribonucleic acid,DNA)、活性酶類產生破壞作用,進而影響其生長和代謝過程[8-9]。但長期處于醬香型白酒這樣酸性釀造環境的脅迫和馴化下,一些釀造微生物已經具有較強的抗逆特性,從而保障了后期輪次發酵的正常進行[10-12]。文獻報道傳統發酵食品中部分酵母菌對弱酸具有較強的耐受性,如釀酒酵母(Saccharomyces cerevisiae)可在1%的乙酸條件下生長[13-14],拜氏接合酵母(Zygosaccharomyces bailii)對乙酸、乳酸、山梨酸等都具有較高的耐受性[15-16],然而對醬香型白酒釀造過程中耐乳酸酵母的種類及特性的相關研究還較少。
本研究以醬香型白酒發酵酒醅為實驗對象,篩選一株具有高乳酸耐受性的酵母菌,并比較該菌株與模式菌株ATCC6258及用于白酒釀造菌株CICC1926對乳酸和乙酸的耐受特性。最后,初步解析該菌株在不同乳酸含量條件下產揮發性風味物質的代謝特征。該研究不僅有助于加深對醬香型白酒釀造機制的認識和理解,同時也為耐酸酵母的篩選提供了較好的參考價值,為酵母高乳酸耐受性機理的研究奠定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
醬香型白酒發酵酒醅:貴州茅臺酒股份有限公司制酒車間。
1.1.2 菌株
庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)、庫德里阿茲威氏畢赤酵母模式菌株ATCC6258、用于白酒釀造庫德里阿茲威氏畢赤酵母CICC1926:中國工業微生物菌種保藏管理中心(ChinaCenterofIndustrialCultureCollection,CICC)。
1.1.3 主要試劑
酵母基因組提取試劑盒:日本TaKaRa公司;其他所需試劑均為分析純,均購買自國藥集團化學試劑有限公司。
1.1.4 培養基
富集培養基:乳酸40 g/L,葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10g/L,磷酸氫二鉀2g/L,氯化鈉1g/L,硫酸鎂0.1g/L,硫酸錳0.05 g/L。
篩選培養基:乳酸40 g/L,葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10 g/L。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液態培養基:葡萄糖20g/L,蛋白胨20g/L,酵母膏10g/L。YPD液態培養基中添加瓊脂20 g/L即為YPD固態培養基。
含5%葡萄糖YPD液態培養基:葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10 g/L。
上述培養基pH自然,115℃滅菌15~20 min。
1.2 儀器與設備
Multiskan FC全自動酶標儀:美國Thermo公司;CX23光學顯微鏡:日本Olympus公司;c1000觸摸屏(雙模塊)聚合酶鏈式反應(polymerase chain reaction,PCR)儀、Gel Doc XR+凝膠成像系統:美國Bio-Rad公司;7890A-5975C氣相色譜質譜聯用儀(gas chromatography-mass spectrometer,GC-MS):美國Agilent公司。
1.3 方法
1.3.1 耐乳酸特性菌株的篩選
稱取樣品10g于90mL帶玻璃珠的無菌水中,振蕩均勻,吸取0.1 mL上清液于100 mL富集培養基中,分別在有氧/無氧、30℃/37℃條件下靜置培養2~4 d,觀察培養液是否渾濁;若培養液已明顯渾濁時,吸取0.1 mL富集培養液于新的100mL液態篩選培養基中30℃靜置培養2 d,培養3~4次后將培養液梯度稀釋于YPD固體培養基上,培養3~4 d后,其單菌落即為抗乳酸特性的目標菌株。
1.3.2 菌株的鑒定
菌株形態觀察:將篩選得到的耐乳酸特性菌株接種于YPD固體培養基上,30℃培養4 d,觀察菌落形態;同時在顯微鏡下觀察菌種細胞形態。
分子生物學鑒定:采用試劑盒法提取基因組[17],以其為模板對目標菌株的26S rDNA D1/D2區基因序列進行PCR擴增。測序引物為NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)。PCR擴增體系(25 μL):Taq-Mix酶12 μL,引物NL1和引物NL4各1 μL,模板1 μL,ddH2O 10 μL。PCR擴增程序:94 ℃預變性5min;94℃變性30s,55℃退火30s,72℃延伸1 min,循環30次;72℃再延伸10 min。PCR擴增產物經1%瓊脂糖凝膠檢驗合格后送往生工生物工程(上海)股份有限公司進行測序。將26SrDNAD1/D2區測序結果上傳至美國國立生物技術信息中心(national center for biotechnology infor mation,NCBI)數據庫中進行BLAST比對,下載同源性高的菌株的基因序列,采用Clustal X進行序列比對分析,再利用MEGA6.0軟件中的鄰接法(neighbor joining,NJ)構建系統進化樹。
1.3.3 菌株生長曲線的測定
種子液制備方法:利用YPD固態培養基對各酵母菌株進行劃線活化,30℃培養2 d,然后利用接種環挑選平板上單菌落接種于裝液量為50 mL/250 mL的YPD液態培養基中,30℃、180 r/min條件下培養12 h。
將目標菌株、模式菌株ATCC6258和用于白酒釀造庫德里阿茲威氏畢赤酵母CICC1926的種子液分別接入含有5%葡萄糖的YPD液體培養基中,接種后液體培養基中初始細胞數量約為106CFU/mL,30℃靜置培養,每隔8 h取樣測定其OD600nm值。
1.3.4 菌株耐受性研究
乳酸耐受性:將目標菌株MT-Y01、菌株ATCC6258和CICC1926的種子液分別接種于含不同質量濃度乳酸(0、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L)的YPD液體培養基中,接種后液體培養基中初始細胞數量約為106CFU/mL,30℃靜置培養4 d后測定其OD600nm值。
乙酸耐受性:將目標菌株MT-Y01、菌株ATCC6258和CICC1926的種子液分別接種于含不同質量濃度乙酸(0、5 g/L、10 g/L、15 g/L、20 g/L)的YPD液體培養基中,接種后液體培養基中初始細胞數量約為106CFU/mL,30℃靜置培養4 d后測定其OD600nm值。
1.3.5 揮發性風味物質分析
將目標菌株的種子液接種于含有5%葡萄糖的YPD液體培養基中,接種后液體培養基中初始細胞數量約為106CFU/mL,同時在培養基中添加不同質量濃度的乳酸(0、20 g/L、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L),30 ℃靜置發酵4 d。
發酵結束后,將發酵液8 000×g離心10 min,取上清液10 mL裝于頂空進樣瓶中,并加入3 g氯化鈉。通過頂空固相微萃取技術(head-space solid phase microextraction,HS-SPME)進行萃取,再利用氣相色譜質譜聯用儀(GC-MS)進樣分析。氣相色譜分離條件:柱溫初始溫度為60℃,以6℃/min的升溫速率升至230℃,保持15min;柱流量1.6mL/min,采用恒壓模式;進樣口溫度230℃。質譜條件:電子電離電壓為70 eV;四極桿溫度150℃;離子源溫度230℃;采用全掃描方式(scan),使用35~550 amu的質量范圍,溶劑延遲5 min。將未知物質圖譜與美國國家標準與技術研究院(NationalInstitute ofStandardsandTechnology,NIST)08a.L Datebase中標準圖譜進行比對,進行定性分析。采用面積歸一法確定相對含量。
1.3.6 數據處理
將得到的揮發性風味物質峰面積進行歸一化處理后,然后利用R語言的pheatmap程序包進行熱圖制作。
2 結果與分析
2.1 菌株的篩選分離與鑒定
為模擬發酵實際環境,將酒醅樣品稀釋后直接接入液態富集培養基,然后置于不同條件下進行培養,培養結束時,觀察發酵液是否渾濁,從而判斷是否有菌株生長,結果見表1。

表1 不同培養條件下菌株的生長情況Table 1 Growth situation of strains under different culture conditions
由表1可知,酒醅樣品在含有40 g/L的乳酸液態培養基中生長良好,其中有氧條件下生長最為旺盛。初步表明酒醅中存在耐乳酸特性的菌株。為進一步確認,對30℃有氧條件下培養的發酵液進行多次傳代培養,以確定其微生物具有穩定的乳酸耐受能力。傳代富集培養3~4代后,對富集培養液稀釋涂布,分離得到單菌落,其菌落及細胞形態結果見圖1。

圖1 酒醅樣品中菌株在YPD培養基上的菌落形態(a)與細胞形態(b)Fig.1 Colonial morphology(a)and cell morphology(b)of strain from fermented grains samples on the YPD medium
通過多次的富集培養,培養基中的微生物種類大大減少,由圖1可知,所有菌落形態一致,菌落呈白色,表面粗糙,質地均勻,易挑取。通過顯微鏡觀察形態結果發現分離篩選得到的菌種細胞呈橢圓狀,部分正在出芽分裂。因此,初步確定分離得到的菌株為酵母菌。
從該平板中隨機挑選7個單菌落,菌株編號分別為MTY01~MT-Y07。7株菌株的測序結果經BLAST比對發現,該7株菌均與庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)NRRL Y-5396的26S rDNA基因序列相似度為99%。選取同源性較高的菌株構建系統發育樹,結果見圖2。

圖2 7株菌株基于26S rDNA D1/D2區域序列構建的系統發育樹Fig.2 Phylogenetic tree of 7 strains based on 26S rDNA D1/D2 sequences analysis
由圖2可知,7株酵母菌與庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)NRRL Y-5396聚于一支,結合形態觀察結果,確定7株酵母菌均為庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)。因此,挑選編號為MT-Y01的酵母菌作為代表菌株進行研究。菌株MT-Y01現已保藏于中國普通微生物菌種保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),編號為CGMCC 14068。
2.2 菌株MT-Y01的菌落形態
為研究不同環境對庫德里阿茲威氏畢赤酵母形態特性的影響,對菌株MT-Y01、ATCC6258和CICC1926的菌落形態進行對比,菌落形態結果見圖3。
由圖3可知,3株菌株雖然都屬于同一種酵母,但形態差別明顯。其中菌株MT-Y01和CICC1926的菌落均為白色、圓形,表面呈粉狀,但菌株MT-Y01的菌落周圍有圓環。來源于人的口腔中模式菌株ATCC6258的菌落形態與其他兩株差異較大,分析原因可能是由于環境不同造成的,菌株MT-Y01和CICC1926都來源于白酒釀造過程,因此兩者菌落形態較為相似,但由于不同香型白酒釀造工藝、環境的不同,從而也造成這兩株菌之間的菌落形態仍有一定的差別。

圖3 菌株MT-Y01(a)、ATCC6258(b)、CICC1926(c)在YPD培養基的菌落形態特征Fig.3 Colonial morphological characteristics of strain MT-Y01(a),ATCC6258(b)and CICC1926(c)on the YPD medium
2.3 菌株MT-Y01的生長特性
分別將3株酵母接入含有5%葡萄糖的YPD液態培養基中,30℃靜置培養,測得不同時間發酵液中菌體濃度,繪制其生長曲線,結果見圖4。

圖4 菌株MT-Y01、ATCC6258和CICC1926在含有5%葡萄糖YPD液態培養基中的生長曲線Fig.4 Growth curves of strain MT-Y01,ATCC6258 and CICC1926 in YPD liquid medium containing glucose 5%
由圖4可知,菌株MT-Y01生長速率最快,模式菌株ATCC6258生長慢,且菌體濃度最高OD600nm值<26;而來源于白酒釀造過程中的CICC1926生長速率和菌體濃度略低于菌株MT-Y01。結果表明,在白酒釀造環境過程中馴化的菌株生長速率更快,特別是在醬香型白酒釀造過程中高溫高酸等環境脅迫條件下,菌株具有更好的適應性和繁殖能力。
2.4 菌株MT-Y01的酸耐受性分析
2.4.1 乳酸耐受性能研究
將菌株MT-Y01和ATCC6258、CICC1926分別接入含有不同質量濃度乳酸的YPD液態培養基中,30℃靜置培養4d,培養結束后測定培養液中菌株的OD600nm值,結果見圖5。
由圖5可知,3株酵母菌都具有較強的乳酸耐受特性,且當乳酸含量為40 g/L時,菌體的OD600nm值最高,在35.0~36.3之間,表明該種類的酵母菌均具有一定的乳酸耐受性。但菌株MT-Y01有極強的乳酸耐受性能,在乳酸含量為100~120 g/L的條件下仍可生長,而其他兩株菌在乳酸含量為60g/L條件下生長非常緩慢,在80g/L的條件下已不能生長。

圖5 不同乳酸含量下酵母菌株的生長情況Fig.5 Growth situation of yeasts with different lactic acid contents
2.4.2 乙酸耐受性能研究
將菌株MT-Y01和ATCC6258、CICC1926分別接入含有不同質量濃度乙酸的液態培養基中,30℃靜置培養4 d,培養結束后測定培養液中菌株OD600nm值,結果見圖6。

圖6 不同乙酸含量下酵母菌株的生長情況Fig.6 Growth situation of yeasts with different acetic acid contents
由圖6可知,3株酵母菌對乙酸的耐受性較弱,當乙酸含量>30g/L之后,所有菌株都不能生長,但與菌株ATCC6258和CICC1926相比,菌株MT-Y01在乙酸含量為20 g/L的條件下仍有一定的生長。
醬香型白酒獨特的發酵環境長期對釀酒微生物進行馴化,促成了釀酒微生態環境中豐富的抗高溫、抗高酸和抗高乙醇等特性的極端微生物的富集。與模式菌株ATCC6258和來源于其他白酒釀造環境的CICC1926相比,菌株MT-Y01在生長速率、乳酸耐受性及其乙酸耐受性方面都具有更強的特性。
2.5 揮發性風味物質的分析
菌株MT-Y01在不同質量濃度的乳酸條件進行發酵,揮發性風味物質的分析結果見圖7。從2.4.1節可知,菌株MT-Y01在不同乳酸質量濃度條件下生長有所差異,同樣其代謝活動和代謝產物也可能發生改變。同時在醬香型白酒制酒過程中,其酒醅中的乳酸含量也在不斷發生變化,下沙堆積時,酒醅中乳酸含量<10g/kg酒醅,中后期則升高至40g/kg酒醅。因此,對菌株MT-Y01在不同乳酸質量濃度條件下的代謝產物進行了研究,結果見圖7。
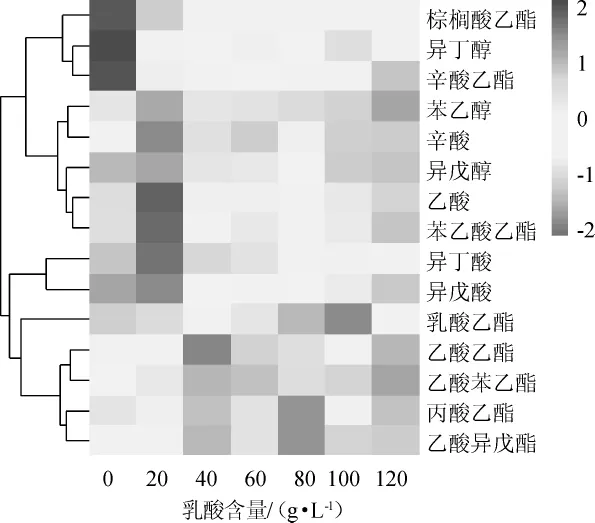
圖7 菌株MT-Y01在不同乳酸含量下所產風味化合物的變化熱圖Fig.7 Heat map of flavor compounds changes produced by strain MT-Y01 with different lactic acid contents
由圖7可知,菌株MT-Y01在不同的乳酸含量條件下主要代謝產生了15種揮發性化合物,這些物質都是醬香型白酒中重要的風味化合物,包括4種酸類、3種醇類和8種酯類。其中酯類物質的種類和含量分別占全部風味物質種類和含量的50%以上,這表明該酵母菌酯類物質代謝生成能力強,是一株醬香型白酒釀造過程中重要的產酯酵母菌。不同乳酸含量條件下,菌株MT-Y01代謝能力差別明顯,當乳酸質量濃度為40 g/L時,其產酯能力最強;當乳酸質量濃度為120 g/L時,菌株MT-Y01的產酯能力受到嚴重抑制。表明該菌株可在0~100 g/L的乳酸含量條件下產酯,但不同酯類物質在不同乳酸含量條件下產量差異大,如乙酸乙酯在乳酸含量為40 g/L時產量最高,占總風味物質峰面積的47.1%,丙酸乙酯在乳酸含量為80 g/L時產量最高,占總風味物質峰面積的4.3%,而辛酸乙酯在不含乳酸時產量最高,占總風味物質峰面積的1.9%。
3 結論
醬香型白酒釀造工藝獨特,是在高溫、高酸等極端環境條件下進行發酵。本研究利用多次傳代篩選的方式,從醬香型白酒酒醅中分離得到了一株高乳酸耐受性的庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii),該菌株有一定乙酸耐受性,最高可耐受120 g/L的乳酸。菌株在0~120 g/L的乳酸含量條件下,可代謝重要的風味物質,當乳酸含量為40 g/L時,其產酯種類多、能力強,特別是乙酸乙酯、丙酸乙酯、乙酸異戊酯和乙酸苯乙酯含量高,該結果表明此菌株是一株乳酸耐受能力強的產酯酵母菌,是醬香型白酒釀造過程中重要的功能菌之一。

