甲殼素對葡萄園土壤微生物群落組成的影響
李芬,董書甲,趙攀,趙新節,何熹
(齊魯工業大學山東省微生物工程重點實驗室,山東濟南 250353)
甲殼素,又名幾丁質,是一類天然多糖類高分子化合物,具有很好的生物安全性、生物相容性和生物可降解性,被廣泛應用到醫藥、食品、農業、保健品、化妝品和紡織等眾多領域之中[1]。作為土壤改良劑,甲殼素含有豐富的碳和氮元素,使得甲殼素被微生物分解利用后可以用它來作為植物生長的養分,使得土壤中的微生物體系得到改善[2]。
土壤微生物是土壤生態系統中最活躍的成員,能夠利用有機質作為營養及能量來源,與土壤酶共同參與土壤各種化學反應和生物化學過程,其生物量及數量分布可以敏感地反映土壤環境質量的變化[3]。土壤微生物對植株的生長有良好的促進作用[4-7]。趙春燕等發現,添加甲殼素的土壤中自生固氮細菌、纖維分解細菌、乳酸細菌和放線菌等有益菌數量顯著增加,酵母菌數量略有增加,而常見的霉菌和其它絲狀真菌的數量明顯減少[8]。尹秀蓮等[9]通過對甲殼素及其衍生物的研究發現,甲殼素低聚糖對革蘭氏陽性菌表現出強抑制作用。土壤中的微生物群落結構失衡,尤其是土壤中真菌群落結構的變化是引起連作障礙的主要原因[10]。王艷芳等[11]研究了甲殼素對連作條件下平邑甜茶幼苗生長及土壤環境的影響,發現甲殼素對真菌的生長有明顯的抑制作用而對細菌的生長有促進作用;改變了土壤中微生物的群落結構,從而改善了連作土壤環境,有效緩解了平邑甜茶的連作障礙。本研究以甲殼素處理葡萄園土壤,采用細菌16S rDNA[細菌染色體上編碼16S rRNA(核糖體RNA)相對應的DNA序列]、真菌內轉錄間隔區(Internal Transcribed Spacer,ITS)測序,對土壤中的細菌和真菌種類組成及數量進行分析,從而了解甲殼素添加對葡萄園土壤微生物群落結構的影響。
1 材料與方法
1.1 土壤樣品采集
試驗在山東省萊西市沽河街道辦事處曲家莊村(葛洪強葡萄園)進行,試驗設置2個處理:①對照組,土壤中不添加甲殼素。②試驗組,土壤中添加甲殼素。各處理面積均為666.7m2。
試驗所用甲殼素為濟南阿波羅甲殼素肥業有限公司生產的963牌養根素(其主要成分為蝦蟹殼生產的殼聚糖,含量為60~80g/L),隨基肥施入,離植株60cm開30cm深的溝施入,每年1次,每666.7m2用量300g(折合純甲殼素的量),2009~2014年連續6年施入。
2015年進行土壤樣品采集。隨機選取添加甲殼素和未添加甲殼素的土壤區域,每個區域選3處取樣,每處采用對角線五點取樣法采集土壤樣品,將三次樣品混勻。取樣時去除地表面的植物等殘體,用土鏟垂直切開土壤,取0~20cm土層的土壤,挑出碎石、植物殘根后,將土壤樣本裝入無菌自封袋中,盡快帶回實驗室后送檢。應用Illumina Misq測序平臺(華大基因)進行分析。
1.2 高通量測序分析
基因測序的總體工作流程大致為:①土壤DNA粗提。土壤中微生物原基因組DNA的提取采用Mag-Bind Soil DNA Kit Protocol試劑盒(OMEGA)。②樣品PCR。分別利用細菌16S rDNA和真菌ITS通用引物進行擴增,擴增的PCR產物-20℃保存。③PCR產物進行瓊脂糖凝膠電泳分析。采用DL2000 Marker、1%的瓊脂糖凝膠,110V恒壓對PCR產物進行電泳35分鐘,凝膠成像儀觀察電泳結果。④高通量測序。使用Axy Prep DNA凝膠回收試劑盒對真菌、細菌的PCR擴增產物進行切膠回收。采用Life Qubit 3.0對純化后的PCR產物進行濃度定量,構建真菌、細菌文庫。將樣品(文庫)逐步稀釋到4nm,按1∶1加入氫氧化鈉室溫變性5分鐘,加入HT1 Buffer預冷,然后進行高通量上機測序[12]。
1.3 數據統計分析
下機后,采用雙峰(pair-end)測序法舍棄原始數據(Raw reads)中的低質量序列(保證50個連續堿基的平均質量大于Q30)。用Flash軟件,過濾對接上的序列(連續相同的堿基個數小于6,模糊堿基個數小于1),設計無法對接的序列,得到最終用于OTU(operational taxonomic unit)分析的序列(Clean reads)。
采用Uparse 軟件將相似度達97%以上的序列歸為一個操作分類單元即OTU;聚類所有序列(Ucl法),參照RDP(Ribosomal Database Project)數據庫,采用貝葉斯算法注釋每個分類中的OTU代表序列,得到每個OTU的分類學信息。分別利用Greengene、UNITE數據庫進行細菌及真菌的物種注釋。根據OTU使用mothur軟件進行Alpha多樣性分析,包括Observed species指數、Chao指數、Ace指數、Shannon指數、Simpson指數,使用R軟件(V3.1.1)繪制稀釋曲線、Rank abundance曲線、物種累積曲線。
2 結果與分析
2.1 OTU統計及豐度分析
物種豐富度是指群落中物種數目的多少。物種均勻度是指一個群落或環境中的全部物種數目個體數目的分配狀況;物種數目越多,多樣性越豐富,物種數目相同時,每個物種的個體數越平均,則多樣性越豐富[13]。OTU Rank曲線能夠體現樣品的物種多樣性,可以同時解釋樣品多樣性的兩個方面,即樣品所含物種的豐富度和均勻度。物種的豐富程度由曲線的橫軸長度來反映,曲線越寬,說明樣品中物種組成越豐富。樣品中物種的均勻度由曲線縱軸的形狀來反映,曲線越平坦,說明樣品中物種組成的均勻度越高。由圖1與圖2可知,試驗組的細菌和真菌OTU Rank曲線圖要比對照組的平坦且橫軸長度長。由此可得,試驗組所含細菌和真菌群落的均勻度和豐富度要比對照組好,而且細菌的物種群落要比真菌的豐富且均勻度更高。
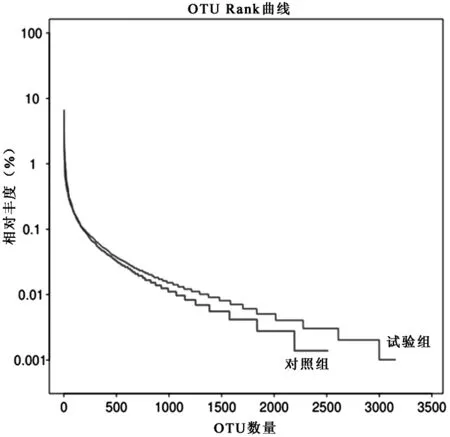
圖1樣品的細菌OTU Rank曲線圖
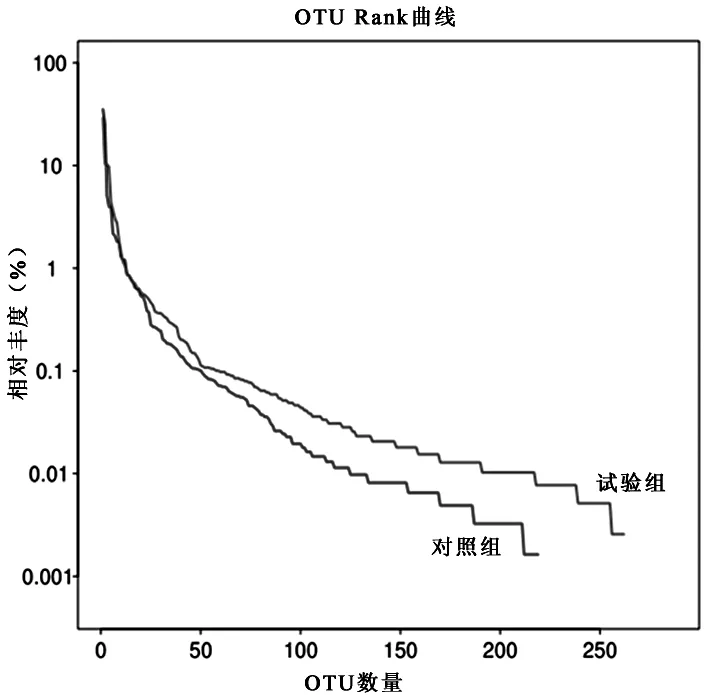
圖2 樣品的真菌OTU Rank曲線圖
2.2 Alpha多樣性分析
通過對供試土壤組進行16S rDNA及ITS高通量測序,共獲得747336條原始數據,700780條過濾數據。在97%相似度下,細菌獲得5661個OTU,真菌獲得481個OTU。每個土壤樣品的序列數及OTU數及Alpha多樣性值見表1。
由表1可知,試驗組的Observed species指數、Chao指數、Ace指數以及Shannon指數均比對照組的大,Simpson指數比對照組要小。Chao和Ace指數可反映群落物種豐富度,Shannon和Simpson指數可反映群落物種多樣性。與對照組相比,試驗組的細菌和真菌群落的物種豐富度高、均勻度大,具有更大的群落多樣性,即土壤微生物種類增多,有助于土壤有機質及養分的積累,有利于植物的生長發育與繁殖。
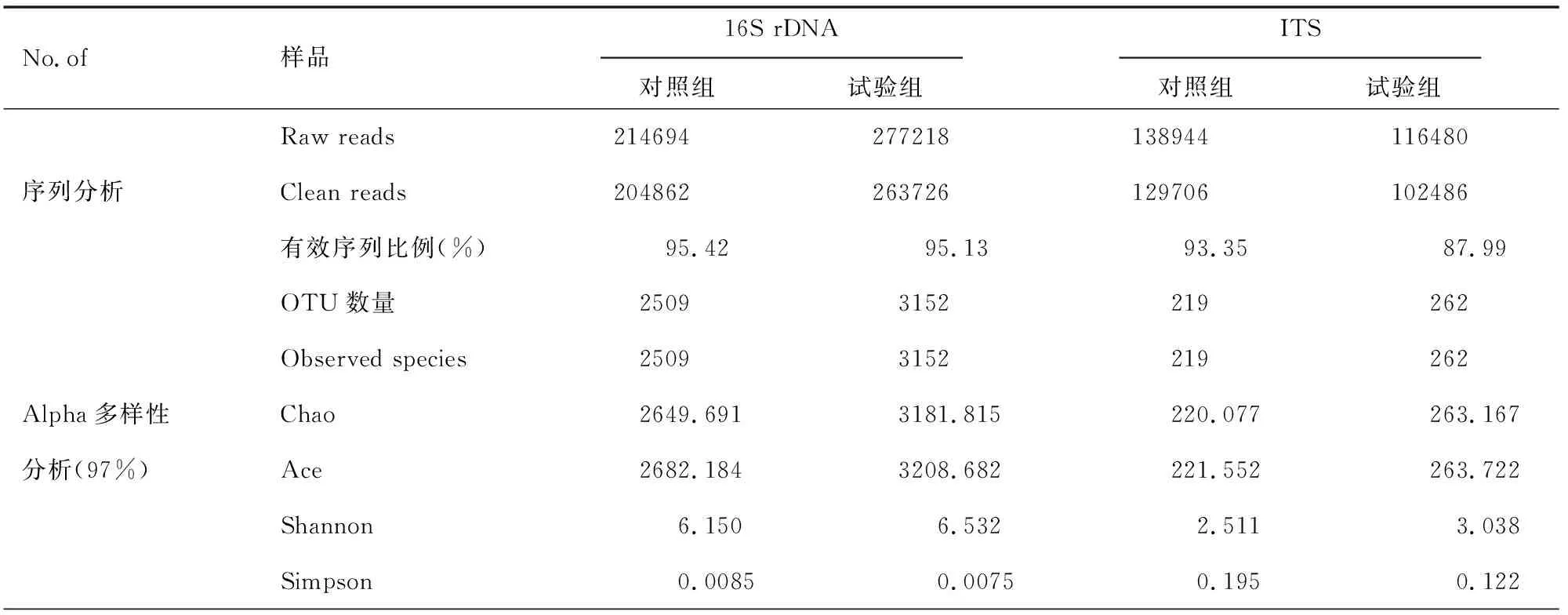
表1 葡萄園土壤測序序列和Alpha多樣性分析
2.3 物種注釋分析
由于樣品中所檢測出的微生物種類繁多,許多物種含量十分少,以物種的豐度大于0.5%作為劃分依據。由表2可得,對照組土壤中的細菌門類主要為變形菌門、酸桿菌門、浮霉菌門和厚壁菌門,試驗組土壤中的主要為變形菌門、酸桿菌門、厚壁菌門、擬桿菌門和浮霉菌門。加入甲殼素后,土壤中細菌群落相對豐度增加較大的是擬桿菌門和厚壁菌門,分別增加了193.52%和47.45%;泉古菌門和疣微桿菌門則分別減少了47.30%和46.61%。
由表3可得,試驗組與對照組相比,主要真菌中,子囊菌門增加了129.25%,擔子菌門增加了47.24%,接合菌門減少了80.06%。
從屬分類水平看,由表4可看出,兩組土壤樣品的細菌所占比例差距較大,試驗組的亞硝化螺菌假絲酵母屬、紅游動菌屬和慢生根瘤菌屬等所占比例明顯少于對照組,浮霉菌屬、腸球菌屬和芽孢桿菌屬等所占比例明顯多于對照組。
從表5可看出,在兩組樣品土壤微生物中,真菌種類大致相同,但試驗組的土赤殼屬、枝孢屬和外瓶霉屬等所占比例明顯低于對照組,紅酵母屬、蟲草屬、隱球菌屬和被孢霉屬等種類所占比例明顯高于對照組。
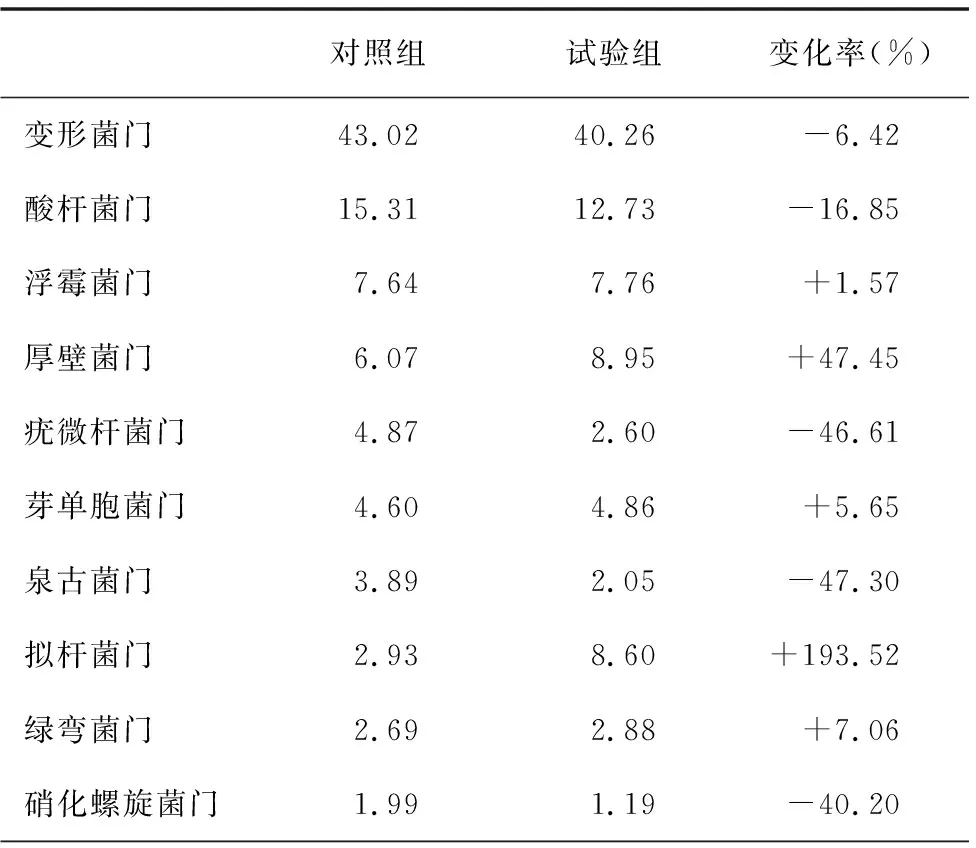
表2 對照組和試驗組門水平的細菌主要群落相對豐度(%)
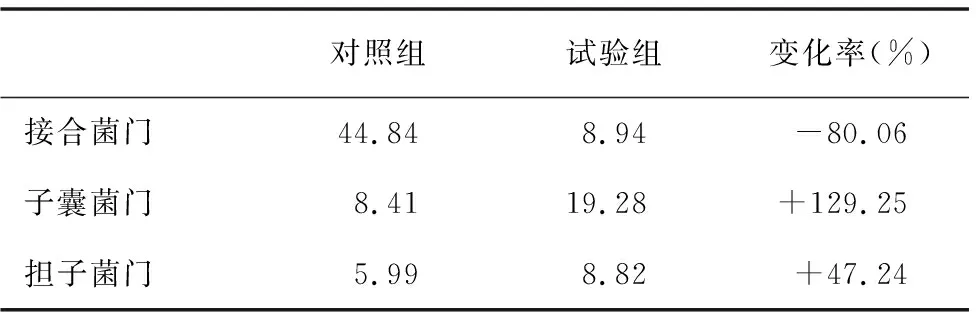
表3 對照組和試驗組門水平的真菌主要群落相對豐度(%)
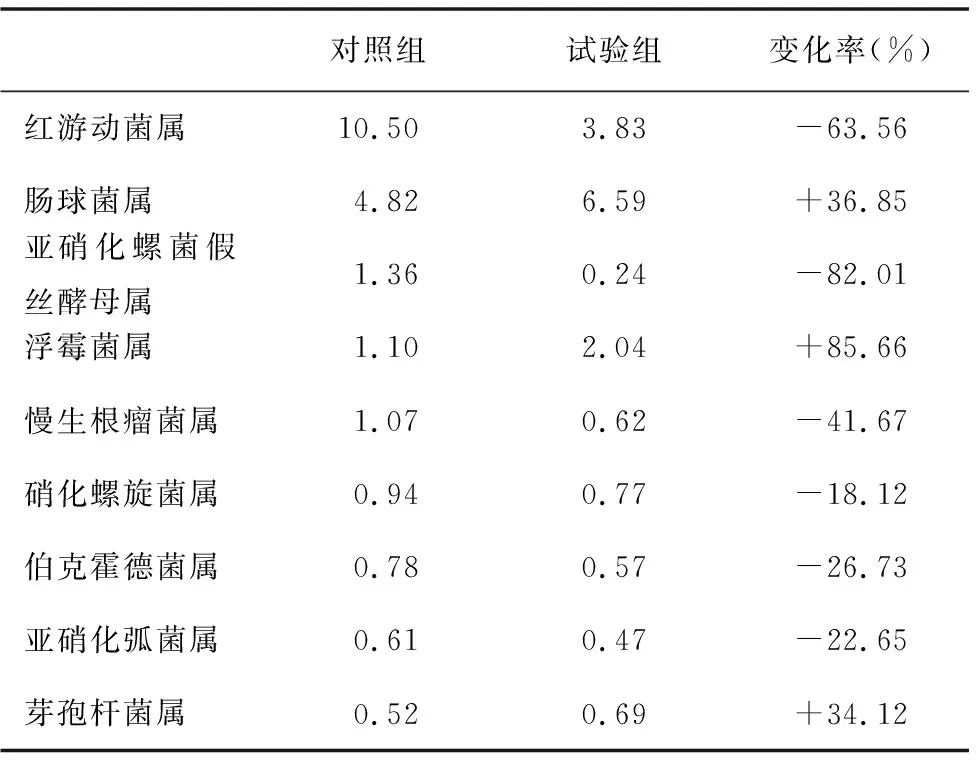
表4 對照組和試驗組屬水平的細菌主要群落相對豐度(%)
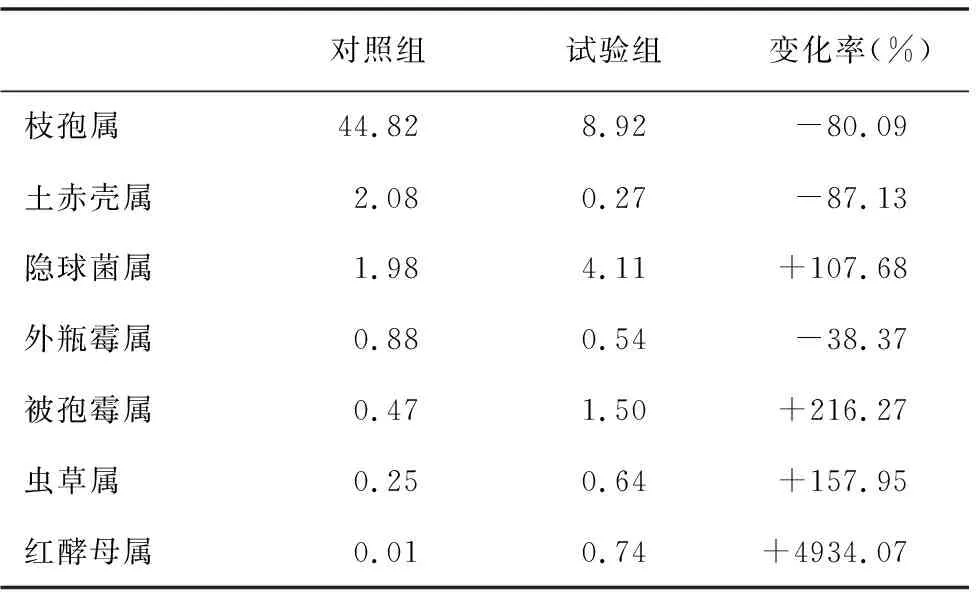
表5 對照組和試驗組屬水平的真菌主要群落相對豐度(%)
3 討論
本研究通過16S rDNA及ITS高通量測序,分析了添加甲殼素(試驗組)與未添加甲殼素(對照組)的土壤細菌與真菌群落結構差異。結果表明,添加甲殼素后,土壤中的細菌及真菌物種豐富度、均勻度及物種多樣性均有明顯的提高。土壤微生物是土壤生態系統的重要組成成分,主導著養分循環和能量流動,對維持系統的穩定性及可持續性具有重要作用[14],且微生物參與大約90%的土壤反應過程[15],故其種類的增多在一定程度上有助于土壤有機質及養分的積累,有利于植物的生長發育與繁殖。
添加甲殼素后,土壤中細菌與真菌中的微生物群落組成比例均有所變化。從門類水平來看,土壤中擬桿菌相對豐度明顯提高,擬桿菌門可以通過降解纖維素、果膠和其他復雜的碳氫化合物為植物提供特殊的營養[16];試驗組與對照組相比,絲狀真菌的相對豐度減少,說明甲殼素對絲狀真菌有一定的抑制作用,這與趙春燕[8]通過不同濃度的甲殼素灌根處理盆栽番茄來探究其對土壤微生物的影響研究相一致。從屬類水平來看,土壤中細菌浮霉菌屬、芽孢桿菌屬,真菌被孢霉屬的相對豐度明顯提高,而真菌枝孢屬的相對豐度明顯受到抑制。浮霉菌屬可以參與氮、碳、硫循環,進行多種循環代謝,富集礦物質,增強土壤肥力[17];芽孢桿菌屬可以代謝碳源[16],具有保濕、抑植物病菌的作用,對植物有促生作用[18];被孢霉屬能分解土壤中的糖類和簡單多糖[19],為植物提供營養元素;枝孢屬為植物致病菌,可寄生于植物各地上部分引起病害[20]。總的來說,甲殼素能夠增加土壤微生物的物種種類與生物量,提高大部分有益菌的相對豐度,抑制部分有害菌的生長,有利于土壤中有機質與營養的積累,改善土壤環境。

