兩步和三步法分離樣本資源庫抗凝血單個核細胞和血漿效果比較
叢 佳,徐 杰,代艷超,王子康,孫堅萍
(1.首都醫科大學附屬北京同仁醫院血液內科,北京 100730;2.首都醫科大學附屬北京佑安醫院,北京 100069)
轉化醫學[1-2]是目前醫學研究中的重點和熱點,而樣本庫資源庫則是轉化醫學研究的基石和重要組成部分。早在2009年北京市科委正式啟動疾病資源庫項目建設工作。北京佑安醫院以肝炎、艾滋病等傳染病人群為主體,建立了肝炎/艾滋病傳染病樣本資源庫[3-6]。在樣本資源庫中外周血單個核細胞(PBMC)和血漿是樣本資源庫儲存的重要樣本。PBMC包括B細胞、T細胞、NK細胞,單核細胞等,在評價免疫反應中至關重要[7],在疫苗研究[8-9]和臨床試驗中也具有重要意義[10-11];而血漿中各種細胞因子對評價機體炎性反應、腫瘤發生及轉移等具有重要作用。在樣本資源庫中對送檢標本如何處理會影響標本的質量。為更好地對標本進行質量控制,從而有利于后期科學研究,本研究比較了兩步和三步法分離外周血PBMC和血漿的效果,現報道如下。
1 材料與方法
1.1標本來源 收集首都醫科大學附屬北京佑安醫院2017年2月至2017年4月送入樣本資源庫的標本,標本來源者均已簽署知情同意書。均為當天采集的新鮮抗凝血,無手術期輸血、輸液等干擾分離效果的標本。
1.2分離外周血PBMC和血漿的方法 用乙二胺四乙酸抗凝管(貨號367525,BD公司)采集外周血6~8 mL,將送檢標本混勻后平均分為2份。一份標本直接加入到Ficoll淋巴細胞分離液(貨號AS1114546,Axis-Shield公司)中,2 200 r/min離心20 min后進行分離PBMC和血漿提取,即兩步法。見圖1A。一份標本2 200 r/min離心7 min后先提取血漿,再加入預溫的1640培養基(貨號SH30809.01B,Hyclone公司)稀釋到原來體積,加入到淋巴細胞分離液中2 200 r/min離心20 min后分離PBMC,即三步法。見圖1B。分離的PBMC加入適量RPIM-1640混合均勻洗滌后進行細胞計數,而血漿放置于-80 ℃冰箱備用。

注:A表示兩步法;B表示三步法
圖1不同處理方法示意圖
1.3細胞計數 采用吖啶橙(AO)/碘化丙啶(PI)染液(貨號CS2-0106-5ml,Nexcelom公司)對細胞進行計數,AO為浸潤性染料(膜通透性),可侵入活細胞與雙鏈DNA結合發出綠色熒光、與單鏈DNA(變性DNA)結合發出紅色熒光;PI為排斥性染料(膜不通透性),不能進入活細胞,與死亡或正在死亡(膜通透性改變)的細胞核酸結合,發出紅色熒光。AO/PI雙染色可區分活細胞與死亡細胞。具體操作:取PBMC懸液20 μL,與AO/PI染料按1∶1比例混勻;取20 μL混勻液加入到細胞計數板(貨號SD100,Nexcelom公司)中,然后插入到自動細胞計數儀(cellcounter,Nexcelom公司)中,自動計數活細胞數、總細胞數和細胞活性。
1.4檢測血漿中細胞因子水平 將凍存的血漿解凍后選取能評價炎癥、免疫狀態、腫瘤發生的27種血漿細胞因子,見表2。利用美國Biorad公司試劑盒進行檢測。根據試劑盒操作說明書采用Luminex高通量技術進行檢測,檢測儀器為美國Luminex 200液相懸浮芯片系統。

2 結 果
2.1不同方法分離PBMC效果比較 2種方法分離的活細胞數、總細胞數及活細胞比例結果相近,差異均無統計學意義(P>0.05)。見表1。
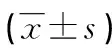
表1 不同方法分離PBMC效果比較
2.2不同方法對血漿細胞因子水平的影響比較 兩步法血漿細胞因子水平均低于三步法,除GM-CSF和IP-10外,其余25種細胞因子比較,差異均有統計學意義(P<0.05),見表2。

表2 不同方法對血漿細胞因子水平的影響比較

續表2 不同方法對血漿細胞因子水平的影響比較
3 討 論
由于樣本資源庫中的臨床樣本是不可再生的寶貴資源,而高質量臨床樣本對科學研究具有極其重要的意義[12]。如何科學、高效、標準化地采集、處理、儲存高質量樣本資源,建立高質量資源庫,使之更好地為轉化醫學服務至關重要[13]。樣本資源庫中標本分離方法對標本質量影響較大,本研究比較了兩步和三步法對PBMC分離和血漿細胞因子水平的影響。
從操作方面看,兩步法處理時間短,操作少于三步法。但在PBMC分離效果方面,在活細胞數、總細胞數及活細胞比例方面,兩步法與三步法的結果基本一致,差異均無統計學意義(P>0.05),提示在分離PBMC時可采取兩步法,這樣操作少且省時。也有研究對不同PBMC分離技術方法進行了比較,為利用PBMC而進行的下游應用研究提供了基礎,從而可選擇最佳PBMC分離方法[15]。
本研究比較了2種方法分離后的血漿細胞因子水平,結果顯示,兩步法分離血漿中的細胞因子水平均低于三步法,其中25種細胞因子比較,差異均有統計學意義(P<0.05),從表2可見,采取兩步法分離的血漿大部分細胞因子水平僅為三步法的2/3,甚至更低,這種差異會對后期研究造成極大影響。究其原因,可能在于兩步法分離的血漿,因為在分離血漿前就加入了淋巴細胞分離液,從而影響了血漿細胞因子水平,具體機制尚不清楚,有待于進一步的驗證研究;而本研究中無論是兩步法還是三步法,均采用了先進的Luminex高通量技術,其差異應該與檢測技術無關;而檢測的27種細胞因子則涵蓋了能反映炎癥、腫瘤發生及轉移等的各種白細胞介素、細胞集落刺激因子、干擾素、血管生長因子等,則2種方法之間的差異也應該不是細胞因子的選擇差異所致。提示如后期研究涉及血漿細胞因子水平,那么樣本庫標本的血漿分離應采用三步法進行處理。
有研究觀察了不同處理時間、不同處理溫度等條件對血漿收集的影響,結果顯示,代謝產物與時間相關,隨時間延長,代謝產物會增多,故建議分離血漿應在3 h內進行,在該時間段內代謝產物數據很穩定[14]。由此可見,在不同實驗條件下分離的血漿質量會有很大差異。
4 結 論
本研究結果顯示,兩步法與三步法比較,在分離和收集PBMC方面效果類似,且步驟簡單,可節省時間;但兩步法分離的血漿細胞因子受到很大影響,不能真實地反映血漿細胞因子水平。

