小麥根際土壤微生物數量對莖基腐病的影響
陸寧海 楊蕊 郎劍鋒

摘要:為探索小麥不同生長時期根際土壤微生物數量的動態變化規律,通過稀釋分離法分析健康植株和患病植株根際土壤真菌、細菌和放線菌數量。結果表明,患病植株根際土壤真菌種群數量在小麥不同生長時期比健康植株根際土壤真菌數量多,從返青期到成熟期,真菌種群數量逐漸增加,孕穗期達到最大值,健康植株根際土壤真菌數量為 10.21×103 CFU/g,患病植株根際土壤真菌數量為14.27×103 CFU/g。患病植株根際土壤細菌、放線菌數量在小麥不同生長時期比健康植株根際土壤細菌、放線菌數量少,從返青期到成熟期,種群數量逐漸增加,在揚花期達到最大值,健康植株根際土壤細菌數量為50.78×106 CFU/g,放線菌數量為28.44×103 CFU/g,患病植株根際土壤細菌數量為36.68×106 CFU/g,放線菌數量為22.67×103 CFU/g。因此,小麥莖基腐病的發生與根際土壤微生物數量有一定的關系,其中當真菌數量較多,細菌和放線菌數量較少時,有可能加重病害的發生。
關鍵詞:小麥莖基腐病;根際土壤;微生物;稀釋分離法
中圖分類號: S435.121.4 ?文獻標志碼: A ?文章編號:1002-1302(2019)22-0113-04
小麥莖基腐病(crown rot,簡稱CR)是由多種病原真菌引起的一種土傳病害,別稱旱地腳腐病(dry land foot rot)、鐮刀根腐病(Fusarium root rot)和鐮刀莖基腐病(Fusarium crown rot)等[1]。該病是一種世界性的重要病害,已有10多個國家報道其發生,包括美國、澳大利亞、意大利、土耳其、加拿大等[2]。在我國江蘇地區曾報道小麥莖基褐腐病的危害,但其病原以根腐蠕孢菌為主,與國外報道的以鐮刀菌為主要病原的小麥莖基腐病明顯不同[3]。Li等首次在我國報道了由假禾谷鐮刀菌(Fusarium pseudograminearum)引起的小麥莖基腐病[4]。有調查顯示,近年來,隨著秸稈還田及免耕少耕等耕作措施的大面積推廣,小麥莖基腐病在各大麥區發生普遍并造成了一定的經濟損失,已逐步引起重視[5-6]。
大量的研究表明,田間環境是影響病害發展和流行的重要因素,主要包括播期、土壤類型、土壤濕度、營養狀況等[7]。另外,品種抗性也在一定程度上影響發病程度。有研究表明,早播會使病害加重發生,而適當晚播可減輕病害的發生程度。莖基腐病在所有土壤類型中均可發生,尤以黏性土壤最為普遍。地勢低洼、排水不良可促進其發病[8]。土壤濕度是影響莖基腐病田間發病率和嚴重度的主要因素。濕潤的表層土壤是病害苗期侵染的必要條件,土壤濕度高有利于發病[9]。有資料顯示,小麥播種后遭遇陰雨天氣以及揚花期至成熟期遇到干旱天氣有利于莖基腐病的發生[10]。氮和鋅是影響莖基腐病發病率和發病嚴重程度的主要營養元素。施用氮肥過多、植物缺鋅均有利于小麥莖基腐病的發生[11-12],在莖基腐病嚴重發生的地區,適當增施鋅肥可有效減輕莖基腐病的發生。但有關根際土壤微生物數量對小麥莖基腐病的影響還未見報道。因此,本研究探討根際土壤微生物數量對小麥莖基腐病的影響。
1 材料與方法
1.1 根際土壤微生物的采集
試驗地點設在河南省新鄉市新鄉縣洪門鎮喬謝村的試驗田,在小麥生長返青期、拔節期、孕穗期、揚花期、成熟期分別采集患病和健康小麥植株根際土壤,采用5點取樣法,每點隨機選擇50株小麥,收集其根際土壤,輕抖帶土植株掉落土樣,該土樣為非根際土壤,黏附在植株根系上的土樣則為根際土壤[13]。采樣后將根際土壤裝入無菌袋中并編號,帶回實驗室后,將統一處理的5個樣品混合,將土樣過1 mm篩后放入 4 ℃ 環境下保存,用于根際土壤微生物的分離。
1.2 培養基的選擇
真菌的分離采用馬鈴薯葡萄糖(PDA培養基)培養基,細菌的分離采用牛肉膏蛋白胨培養基,放線菌的分離采用高氏一號合成培養基[14]。
馬鈴薯葡萄糖培養基配方[15]:200 g馬鈴薯,10~20 g葡萄糖,17~20 g瓊脂,1 000 mL自來水,自然pH值。
牛肉膏蛋白胨培養基配方[14]:3 g牛肉浸膏,5~10 g蛋白胨,1 000 mL水,17~20 g瓊脂,自然pH值。
高氏一號合成培養基配方[14]:20 g可溶性淀粉,1.0 g KNO3,0.5 g K2HPO4,0.5 g MgSO4·7H2O,0.5 g NaCl,0.01 g FeSO4·7H2O,1 000 mL水,20 g瓊脂,自然pH值。
1.3 根際土壤微生物的分離
(1)用稀釋分離法[16]從根際土壤中分離細菌。將牛肉膏蛋白胨培養基放在微波爐里加熱,待完全融化后取出,在無菌操作臺上倒空白平板。冷凝后,用微量移液槍吸取已經梯度稀釋過的土壤懸浮液中,從低濃度到高濃度依次吸取10-6、10-5、10-4各0.1 mL,用涂抹棒涂抹均勻。置于28 ℃培養箱中培養,在第2天至第7天每天觀察統計細菌菌落數量與種類。
(2)用稀釋分離法[16]從根際土壤中分離真菌。將滅過菌的250 mL PDA培養基放在微波爐里加熱,待完全融化后取出,加入1 mL鏈霉素,輕搖,使鏈霉素與培養基充分混勻,然后倒空白平板。冷凝后,用微量移液槍吸取已經梯度稀釋過的土壤懸浮液,從低濃度到高濃度依次取10-3、10-2、10-1各 0.1 mL,用涂抹棒涂抹均勻。置于25 ℃培養箱中培養,在第2天至第7天每天觀察統計真菌菌落數量與種類。
(3)用稀釋分離法[16]從根際土壤中分離放線菌。將高氏一號合成培養基放在微波爐里加熱,待完全融化后取出,在無菌操作臺上倒空白平板。冷凝后,用微量移液槍吸取已經梯度稀釋過的土壤懸浮液,從低濃度到高濃度依次取10-3、10-2、10-1各0.1 mL,用涂抹棒涂抹均勻。放在28 ℃培養箱中培養,在第2天至第7天每天觀察統計放線菌菌落數量與種類。每個處理重復3次,土壤中微生物數量以每克土壤樣品所含的菌落數表示,單位為CFU/g。試驗所用器材均為事先滅過菌的。
1.4 小麥莖基腐病發病情況調查
在小麥返青期、拔節期、孕穗期、揚花期、成熟期分別調查記錄各小區小麥莖基腐病的發病情況,按對角線5點取樣法進行,每點取50株,調查小麥莖基腐病的發生情況。按莖基腐病的發病程度分為0~5級,即0級:無明顯癥狀;1級:第1葉鞘褐枯小于葉鞘長度10%;2級:第1葉鞘褐枯占葉鞘長度11%~25%;3級:第1葉鞘褐枯占葉鞘長度26%~50%;4級:第2葉鞘有明顯褐枯;5級:第3葉鞘有明顯褐枯或全株枯死[17]。然后計算發病率和病情指數[18]。
病情指數=100×∑(各級病葉數×各級代表值)/(調查總葉數×最高級代表值);
發病率=調查染病株數/調查總株數×100%。
2 結果與分析
2.1 小麥莖基腐病在不同時期的發病率和病情指數分析
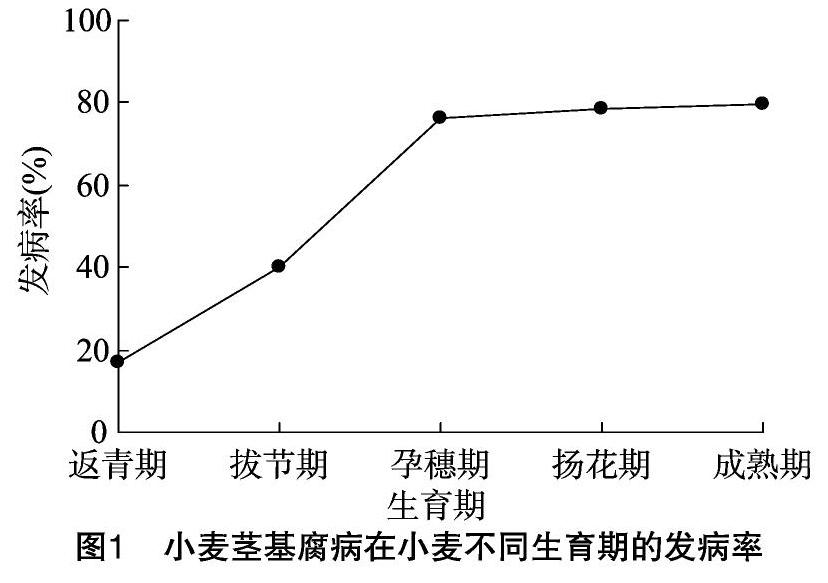
由圖1可知,在小麥的整個生育期中,小麥莖基腐病的發生呈先迅速上升而后趨于平穩的變化動態。從返青期到孕穗期,莖基腐病的發生流行較快,返青期、拔節期、孕穗期的發病率分別為17.11%、40.12%、76.26%,在孕穗期達到高峰,孕穗期后發病率相對穩定,揚花期、成熟期的發病率分別為 78.33%、79.54%。
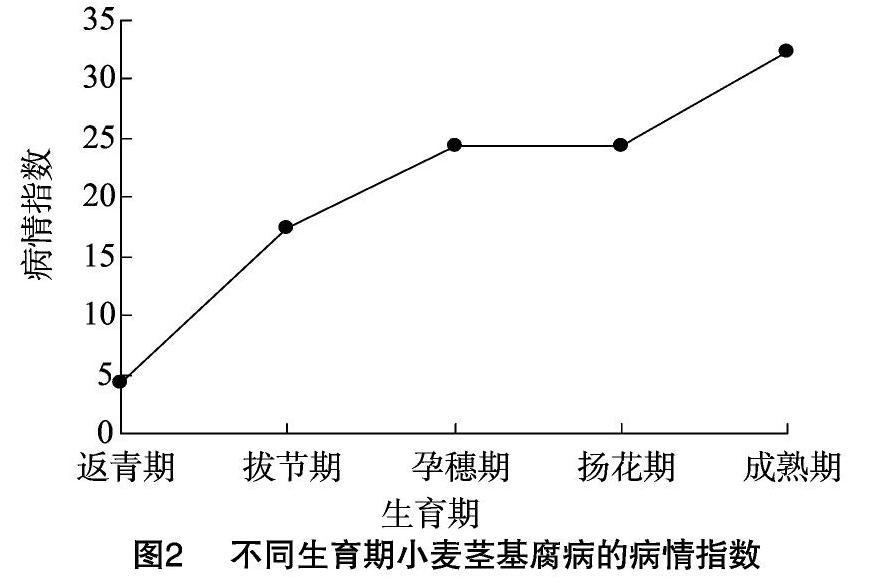
由圖2可知,在小麥的不同生長發育時期,小麥莖基腐病的病情指數(即嚴重度)呈持續上升趨勢,在成熟期達到高峰。從返青期到拔節期,小麥的病情指數急劇增長,從4.24增長到17.43,孕穗期、揚花期、成熟期,病情逐漸加重,但增幅較小,病情指數分別為24.33、27.41、32.41。
2.2 小麥返青期根際土壤微生物的數量分析
由表1可知,返青期患病小麥植株根際土壤與健康小麥植株根際土壤中的微生物數量有顯著差異。小麥返青期健康小麥根際土壤中的細菌數量明顯比患病小麥根際土壤中的細菌數量多,健康植株根際土壤中的細菌數量為4.64×106 CFU/g,患病植株根際土壤中的細菌數量為3.23×106 CFU/g;患病小麥根際土壤中的真菌數量明顯比健康小麥根際土壤中的真菌數量多,健康小麥根際土壤中的真菌數量為1.67×103 CFU/g,患病小麥根際土壤中的真菌數量為3.51×103 CFU/g;健康小麥根際土壤中放線菌的數量明顯比患病小麥根際土壤中放線菌的數量多,健康小麥根際土壤中放線菌的數量為1.32×103 CFU/g,患病小麥根際土壤中放線菌的數量為 1.06×103 CFU/g。
2.3 小麥拔節期根際土壤微生物的數量分析
由表2可知,拔節期患病小麥植株根際土壤與健康小麥植株根際土壤中的微生物數量有顯著差異。小麥拔節期健康植株根際土壤中的細菌數量明顯比患病植株根際土壤中的細菌數量多,健康植株根際土壤中的細菌數量為14.35×106 CFU/g,患病植株根際土壤中的細菌數量為10.12×106 CFU/g;患病植株根際土壤中的真菌數量明顯比健康植株根際土壤中的真菌數量多,患病植株根際土壤中的真菌數量為5.98×103 CFU/g,健康植株根際土壤中的真菌數量為3.74×103 CFU/g;健康植株根際土壤中放線菌的數量明顯比患病植株根際土壤中放線菌的數量多,健康植株根際土壤中放線菌的數量為5.12×103 CFU/g,患病植株根際土壤中放線菌的數量為 4.18×103 CFU/g。
2.4 小麥孕穗期根際土壤微生物的數量分析
由表3可知,孕穗期患病小麥植株根際土壤與健康小麥植株根際土壤中的微生物數量有顯著差異。小麥孕穗期健康植株根際土壤中的細菌數量明顯比患病植株根際土壤中的細菌數量多,健康植株根際土壤中的細菌數量為32.69×106 CFU/g,患病植株根際土壤中的細菌數量為19.79×106 CFU/g;患病植株根際土壤中的真菌數量明顯比健康植株根際土壤中的真菌數量多,患病植株根際土壤中的真菌數量為11.26×103 CFU/g,健康植株根際土壤中的真菌數量為8.62×103 CFU/g;健康植株根際土壤中放線菌的數量明顯比患病植株根際土壤中放線菌的數量多,健康植株根際土壤中放線菌的數量為13.78×103 CFU/g,患病植株根際土壤中放線菌的數量為 11.56×103 CFU/g。
2.5 小麥揚花期根際土壤微生物的數量分析
由表4可知,揚花期患病小麥植株根際土壤與健康小麥植株根際土壤中的微生物數量有顯著差異。小麥揚花期健康植株根際土壤中的細菌數量明顯比患病植株根際土壤中的細菌數量多,健康植株根際土壤中的細菌數量為50.78×106 CFU/g,患病植株根際土壤中的細菌數量為36.68×106 CFU/g;患病植株根際土壤中的真菌數量明顯比健康植株根際土壤中的真菌數量多,患病植株根際土壤中的真菌數量為14.27×103 CFU/g,健康植株根際土壤中的真菌數量為10.21×103 CFU/g;健康植株根際土壤中放線菌的數量明顯比患病植株根際土壤中放線菌的數量多,健康植株根際土壤中放線菌的數量為28.44×103 CFU/g,患病植株根際土壤中放線菌的數量為 22.67×103 CFU/g。
2.6 小麥成熟期根際土壤微生物的數量分析
由表5可知,成熟期患病小麥植株根際土壤與健康小麥植株根際土壤中的微生物數量存在顯著差異。小麥成熟期健康植株根際土壤中的細菌數量明顯比患病植株根際土壤中的細菌數量多,健康植株根際土壤中的細菌數量為35.14×106 CFU/g,患病植株根際土壤中的細菌數量為28.95×106 CFU/g;患病植株根際土壤中的真菌數量明顯比健康植株根際土壤中的真菌數量多,患病植株根際土壤中的真菌數量為11.17×103 CFU/g,健康植株根際土壤中的真菌數量為9.56×103 CFU/g;健康植株根際土壤中放線菌的數量明顯比患病植株根際土壤中放線菌的數量多,健康植株根際土壤中放線菌的數量為21.56×103 CFU/g,患病植株根際土壤中放線菌的數量為 19.79×103 CFU/g。
參考文獻:
[1]周海峰,楊 云,牛亞娟,等. 小麥莖基腐病的發生動態與防治技術[J]. 河南農業科學,2014,43(5):114-117.
[2]Burgess L W,Backhouse D,Summerell B A,et al. Crown rot of wheat[M]. Paul:Aps Press,2001:271-294.
[3]李 偉,陳 瑩,張曉祥,等. 小麥莖基褐腐病病原菌組成及其致病力研究[J]. 麥類作物學報,2011,31(1):170-175.
[4]Li H L,Yuan H B. First report of Fusarium pseudograminearum causing crown rot of wheat in Henan,China[J]. Plant Disease,2012,96(7):1065.
[5]陳厚德,王彰明,袁樹忠,等. 小麥莖基褐腐病的發生特點及其對產量的影響[J]. 揚州大學學報(自然科學版),2001,4(4):43-46.
[6]李冬梅,曹克強,王愛英,等. 河北省小麥根病發生現狀及致病病原種類調查[J]. 河北農業大學學報,2001,24(3):38-42.
[7]Klein T A,Burgess L W,Ellison F W. The incidence of crown rot in wheat,barley and triticale when sown on two dates[J]. Australian Journal of Experimental Agriculture,1989,29(4):559-563.
[8]Wallwork H. Cereal root and diseases[M]. Adelaide:Sardi-Grdc Press,1996:26-31.
[9]Klein T A. Burgess L W,ellison F W.The incidence and spatial patterns of wheat plants infectd by Fusarium graminearum gyoup1 and the effect of crown rot on yield[J]. Australain Journal of Agricultural Research,1991,42(3):399-407.
[10]Paulitz T C,Smiley R W,Cook R J. Insights into the prevalence and management of soilbome cereal pathogens under direct seeding in the Pacific Northwest,U.S.A.[J]. Canadian Journal of Plant Pathology,2002,24(4):416-428.
[11]Verrell A,Moore K J,Backhouse D,et al. Water and Nitrogen affect the incidence and severity of crown rot in wheat[M]. Tamworth:Nsw Agriculture Press,2003:63-64.
[12]Sparrow D H,Graham R D. Susceptibility of zine-deficient wheat plants to colonization by Fusarium graminearum Schw.group1[J]. Plant and Soil,1988,112(2):261-266.
[13]Maaritn R,Heiskanen I,Walleniusk,et al. Extraction and purification of DNA in rhizosphere soil samples for PCR-DGGE analysis of bacteria consortia[J]. Journal of Microbiological Methods,2001,45(3):155-165.
[14]徐瑞富,陸寧海,楊 蕊,等. 土壤類型及生育時期對小麥根際土壤微生物數量的影響[J]. 河南農業科學,2013,42(12):75-78.
[15]陸寧海,徐瑞富,吳利民,等. 不同培養基對小麥紋枯病菌生長繁殖及致病力的影響[J]. 中國農學通報,2005,21(2):262-263,283.
[16]向萬勝,吳金水,肖和艾,等. 土壤微生物的分離、提取與純化研究進展[J]. 應用生態學報,2003,14(3):453-456.
[17]張 鵬,霍 燕,周淼平,等. 小麥禾谷鐮孢菌莖基腐病抗源的篩選與評價[J]. 植物遺傳資源學報,2009,10(3):431-435.
[18]孫海燕,李 琦,杜文珍,等. 不同殺菌劑拌種防治小麥全蝕病研究[J]. 植物保護,2012,38(3):155-158,175.

