微生物去除土壤阿特拉津污染及黃瓜根系的氧化應激反應
劉丹丹 劉暢


摘要:以莠去津降解菌和硅藻土為試材制備修復菌劑,通過對菌體存活率的測定,研究菌劑對貯藏時間、溫度和紫外線的耐受能力。同時采用盆栽試驗方法,測定菌劑對莠去津的去除效果,并比較菌劑施用前后黃瓜根部丙二醛(MDA)、過氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)等氧化應激指標的變化。結果表明,菌劑在室溫條件下存放28 d后,菌體存活率仍高達83%,對高溫和紫外線照射也表現出較強的抗性。盆栽試驗中,菌劑施用28 d后,莠去津的去除率最高,接近80%。氧化應激指標變化表明,菌劑能夠減少黃瓜根部MDA積累,提高POD、PPO和SOD活性。不難看出,以硅藻土為載體的修復菌劑性狀良好,不僅能夠高效去除土壤中的莠去津殘留,還能減輕莠去津對敏感作物的傷害作用。
關鍵詞:莠去津;黃瓜;生物修復;環境脅迫;PPO;SOD;POD;MDA
中圖分類號: X592 ?文獻標志碼: A ?文章編號:1002-1302(2019)22-0307-03
莠去津是在世界范圍內都有廣泛應用的除草劑,應用后在環境中持久存在,且具有毒性[1]。它在環境中的高殘留常對其他作物造成毒害,帶來嚴重的經濟損失[2]。在治理莠去津污染的過程中,生物修復以成本低廉、操作簡便、處理效果好和無二次污染等優點,成為眾多治理方法中的首選[3]。但生物修復方法的應用,受環境條件限制,如溫度、光照、水分、pH值和土壤性質等,均能影響污染修復效果[4]。選擇合適的載體材料,制成生物修復菌劑技術,不僅能夠提高菌體對不良環境條件的抗性,還能保證污染治理效果。硅藻土對環境友好,成本低,易獲得,亦是常見的載體材料,將其與莠去津降解菌制成修復菌劑,對莠去津的污染治理具有重要意義。
有研究表明,當土壤中莠去津含量超過0.1 mg/kg時,將嚴重影響敏感作物的生長[5]。黃瓜是常見的蔬菜,其種植面積大,對莠去津敏感。黃瓜抗氧化防御酶活性變化與所處環境條件密切相關,其活性的提高可以增強植物對逆境的耐受能力,是降低和修復逆境傷害的重要生理生化指標[6]。了解莠去津脅迫下敏感作物的生理響應,對于減輕植物傷害、揭示微生物修復機制都有重要意義。
1 材料與方法
1.1 試驗材料
1.1.1 供試藥劑 莠去津,市售商品,濃度為97%。
1.1.2 供試黃瓜 粵秀3號,市售商品。挑選大小均一的飽滿籽粒,催芽露白后播種,待植株生長至2~3張復葉時進行試驗。
1.1.3 試驗菌株 莠去津降解菌Enterobacter sp.(腸桿菌屬),由沈陽化工大學環境科學實驗室篩選并保存。菌株采用無機鹽液體培養基(每1 000 mL含K2HPO4 1.6 g、KH2PO4 0.4 g、MgSO4 0.2 g、NaCl 0.1 g、葡萄糖3 g、莠去津0.1 g)培養24 h,并制成生物量為2×108 CFU/mL的菌液。
1.1.4 載體材料 硅藻土,市售,粒徑為3~6 mm,呈灰白色,經121 ℃高壓滅菌30 min,65 ℃烘干備用。
1.2 試驗方法
1.2.1 菌劑制備及性能測定 菌劑制備:向硅藻土中噴灑 2×108 CFU/mL 菌液并混勻,用量約為60 mL菌液/100 g硅藻土,制成菌劑,并于廣口瓶中避光保存。存活率測定:28 d后,取0.1 g菌劑放入 100 mL 無菌水中,30 ℃振蕩培養2 h,進行平板涂布,測定活菌數,計算菌體存活率。溫度對菌體存活的影響:在15、25、40、60 ℃條件下,將菌劑放置2、7、14、21、28 d后,振蕩培養,測定菌體存活率。紫外線照射對菌體存活的影響:將菌劑平鋪,放置于紫外燈下(波長312 nm,功率10 W),照射0、20、40、60、80 min,振蕩培養后,測定菌體存活率。各試驗均設5次重復,以游離菌為對照。菌體存活率=測得活菌數/接種細菌數×100%。
1.2.2 菌劑對土壤中莠去津的去除與黃瓜根系防御酶活性的測定 取不含莠去津的農田表層土壤,過2 mm篩后風干備用。土壤做3組處理,即污染土壤(莠去津10 mg/kg)、添加菌劑土壤(按土壤質量1%向污染土壤中添加菌劑)和空白對照。將處理好的土壤裝入塑料花盆中,裝土量約200 g/盆,黃瓜4株/盆,在25 ℃培養箱中避光保存,保持土壤含水率在70%左右,0、7、14、28、35 d后,檢測土壤中莠去津殘留量和黃瓜根系防御酶活性。粗酶提取參考薛應龍的方法[7],丙二醛(MDA)含量測定采用Chen等的方法[8],過氧化物酶(POD)活性測定采用張志良等的方法[9],多酚氧化酶(PPO)活性測定采用段春梅等的方法[10],超氧化物歧化酶(SOD)活性測定采用Giannopolitis等的方法[11]。
1.3 數據分析
試驗數據采用SPSS 22.0和Excel 2010統計完成。
2 結果與分析
2.1 菌劑制備和性能測定結果
硅藻土具有大量微孔,其比表面積大,菌體負載能力和吸水能力強,并能吸收和分散太陽光,保護菌體免受不良環境條件傷害,保證菌體的有效活菌數。經測定,在菌劑制成并存放28 d后,其菌體存活率約為80%。溫度對微生物生命活動的影響很大,直接影響菌劑的施用效果,因此,要考察不同溫度條件下,菌劑中有效活菌數的變化情況。從菌劑制備完成至存放28 d,菌體存活率情況見表1。由表1可知,在較低溫度 15 ℃ 時,菌劑保存28 d后,檢測其活菌率較高,約為83%;25 ℃ 下,隨著時間延長,活菌率下降,28 d時為80%;在較高溫度40和60 ℃時,菌劑中活菌數量顯著降低,28 d時分別降至33%和12%。
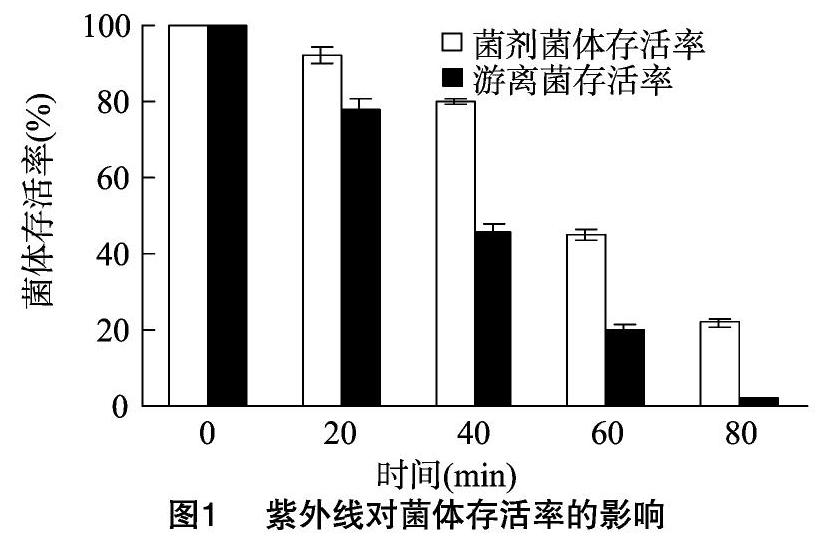
紫外線具有殺菌能力,細菌直接暴露在陽光下,其數量和功能都會降低,而硅藻土的特殊結構可以吸收分散陽光輻射,為細菌提供保護場所。本試驗考察了菌劑受不同時間的紫外線照射后,菌體的存活情況。由圖1可知,在相同處理時間,菌劑中的菌體存活率均高于游離菌。紫外線照射 20 min后,菌劑中菌體存活率為92%,對照中游離菌的存活率為78%;紫外線照射80 min后,菌劑中菌體存活率為22%,對照中游離菌的存活率已下降至1.8%。不難看出,以硅藻土為載體制成的莠去津修復菌劑對紫外線的耐受力較強。
2.2 菌劑對土壤中莠去津的去除效果
由圖2可知,在不同修復時間,土壤中添加菌劑后莠去津殘留量一直低于不添加菌劑的污染土壤。施入菌劑28 d時,土壤中莠去津含量接近最低,約為2.0 mg/kg,去除率接近80%,而污染土壤中莠去津殘留量仍高達8.2 mg/kg。
2.3 菌劑對黃瓜根系防御酶的影響
不利的環境條件會刺激植物產生某些代謝反應以降低或修復逆境帶來的傷害,黃瓜抗氧化防御酶活性的增強,可以提高植物的抗逆性,抗氧化防御酶系被認為是其對環境脅迫響應的重要指標。在利用修復菌劑進行土壤污染修復的過程中,檢測不同處理時間下的黃瓜根系MDA含量與POD、PPO、SOD活性。由圖3至圖6可知,在僅含莠去津的污染土壤中,MDA積累量較對照明顯增加,說明黃瓜根系受害嚴重,添加菌劑后MDA含量有所下降。POD、PPO和SOD活性在不添加菌劑的污染土壤中最低,添加菌劑后,活性均有不同程度的升高,表明黃瓜的傷害狀況得到了一定程度的緩解。
3 討論與結論
從菌劑制備及其性能測定結果可以看出,以硅藻土為載體制備的修復菌劑,在耐貯藏、高溫和紫外線等方面,性能良好,對土壤中的莠去津殘留有較好的修復效果。
MDA是膜脂過氧化過程中形成的產物,其含量能夠很好地反映細胞膜損傷程度[12]。POD是植物中廣泛存在的酶,是反映根系活力的重要指標。PPO的作用是進行去甲基化反應,與生長素(IAA)含量和植物根系生長有關[13]。SOD在清除體內活性氧方面有重要作用,可避免植物的傷害作用[14]。對比菌劑施用前后黃瓜根系氧化應激指標的變化情況可知,在菌劑處理土壤中,MDA含量降低,POD、PPO和SOD活性都有明顯升高,表明莠去津對黃瓜的傷害作用得到了緩解。
參考文獻:
[1]周 寧. 除草劑莠去津污染土壤的植物修復研究[J]. 北方園藝,2014(6):166-168.
[2]宋 日,劉 利,馬麗艷,等. 阿特拉津對不同種子大小品種大豆的危害[J]. 中國油料作物學報,2013,35(2):207-210.
[3]Fan X X,Song F Q. Bioremediation of atrazine:recent advances and promises[J]. Journal of Soils and Sediments,2014,14(10):1727-1737.
[4]Zhou X D,Wang Q F,Wang Z,et al. Nitrogen impacts on atrazine-degrading Arthrobacter strain and bacterial community structure in soil microcosms[J]. Environmental Science and Pollution Research,2013,20(4):2484-2491.
[5]楊彩宏,馮 莉,田興山. 莠去津土壤殘留對4種蔬菜生長及葉綠素熒光參數的影響[J]. 中國蔬菜,2016(3):53-59.
[6]馬兵兵,姜 昭,Kehinde,等. 狼尾草根系對阿特拉津長期脅迫的氧化應激響應[J]. 生態毒理學報,2016,11(6):214-222.
[7]上海植物生理學會. 植物生理學實驗手冊[M]. 上海:上海科學技術出版社,1985.
[8]Chen Y S,Wu C F,Zhang H B,et al. Empirical estimation of pollution load and contamination levels of phthalate esters in agricultural soils from plastic film mulching in China[J]. Environmental Earth Sciences,2013,70(1):239-247.
[9]張志良,瞿偉箐. 植物生理學實驗指導[M]. 3版.北京:高等教育出版社,2003.
[10]段春梅,薛泉宏,趙 娟,等. 放線菌劑對黃瓜幼苗生長及葉片PPO活性的影響[J]. 西北農業學報,2010,19(9):48-54.
[11]Giannopolitis C N,Ries S K. Superoxide dismutases Ⅰ.Occurrence in higher plants[J]. Plant Physiology,1977,59(2):309-314.
[12]Chiang Y J,Wu Y X,Chiang M Y,et al. Role of antioxidative system in paraquat resistance of tall fleabane (Conyza sumatrensis)[J]. Weed Science,2008,56(3):350-355.
[13]高桂鳳,王俊玲,楚海嬌. 阿特拉津降解酶的提取及酶活性分析[J]. 北方園藝,2016,40(14):94-96.
[14]竇俊輝,喻樹迅,范術麗,等. SOD與植物脅迫抗性[J]. 分子植物育種,2010,8(2):359-364.

